七氟醚后处理调控cAMP/PKA信号通路减轻大鼠心肌缺血再灌注损伤的机制研究*
陈 倩,李查兵,康 路
(安徽省第二人民医院麻醉科,合肥 230041)
心血管疾病是全球发病率和病死率极高的疾病之一[1]。在临床实践中,心脏手术引起心肌缺血,导致心脏损害,再灌注期血流恢复后心肌再次受到损伤,这个过程被称为缺血再灌注(I/R)损伤[2]。心肌I/R 主要发生在心肌梗死、冠心病、脑卒中等心血管疾病患者中[3]。心肌缺血后导致心脏供氧不平衡,进一步导致心脏组织功能障碍。缺血后再灌注会恢复缺血心肌的血流量,这一过程会导致心肌细胞死亡,增加心肌梗死面积[4]。心肌I/R 是导致心血管疾病患者预后生存差的主要原因之一[5],因此,探究心脏I/R 的发生机制,对提高患者存活率具有重要意义。
七氟醚是目前在临床上广泛应用的麻醉剂。近期的研究发现,使用七氟醚预处理后可从一定程度上改善脑损伤,进而起到神经保护作用[6]。有研究表明,七氟醚对线粒体功能具有保护作用,并减轻肝脏损伤[7]。但目前对于七氟醚在心肌I/R 中具体的保护机制尚未深入探究。环磷腺苷(cAMP)/蛋白激酶A(PKA)通路属于环核苷酸系统,是细胞内经典传导途径之一。cAMP 反应元件结合蛋白(cy‐clic-AMP response binding protein,CREB)由341 个氨基酸残基构成,是富含亮氨酸拉链结构的超家族成员。cAMP/PKA 通路活化后可改善I/R 左心室收缩力,进而保护心肌[8]。本研究通过复制I/R 损伤大鼠模型,旨在探究七氟醚在心肌I/R 中的作用及其机制。
1 材料与方法
1.1 实验动物 健康成年雄性SD 大鼠80 只,体重250~300 g,SPF 级,由湖南斯莱克景达实验动物公司提供。动物置于温度18~26 ℃,相对湿度40%~70%环境中,分笼饲养,以标准饲料及无菌水饲养1 周。本实验动物处置方法符合安徽省第二人民医院动物伦理学标准,审批号:201906051。
1.2 实验分组 将60只大鼠随机分为5组,每组12只,分别为假手术组(左冠状动脉前降支穿线,不结扎)、I/R组(结扎左冠状动脉前降支,缺血30 min,再灌注2 h)、七氟醚后处理(S-post)组(结扎左冠状动脉前降支,缺血30 min,于缺血末至再灌注开始吸入2.4%七氟醚15 min,再灌注2 h)、H89 组(实验前24 h 腹腔注射PKA 抑制剂H8920 nmol/mL,后续操作同I/R 组)及S-post+H89 组(实验前24 h 腹腔注射PKA 抑制剂H89 20 nmol/mL,后续操作同S-post组)。成年大鼠七氟醚的最低肺泡有效浓度(MAC值)为2.4%~2.5%,再参照文献,本文采用缺血处理后吸入2.4%的七氟醚15 min再灌注2 h作为大鼠模型的建立方法[9]。
1.3 大鼠心肌I/R 模型的建立 所有大鼠术前禁食12 h,自由饮水,腹腔注射3%戊巴比妥钠50 mg/kg麻醉大鼠,仰卧固定后,在颈部正中切口,3~4 气管环切开并插人气管导管,连接小动物呼吸机行机械通气,吸入氧浓度33%(呼吸频率60 次/min,潮气量5~7 mL/100 g,吸呼比为1∶2,氧流量为1 L/min)。气管插管后,大鼠右侧颈内静脉及颈内动脉置充满肝素管,并维持动脉血气指标。备皮,络合碘消毒,经左侧第5 肋间逐层钝性分离并打开心包暴露心脏,用7-0 缝合线(山东博达医疗用品股份有限公司)穿过左冠状动脉前降支,稳定30 min 后结扎,以心外膜发绀苍白、心电图提示ST 段抬高,T 波高耸为缺血成功。缺血30 min 后,松开结扎线使左冠状动脉前降支血流恢复,并持续2 h。当心电图提示ST 段回落和T 波恢复,心肌组织逐渐转红,说明再灌注成功。
1.4 心功能指标检测 灌注结束时,采用Powerlab/8SP数据采集系统收集左心室发展压(LVDP)、左心室舒张末期压(LVEDP)以及最大左心室增加速率(+dp/dtmax)。
1.5 心肌梗死面积测量 再灌注结束后取心脏,去除心房组织,2~3 mm 厚切片,1% 2,3,5-三苯基氯化四氮唑(TTC,索莱宝科技有限公司)染色,避光恒温孵育25 min,PBS 缓冲液洗涤,4%甲醛固定24 h。梗死区被染为灰白色,非梗死区染为砖红色。拍摄图像后用Image J软件计算梗死面积。
1.6 Western blotting 法检测PKA、CREB、Bax 及Bcl-2 蛋白表达 取大鼠左心室心肌组织,剪碎,加入蛋白裂解液和磷酸酶抑制剂(北京索莱宝),4 ℃下超声匀浆,离心,收集上清后BCA 法测定蛋白浓度。取30 µg 心肌组织进行SDS-PAGE 分离蛋白,随后湿法转到NC 膜,5% BSA(TBST 配制)封闭1.5 h;、磷酸化PKA(p-PKA)兔单抗(1∶1 000,ab2390,英国Abcam 公司)、磷酸化CREB(p-CREB)兔单抗(1∶250,ab32096,英国Abcam公司)、Bax兔单抗(1∶1 000,14796,美国CST 公司)、Bcl-2 鼠单抗(1∶2 000,964495,英国Abcam 公司)、GAPDH 兔单抗(1∶10 000,ab181602,英国Abcam 公司)4 ℃冰箱孵育过夜,TBST 洗膜15 min×3 次;加入相应二抗(1∶2 000~1∶50 000,英国Abcam 公 司),室温孵育1.5 h,用TBST 洗膜15 min×3 次。ECL 发光、显色,SmartView Pro 2000(UVCI-2100,美 国Major Sci‐ence 公司)拍照。利用Image J 软件扫描条带灰度值,以目的蛋白条带灰度值与内参蛋白条带灰度值的比值作为目的蛋白相对表达量。
1.7 血浆炎症因子和心肌酶含量检测 再灌注结束后,采集大鼠尾静脉血5 mL,置于肝素化抗凝EP管中,分离血浆,酶联免疫吸附试验(ELISA)法检测血浆白介素(IL)-1β、肿瘤坏死因子(TNF)-α 和乳酸脱氢酶(LDH)的含量。IL-1β、TNF-α 试剂盒购于美国R&D 公司,LDH 试剂盒购于南京建成生物研究所,检测过程严格按照试剂盒说明书进行操作。
1.8 苏木精-伊红(HE)染色 灌注结束后,取大鼠心脏,用无菌生理盐水冲洗,4%甲醛中固定24 h,酒精脱水后石蜡包埋、切片(4 μm),二甲苯脱蜡,行HE 染色,显微镜(上海无陌光学仪器有限公司)下观察心肌组织的病理变化。
1.9 统计学方法 采用SPSS 20.0 统计软件进行数据分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验;计数资料以百分率(%)表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 5 组大鼠心功能指标比较 与假手术组比较,I/R组LVDP及+dp/dtmax降低,LVEDP升高(P<0.05);与I/R组比较,S-post 组LVDP 及+dp/dtmax升高,LVEDP降低(P<0.05);加入PKA 抑制剂H89后,与S-post 组比较,H89 组及S-post+H89 组LVDP 及+dp/dtmax降低,LVEDP升高(P<0.05),见表1~表3。
2.2 5 组大鼠心肌梗死面积及LDH 释放比较 与假手术组比较,I/R 组心肌梗死面积及LHD 释放量明显增加(P<0.05);与I/R 组比较,S-post 组心肌梗死面积及LHD 释放量减少(P<0.05);与S-post 组比较,H89 组及S-post+H89 组心肌梗死面积及LHD释放量增加(P<0.05);与H89 组比较,S-post+H89组LDH释放降低(P<0.05),见图1、表4。
表1 5组大鼠LVDP比较 kPa,±s
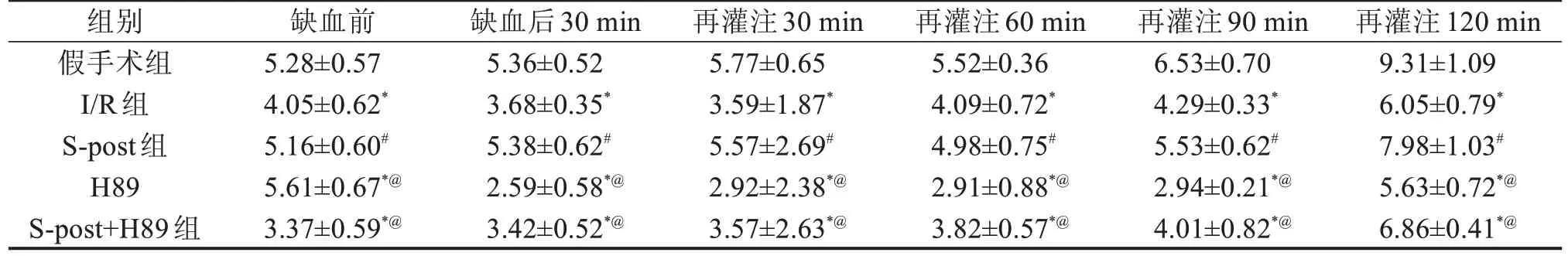
表1 5组大鼠LVDP比较 kPa,±s
与假手术组比较,*P<0.05;与I/R组比较,#P<0.05;与S-post比较,@P<0.05。
表2 5组大鼠LVEDP比较 kPa,±s

表2 5组大鼠LVEDP比较 kPa,±s
与假手术组比较,*P<0.05;与I/R组比较,#P<0.05;与S-post比较,@P<0.05。
表3 5组大鼠+dp/dtmax比较 kPa/s,±s
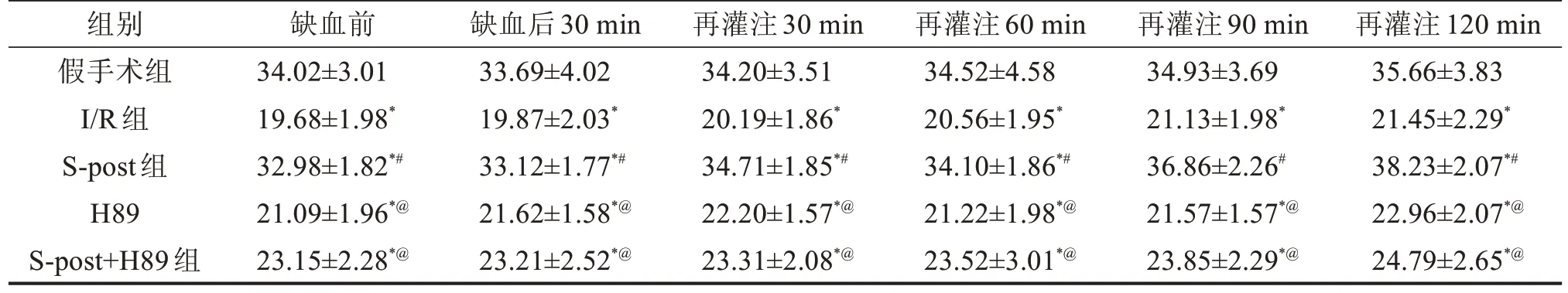
表3 5组大鼠+dp/dtmax比较 kPa/s,±s
与假手术组比较,*P<0.05;与I/R组比较,#P<0.05;与S-post比较,@P<0.05。

图1 大鼠TTC染色图
表4 5组大鼠心肌梗死面积及LDH释放量比较 ±s
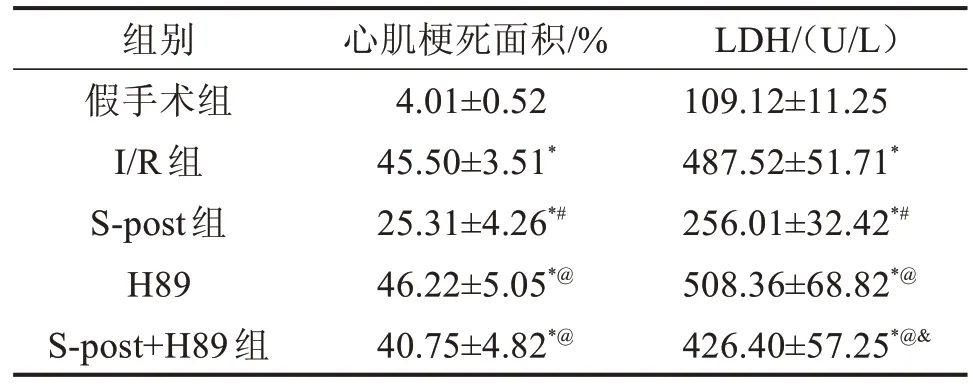
表4 5组大鼠心肌梗死面积及LDH释放量比较 ±s
与假手术组比较,*P<0.05;与I/R 组比较,#P<0.05;与S-post比较,@P<0.05;与H89组比较,&P<0.05。
2.3 5组大鼠心肌组织病理学改变 假手术组心肌纤维规则排列,横纹排列整齐,心肌细胞大小均一,细胞结构完整,形态清晰;I/R 组心肌纤维排列不规则,大部分心肌纤维呈异常波浪状排列,肌丝断裂,炎性浸润明显,心肌细胞大面积坏死;S-post 组较I/R组细胞形态明显改善,心肌纤维排列相对规则,细胞炎性浸润减轻,细胞坏死面积减少;H89 组较Spost 组病理变化更为严重,与I/R 组损伤程度类似,出现大量心肌细胞死亡,炎性浸润明显;H89+S-post组较H89组稍改善,与I/R组病理变化类似,见图2。

图2 大鼠心肌组织HE染色图(×200)
2.4 5 组大鼠血浆炎症因子IL-1β 和TNF-α 的含量比较 与假手术组比较,I/R 组IL-1β、TNF-α 含量显著升高(P<0.05);与I/R 组比较,S-post 组IL-1β、TNF-α 含量显著降低(P<0.05);与S-post 组比较,H89 组及S-post+H89 组IL-1β、TNF-α 含量显著升高(P<0.05);与H89 组比较,S-post+H89 组TNF-α 含量显著降低(P<0.05),见表5。
表5 5组大鼠血浆炎症因子IL-1β和TNF-α的含量比较 pg/mL,±s

表5 5组大鼠血浆炎症因子IL-1β和TNF-α的含量比较 pg/mL,±s
与假手术组比较,*P<0.05;与I/R 组比较,#P<0.05;与S-post组比较,@P<0.05;与H89组比较,&P<0.05。
2.4 5 组Bcl-2、Bax、p-PKA 及p-CREB 蛋白表达量比较 与假手术组比较,I/R 组Bax 蛋白表达上调,Bcl-2、p-PKA 及p-CREB蛋白表达下调(均P<0.05);与I/R 组比较,S-post 组Bax 表达下调,Bcl-2、p-PKA 及p-CREB 表达上调(均P<0.05);加入PKA抑制剂H89 后,与S-post 组比较,H89 组及S-post+H89 组Bax 表达上调,Bcl-2、p-PKA 及p-CREB 表达下调(均P<0.05);与H89 组比较,S-post+H89 组Bax 表达下调,Bcl-2、p-PKA 及p-CREB 表达上调(均P<0.05),见图3。
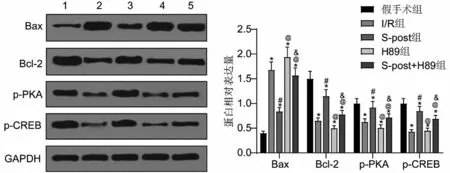
图3 Western blotting法检测心肌组织中Bcl-2、Bax、p-PKA及p-CREB蛋白表达
3 讨论
七氟醚作为麻醉药物,具有术中血流动力学稳定,肌松药用量小,术后苏醒快等特点,作为吸入性麻醉剂被广泛应用于临床。目前较多研究显示,七氟醚预处理或后处理能有效抑制心肌I/R 损伤[10-11]。本研究中,S-post 组I/R 大鼠心功能明显改善,心肌梗死面积和LDH释放量显著减少,且血浆炎症因子水平明显降低(P<0.05),进一步说明七氟醚对心肌I/R损伤具有保护作用。
cAMP 是细胞内参与调节物质代谢和生物学功能的重要物质,是生命信息传递的“第二信使”。cAMP 在体内可以促进心肌细胞的存活,增强心肌细胞抗损伤,具有抗缺血/缺氧能力;促进钙离子向心肌细胞内流动,增强磷酸化作用,促进兴奋—收缩偶联,提高心肌细胞收缩力,增加心输出量;同时扩张外周血管,降低心脏射血阻抗,减轻心脏前、后负荷,增加心排出量,改善心功能,起到营养心肌、正性肌力、舒张血管、抗血小板凝聚和抗心律失常的作用。cAMP 主要通过激活下游PKA 使靶蛋白磷酸化,产生相应的生物学效应。CREB 是细胞内信号通路的交汇点,细胞内信号转导通路的激活使CREB 的第133 位丝氨酸残基磷酸化,其活化后调控基因的转录。CREB 含量的变化在一定程度上可反映细胞总体信号转导通路的变化。研究发现,CREB 磷酸化介导的转录,能提高海马神经元的活性和耐受能力,改善脑I/R 损伤[12]。本研究结果显示,心肌I/R 损伤大鼠中p-PKA、p-CREB 表达较假手术组显著降低,提示I/R 大鼠心肌组织PKA/CREB 信号通路被抑制;S-post 可明显上调p-PKA及p-CREB 表达(P<0.05),而加入PKA 抑制剂H89后,S-post 促进PKA 和CREB 磷酸化的作用被显著抑制(P<0.05),提示S-post 对I/R 心肌的保护作用可能与cAMP/PKA/CREB信号通路的活化有关。
心肌I/R 损伤时心肌细胞凋亡加剧,这一现象已被广泛证实。Bcl-2 和Bax 分别是Bcl-2 家族中最有代表性的抑制凋亡和促进凋亡基因,且Bax 是Bcl-2 活性的主要调控因子。本研究中,I/R 组Bax蛋白表达上调,Bcl-2 蛋白表达下调(P<0.05),与I/R组比较,S-post组Bax表达下调,Bcl-2表达上调(P<0.05);加入PKA 抑制剂H89 后,S-post 对Bax 表达的抑制作用和对Bcl-2 表达的促进作用被显著逆转(P<0.05),推测七氟醚可能通过激活cAMP/PKA/CREB 信号通路抑制心肌细胞凋亡,从而减轻I/R大鼠心肌损伤。
综上所述,七氟醚后处理可抑制大鼠心肌I/R诱导的心肌细胞凋亡,减少炎症反应,增加心肌组织内PKA 及CREB 的磷酸化水平,发挥心肌保护作用。而本研究也发现,cAMP 的抑制仅能部分阻断七氟醚对心肌细胞的保护作用,这提示七氟醚对心肌细胞的保护机制不仅限于cAMP/PKA 信号通路,对此,仍需进行深入探究。
- 广西医科大学学报的其它文章
- Effect of miR-200a-3p targeting transthyretin(TTR)on the biological behavior of placental trophoblasts in hypertensive disorder complicating pregnancy
- 沙利度胺对重型β地中海贫血患者红系细胞γ珠蛋白基因表达及分化的作用研究*
- CEMIP调控Src/AKT/STAT3信号通路对非小细胞肺癌上皮间质转化及细胞侵袭、迁移的影响*
- 乳铁蛋白对正畸复发移动过程中牙周改建的影响*
- 秦皮苷对脂多糖诱导的软骨细胞氧化应激和炎症因子的影响*
- miR-133b-3p对大鼠脑缺血/再灌注损伤的影响及其作用机制*

