CEMIP调控Src/AKT/STAT3信号通路对非小细胞肺癌上皮间质转化及细胞侵袭、迁移的影响*
莫小香,黎 骊,黄国林,宋锦静,于 菲,韦彤彤,阳 洁Δ
(1.广西医科大学药学院,南宁 530021;2.广西医科大学第五附属医院药学部,南宁 530022)
近10年来,肺癌的发病率和死亡率在全球所有类型癌症中均位居第一[1-3]。非小细胞肺癌(nonsmall cell lung cancer,NSCLC)是我国肺癌的主要亚型,其中,85%的肺癌患者属于腺癌[4]。与其他肺癌类型比较,NSCLC 症状隐匿,极易与其他肺部疾病混淆而漏诊,从而导致患者错失手术治疗时机[5]。尽管NSCLC 治疗方式多样,但因其进展迅速,多数患者确诊时已发生远处转移,难以采用手术治疗且对可选择的治疗手段容易发生耐受,平均5 年生存率低,约为15%[3,6-7]。因此,远处转移仍是NSCLC 患者远期生存率低的关键原因,目前抑制NSCLC 转移的治疗方式还十分有限[7-8]。
细胞迁移诱导透明质酸结合蛋白(cell migra‐tion inducing protein,CEMIP)是近年来被发现的一个具有透明质酸(hyaluronan,HA)水解酶活性,调节细胞运动的蛋白[9]。大量研究发现,CEMIP 异常高表达与结直肠癌、宫颈癌、肝癌的发生发展、侵袭、转移呈正相关关系,而鲜少有报道CEMIP对肺癌的影响[10-12]。因此,本研究拟在细胞水平上干预CE‐MIP 的表达,并通过实时荧光定量PCR(quantitative real-time PCR,qPCR)、Western blotting、Transwell等技术检测细胞侵袭、迁移能力、上皮间质转化(epi‐thelial-mesenchymal transition,EMT)标志物的表达变化及其细胞内信号通路的改变,探究CEMIP 对NSCLC侵袭、迁移的影响及其可能的分子机制。
1 材料与方法
1.1 细胞株及主要试剂 NSCLC 细胞株A549、H1299 购自中科院上海研究所细胞库,人正常肺细胞BEAS-2B 购自中科院昆明研究所细胞库;RPMI-1640、胎牛血清购Thermo Fisher Scientific 公司;总RNA 提取试剂RNAiso Plus、逆转录试剂盒(Prime‐Script™RT reagent Kit with gDNA Eraser)、qPCR 扩增染料(TB Green®Premix Ex Taq™II)购自TAKA‐RA 公司;CEMIP 一抗(Proteintech 公司)、GAPDH(BBI公司)、E-cadherin(CST公司)、N-cadherin(Pro‐teintech公司)、Vimentin(CST公司)、Twist1(Protein‐tech公司)、Snail1(Proteintech公司);STAT3(CST 公司)、Src(Proteintech公司)、p-AKT(CST公司)、AKT(abcam 公司)、Alex-555-羊抗兔(BBI 公司)、羊抗兔、羊抗鼠二抗购自CST公司;CEMIP干扰慢病毒、阴性对照干扰慢病毒购自上海吉凯公司。
1.2 临床标本收集 收集2017 年8 月至2018 年8月广西医科大学附属肿瘤医院收治的6 例NSCLC患者(男4例、女2例,中位年龄66岁)经手术切除的肺癌组织及其癌旁正常肺泡组织。病例纳入标准:(1)年龄大于18 岁;(2)ESCO 得分<2 分;(3)病理诊断证实为NSCLC 且具有完整的病历;(4)术前未曾接受放、化疗;(5)未合并其他重大疾病。
1.3 免疫荧光染色检测病理组织CEMIP表达情况 将病理切片置于提前预热的烤箱,72 ℃烤片5 h,经过二甲苯-乙醇梯度脱蜡、复水,用柠檬酸/柠檬酸钠缓冲液(pH=6)进行高压抗原修复,高压上汽5 min 后停止,待其降至室温取出切片。修复后的切片用PBS 洗2 次,然后用5% BSA 室温封闭1 h。按1∶100(CEMIP 抗体∶PBS)比例配置CEMIP一抗稀释液,4 ℃冰箱孵育过夜,次日37 ℃复温1 h,用PBS 洗2 次,加入荧光二抗:Alex555-羊抗兔(1∶100),37 ℃孵育1 h。PBS 洗涤后,加入DAPI 染核5 min,洗涤3 次后切片用甘油封片。在激光共聚焦显微镜(德国徕卡公司,Model DMi8)下观察并拍照,记录CEMIP 染色情况,用Image J软件进行半定量分析。
1.4 细胞培养 NSCLC 细胞株A549、H1299 细胞用含10%胎牛血清、100 U/mL 青-链霉素的RMPI-1640 培养基于37 ℃、5%CO2培养箱中常规培养、传代。肺正常细胞BEAS-2B 用含0.4%牛脑垂体提取物、0.1%氢化可的松、0.1%重组表皮生长因子、0.1%肾上腺素、0.1%胰岛素、0.1%转铁蛋白、0.1%三碘甲状腺素、0.1%视黄酸的BEBM 基础培养基培养。
1.5 慢病毒转染构建稳定干扰CEMIP 细胞株 将对数生长期的细胞接种到24 孔板,每孔2×104个细胞,每孔加入500 μL RMPI-1640 完全培养基培养。第2 天,吸弃原细胞培养液,用PBS 洗2 次,然后每孔加入500 μL 稀释后的病毒液,病毒滴度为5×106TU/mL,同时设置阴性对照组,37 ℃、5% CO2培养12~24 h 后,吸弃病毒液,用PBS 洗2 次,然后加入500 μL 新鲜RMPI-1640 完全培养基培养。观察细胞状态,必要时给予换液,如果细胞融合度达到80%~90%则将细胞消化转移到25T 培养瓶培养。用荧光显微镜观察细胞GFP 荧光的表达情况,细胞用3 μg/mL 嘌呤霉素持续筛选2 周后,可获得稳定转染细胞株。通过qPCR 和Western blotting 验证所转染细胞株构建成功后,将细胞分为干扰组(shCE‐MIP 组)和转染阴性对照病毒的阴性对照组(shNC组)。
1.6 qPCR 法检测细胞CEMIP mRNA 表达 按照试剂说明书,提取细胞总RNA,反转录成cDNA,用实时定量PCR 仪(ABI 7500,美国)检测CEMIP mRNA 表达水平。CEMIP 上游引物:5’-TCGGTC‐CAAGAGTCCATTC-3’,下游:5’-CTCCATCACCACTAATCTCCC-3’;GAPDH 上游引物:5’-GAAGGTGAAGGTCGGAGTC-3’,下游:5′-GAAGATGGTGATGGGATTTC-3’。PCR 反应条件:95 ℃预变性5 min;95 ℃变性5 s,60 ℃退火、延伸34 s,共40个循环;添加熔解曲线:95 ℃10 min,60 ℃15 s,95 ℃5 s。采用2-ΔΔct法计算mRNA相对表达量。
1.7 Transwell实验检测细胞侵袭、迁移能力 迁移实验:将各组细胞预先用无血清培养基饥饿处理12 h。消化收集各组细胞,用无血清RMPI-1640 培养基重悬成5×105个/mL浓度,每孔100 μL分别接种到Transwell 上室,并在下室加入600 μL 含10% 胎牛血清的RMPI-1640 培养基,37 ℃培养24 h 后,取出小室,用棉签擦净滤膜上未转移的细胞,用4%多聚甲醛固定30 min、0.1% 的结晶紫染色30 min,洗净风干,在倒置显微镜下观察(200×),取8 个视野拍照、计数,取均数。每组设3个复孔。细胞迁移能力用平均细胞数/高倍镜视野表示。
侵袭实验:将Matrigel 原液与无血清RMPI-1640 培养基按1:8 稀释,在Transwell 小室上室加入100 μL 稀释后的Matrigel 基质胶,置于37 ℃培养箱1 h。待上室中的胶凝固后取出小室,消化收集各组饥饿处理后的细胞,用无血清RMPI-1640 培养基重悬成8×105个/mL 浓度,每孔100 μL 分别接种到Transwell上室,并在下室加入600 μL含10%胎牛血清的RMPI-1640 培养基,37 ℃培养24 h 后,取出小室。后续处理及统计与迁移实验相同。
1.8 划痕实验测定细胞愈合能力 预先在6 孔板底部用记号笔每隔0.5~1.0 cm均匀画横线,然后在6孔板中加入各组细胞,每孔5×105个细胞,用完全培养基进行培养。第2 天用10 μL 枪头在孔板底部垂直于背后的横线画痕,PBS冲洗干净后,加入无血清培养基培养,移到10×光镜下观察各组细胞迁移情况,拍照记录。然后放回培养箱培养,必要时更换无血清培养基,并在48 h进行拍照记录。愈合率%=(0 h宽度−48 h宽度)/0 h宽度×100%。
1.9 Western blotting法检测细胞CEMIP、EMT标志蛋白及相关通路蛋白的表达 提取各组细胞蛋白,采用BCA 定量法测定各组细胞蛋白浓度;取30 μg的蛋白进行SDS-PAGE 分离蛋白,将蛋白转移至NC 膜;5%脱脂牛奶室温下封闭1 h 后,分别加入一抗:CEMIP 抗体(1∶800)、GAPDH 抗体(1∶2 000)、Ecadherin(1∶1 000)、N-cadherin(1∶1 000)、Vimentin(1∶1 000)、Twist1(1∶500)、Snail1(1∶500)、STAT3(1∶500)、Src(1∶1 000)、p-AKT(1∶2 000)、AKT(1∶1 000),4 ℃冰箱孵育过夜;PBST 洗膜,分别加入二抗(1∶10 000或1∶30 000)室温下孵育1 h,PBST洗膜,用双色红外成像系统(美国Licor 公司,ODYSSEY)扫膜,Image J软件分析蛋白条带灰度值。
1.10 统计学方法 采用SPSS 19.0 统计软件进行数据分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 CEMIP在NSCLC临床标本中的表达 肺癌组织中CEMIP 的表达明显高于其配对癌旁正常肺泡组织(P<0.05),约为1.56倍,见图1。
2.2 CEMIP 在肺癌细胞A549、H1299 及肺正常细胞BEAS-2B 的表达 肺癌细胞A549 和H1299 的CEMIP mRNA 及蛋白表达水平均显著高于肺正常细胞BEAS-2B(均P<0.05),见图2。
2.3 干扰CEMIP后NSCLC细胞中CEMI mRNA及蛋白表达 经嘌呤霉素稳定筛选后,病毒的转染效率均达90%以上。与shNC组比较,shCEMIP组CE‐MIP mRNA 及蛋白表达量均显著降低(均P<0.001),见图3。
2.4 干扰CEMIP 表达对NSCLC 细胞侵袭、迁移能力的影响 H1299、A549 细胞中shCEMIP 组的迁移、侵袭细胞数均显著少于其shNC 组(均P<0.01),见图4。
2.5 干扰CEMIP 表达对NSCLC 细胞愈合能力的影响 H1299、A549 细胞中,shCEMIP 组细胞愈合率均显著低于shNC组(均P<0.001),见图5。
2.6 干扰CEMIP表达对NSCLC细胞EMT的影响 H1299 和A549 细胞shCEMIP 组的上皮标志物E-cadherin蛋白表达量显著高于shNC组(P<0.05),而间质标志物N-cadherin、Vimentin、Twist1、Snail1蛋白表达量均低于shNC组(均P<0.05),见图6。
2.7 干扰CEMIP 表达对NSCLC 细胞转移相关信号通路蛋白的影响 干扰CEMIP 后,H1299 和A549 细胞Src、p-AKT、AKT、STAT3 表达均呈不同程度下降(P<0.05),见图7。
3 讨论

图1 CEMIP在NSCLC组织样本中的表达

图2 CEMIP在肺癌细胞A549、H1299及肺正常细胞BEAS-2B中的表达

图3 干扰CEMIP后NSCLC细胞中CEMIP的mRNA及蛋白表达

图4 干扰CEMIP表达对NSCLC细胞迁移、侵袭能力的影响
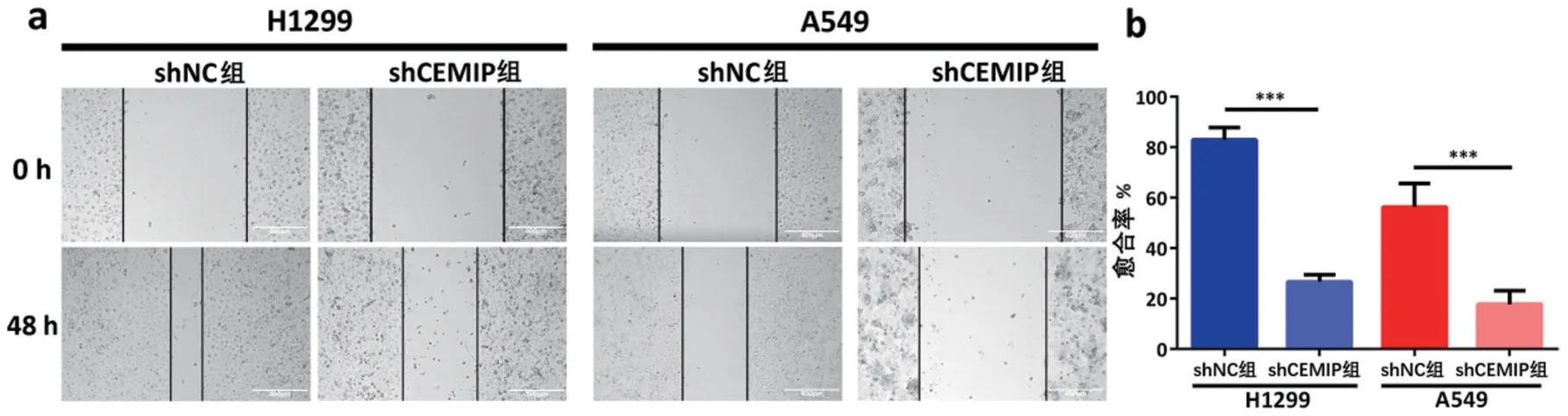
图5 干扰CEMIP表达对NSCLC细胞划痕愈合能力的影响

图6 干扰CEMIP表达对NSCLC细胞EMT标志物蛋白表达水平的影响

图7 干扰CEMIP表达对NSCLC细胞转移相关信号通路蛋白表达的影响
大量研究表明,NSCLC 细胞在一些蛋白、转录因子的驱动下,通过EMT 而获得强大的侵袭、转移能力,发生远处转移。EMT 是指上皮细胞在特定的生理和病理情况下向间充质细胞转化的现象[13]。NSCLC 细胞发生EMT 时,表现为失去上皮细胞特性而获得间质细胞特性,如极性消失、呈梭型改变;细胞间粘附减弱、运动能力增强;上皮细胞标记物如E-cadherin 表达下调;间质细胞标记物如N-cad‐herin、vimentin 等表达上调,转录因子Snail、Slug、Twist、ΔEF1/ZEB1、SIP1/ZEB2、E12/E47 等表达增加[13-14]。最近,Yu 等[15]采用免疫组化检测14 对临床标本中YAP1 的表达情况,发现其在具有显著间质表型的NSCLC 癌组织中高表达;Yang 等[16]发现,高表达FOXP3 的NSCLC 能够维持细胞的间质表型,并通过激活Wnt/β-catenin 使细胞具有更强的侵袭、转移及增殖能力。Elumalai 等[17]通过敲除NSCLC细胞中PTEN 表达(PTEN-KO)发现,具有显著间质表型的PTEN-KO 细胞表现出更强的侵袭、迁移能力,并在裸鼠模型上验证PTEN-KO 细胞在体内更易发生远处转移。此外,Jakobsen 等[18]发现,对表皮生长因子受体-酪氨酸激酶抑制剂(EGFR-TKI)耐药的NSCLC 细胞具有很强的间质表型,且间质标记物的高表达与不良预后呈正相关。相反地,通过抑制EMT 则能够减缓转移的发生。由此可见,EMT表型转化是NSCLC 细胞发生转移的重要过程,EMT与NSCLC的预后、转移有着密切联系。
近年来,大量研究发现,CEMIP 通过调控多种肿瘤细胞EMT 表型转化,驱动其发生远处转移。Xu 等[19]发现,索拉菲尼耐药的肝癌细胞出现明显地间质化,这一现象与其中异常高表达的CEMIP协同EGF 诱导的EMT 转化密切相关。该研究还在裸鼠肝癌耐药模型中证实,高表达CEMIP的耐药细胞更易发生远处转移。具体来说,由于CEMIP含有调控EMT 的高度保守的功能域,这使得其在多种肿瘤中均能促进EMT 进程[20]。此外,一篇CEMIP 与肺癌相关的研究报道,NSCLC 组织中CEMIP 表达水平比正常肺上皮组织明显上调,CEMIP 在研究队列中的强阳性率达49.67%,且高表达CEMIP 与肿瘤低分化、淋巴转移、远处转移呈正相关关系[21]。本研究首先通过检测收集的临床标本,发现CEMIP 在NSCLC 癌组织中的表达显著高于癌旁正常肺泡组织,体外细胞实验采用qPCR 及Western blotting 同样证实了CEMIP 在NSCLC 细胞A549、H1299 中的表达显著高于肺正常细胞BEAS-2B(P<0.05)。进一步通过干扰CEMIP 表达后发现,NSCLC 细胞的EMT 表型发生逆转,表现为上皮标志物E-cadherin表达上调(P<0.05),而间质标志物N-cadherin、Vi‐mentin、Twist1、Snail1 的表达下调(P<0.05),表明CEMIP参与调控NSCLC细胞的EMT表型转变。
研究表明,NSCLC 细胞发生EMT 表型的变化主要受细胞内PI3K/AKT、STAT3 信号通路的调控;抑制NSCLC 细胞中AKT[22]、STAT3[23]等信号通路,可逆转细胞EMT 转化,降低NSCLC 的侵袭迁移能力。Luo等[22]人报道,在NSCLC细胞中使用PI3K抑制剂后,可显著下调其下游AKT、p-AKT 以及mTOR、p-mTOR 的表达,进而降低NSCLC 细胞的侵袭和迁移能力。p-AKT 能够通过激活其下游mTOR 分子,或同时参与调控NSCLC 细胞EMT 转化,从而促进其侵袭迁移[24]。而AKT 的激活依赖于蛋白激酶Src 与AKT 的SH2 功能域结合,使AKT 位于473 位的丝氨酸磷酸化。本研究检测到干扰CE‐MIP 后可引起Src 表达量的降低,且p-AKT 也相应降低(P<0.05),表明干扰CEMIP 能够通过抑制Src表达,使其对信号蛋白AKT 的激活作用减弱。此外,还发现STAT3 也发生下调(P<0.05),这可能与其上游p-AKT 表达降低有关,这一结果与Wei 等[25]发现抑制AKT/STAT3 能够降低肾癌转移的报道一致。
综上所述,干扰CEMIP 表达可通过调控NSCLC 细胞中Src/AKT/STAT3 信号通路,抑制其EMT 过程,降低NSCLC 细胞侵袭、迁移能力。本研究提示CEMIP或可成为NSCLC 转移治疗的潜在靶点。

