对矿井中硫化氢脱除剂的制备及表征
张辛亥,胡 震,薛韩玲,张国伟,李经文,尚治州
(1.西安科技大学 安全科学与工程学院,陕西 西安 710054;2.西安科技大学 能源学院,陕西 西安 710054)
0 引 言
H2S除广泛存在于工业废气、水煤气、炼厂气、合成气、人造丝、硫化染料和天然气等石油化工产品中以外[1],也是煤矿井下经常出现的有害气体。中国煤炭资源丰富,国内绝大多数煤田都出现过H2S涌出现象[2]。近几年来,由于开采强度增加,煤矿H2S涌出现象有增无减,陕西澄合、铜川、黄陵、彬长等矿区,河北邢台、山东淄博、山西太原等地区的煤矿近年都出现过H2S严重超限威胁安全生产。由于矿井环境有大量工作人员,因此控制矿井H2S含量意义重大。
干法脱H2S通常用于低浓气体精细处理,是利用粉状或粒状吸附剂或氧化剂来脱除H2S。用于脱除H2S的金属氧化物包括铁系、锌系、以及铝掺加钴、镍、锰、钒、铈、铋、钛等的氧化物组合[3]。国外最早干法脱硫是1883年英国人克劳斯利用H2S的不完全燃烧生成 SO2去除原料气中的H2S生成单质S和H2O。由于纳米材料的发现,国外原始脱硫方法有了很大的改进,纳米材料以其自身多孔、高比表面积、结构稳定、在电子转移和传热等方面有着优异的性能。近年来,国内外干法脱硫主要利用多孔介质负载金属氧化物去除H2S。SHAHIN等人通过过量浸渍制备的NiO/TiO2,CuO/TiO2和CoO/TiO2纳米复合材料对H2S吸附性能实验表明在480 ℃CoO促进TiO2有更长的穿透时间,促进剂与TiO2的最佳比例为2.5∶5;在400 ℃时,NiO/TiO2吸附性能优于CoO/TiO2[4]。国外的研究者们不会局限于此,在制备出纳米金属氧化物的同时还开发出一定的纳米负载物,使得H2S与金属氧化物作用有着更大的发挥空间;CIMINO等人应用蜂巢结构反应器室用ZnO/CuO(摩尔比1∶1)吸附剂脱除H2S,都取得了不错的脱硫效果[5]。HYUNGSEOK等人将铜浸入到米壳活性炭中(Cu/ARH),形成脱除H2S等毒性气体性能良好的吸附剂[6]。
固体氧化剂化学吸附通常吸附容量较大,效率比较高,经济性相对也比较合理[7]。干法精细化脱除硫化氢一般往往选择金属氧化物作为催化氧化剂[8-10]。因此很多国内外学者利用金属氧化物负载到其他多孔吸附材料中,形成性能优异的脱硫剂,但这些方法制备复杂、材料昂贵、取材不易,而且其负载材料本身的性能欠佳。碳纳米管以高比表面积、丰富的孔道结构、强吸附性、取材方便、价格低廉等优异性能备受学者关注。本论文旨在采用浸渍法的方式将Cu(NO3)2·3H2O溶液负载到碳纳米管上,焙烧后形成具有多维分形结构的CuO/碳纳米管脱硫剂,该脱硫剂取材方便、制备简单,适用于矿井条件下的H2S脱除。为矿井有害气体脱除奠定了基础。
1 实验仪器及材料
1.1 实验材料
选取的材料的纯度以及来源,见表1,该合成实验均在西安科技大学安全实验室完成,实验所需仪器,见表2。

表1 实验药品

表2 实验仪器
1.2 形貌分析
应用JSM-IT300扫描电子显微镜对三维碳纳米管的表观形貌进行测试。 图1显示放大20万倍的SEM照片。
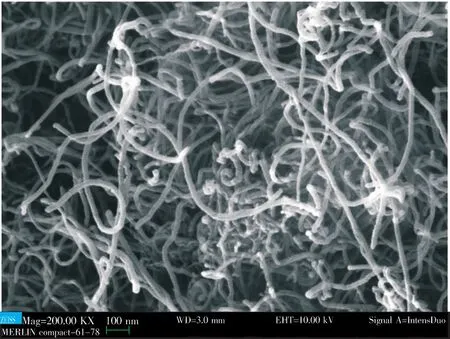
图1 碳纳米管形貌图Fig.1 Morphology of carbon nanotubes
如图1所示,观察碳纳米管的形貌图片发现,图中亮色部分为碳纳米管的主体部分,还能观察到碳纳米管的形状呈现丝状,带状结构,并且无规则的缠绕在一起,形成较为丰富的孔道结构。
2 CuO/碳纳米管脱硫剂的制备与表征
2.1 脱硫剂的制备
采用浸渍法制备CuO/碳纳米管脱硫剂,根据CuO负载量的多少,分为20,30,40,50wt%等,制备出不同负载量的CuO/碳纳米管脱硫剂前驱体。
1)首先根据活性组分负载量计算出所需要的浸渍液浓度,见式(1)。
(1)
式中T为负载量,%;Vp为载体比容,mL/g;C为浸渍液浓度,以氧化物计(g/mL)。
2)按照化学计量比,分别称量43.75,65.625,87.5,109.375 g,分析纯的Cu(NO3)2·3H2O,研磨至粉末状,分别加入4个烧杯中,准确称量4份250 mL的去离子水,加入盛有Cu(NO3)2·3H2O的烧杯中,充分搅拌至Cu(NO3)2·3H2O颗粒完全溶解,再缓慢加入适量碳纳米管,添加过程中保持匀速搅拌。
3)将制备好的溶液浸渍24 h后在 110 ℃下干燥至恒重,分别得到脱硫剂前驱体A(负载量20%)、前驱体B(负载量30%)前驱体C(负载量40%)前驱体D(负载量50%)。
4)将制备好的CuO/碳纳米管脱硫剂前驱体,放在马弗炉中,在500 ℃下焙烧4 h,制得CuO/碳纳米管脱硫剂。
2.2 脱硫剂的表征
对脱硫剂的平均孔径、比表面积和孔体积是基于Autosorb-IQ型全自动比表面及孔隙度分析仪(美国康塔)的氮吸附和解吸量确定的,其测量孔隙度范围在3.5~5 000 A;比表面积大于0.000 5 m2/g;使用扫描电子显微镜(SEM,JSM-7500F,日本株式会社)分析脱硫剂的表面形态,其分辨率为0.8 nm(15 kV),1.2 nm(1 kV),放大倍数25 到 1 000 000倍;粉末(XRD)X射线衍射仪对脱硫剂进行晶体结构分析以2°/min的速度在5至80的范围内扫描(XRD,JSM 7001F,日本株式会社);使用美国TA Q50热重分析仪,以10 ℃/min的升温速率从室温上升到1 000 ℃,研究其质量随温度的变化情况。
3 CuO/碳纳米管脱硫剂结果分析
3.1 氮气物理吸附分析
使用Autosorb-IQ型全自动比表面及孔隙度分析仪对所得样品进行分析见表3。

表3 CuO三维碳纳米管脱硫剂结构参数
表3给出了碳纳米管和纳米CuO/碳纳米管脱硫剂的结构参数,其中包括晶体的比表面积、孔体积、平均孔径和粒径。由表可知,随着负载量的增大,脱硫剂的比表面积相应减小,与未负载相比,负载后脱硫剂样品的比表面积和孔容分别减少了45%左右。随着负载量的增大,脱硫剂的比表面积相应减小,与未负载相比,负载后脱硫剂样品的比表面积和孔容分别减少了40%左右,孔容的减少是因为CuO晶体充分占据了碳纳米管的小孔及微孔,而且负载越多孔容越少;平均孔径与比表面积和孔体积截然相反,平均孔径会有很大幅度的上升,值得注意的是,CuO/碳纳米管脱硫剂的平均孔径随着金属氧化物的负载而增加,这可以从另一方面说明,金属氧化物的晶粒在生长时会先从小孔和微孔开始生长,最先填满小孔和微孔,使得更大的孔道得以保留;虽然纳米CuO晶体的粒度也会因为负载的增加而变大,其中,最关键的原因是,负载量增加,导致CuO晶体在结晶时容易发生团聚现象,从而导致其自身粒径增加,从图4可以清晰地观察到这一现象。
3.2 TEM透射电镜分析
通过TEM获得了CuO/碳纳米管脱硫剂的形貌信息,以检查金属氧化物的形态和细观结构的均匀性。如图2所示,明亮和深色相间的条状和丝状结构为碳纳米管的结构,其直径约在17 nm左右,其极少部分碳纳米管结构从图2可观察到。在TEM图片中能看到较为清晰的碳纳米管结构。由图中可清晰看到暗黑色团状物质,这是氧化铜形成的晶体,从图2可以明显看到,氧化铜晶体没有沿着碳纳米管结构的方向生长,没有形成与碳纳米管条状或丝状结构的氧化铜晶体,而是在碳纳米管富集的地方,自发的形成一种以大颗粒氧化铜晶体为支撑的,小颗粒氧化铜附着其表面的团聚结构,这与SEM上沉积的氧化铜晶体呈现层或分散在团簇结构基本吻合。

图2 20%负载量下的透射电镜扫描Fig.2 Scanning of TEM at 20% load
这种结构的脱硫剂,可以更好的利用碳纳米管的强吸附性,能够给脱硫剂中的活性相提供更富集的硫化氢分子,使得脱硫机活性相周围的电子密度增加,增加电子交换的几率,从而提高脱硫效率。
3.3 SEM分析
使用JSM-IT300型扫描电镜,将制得的4组CuO/碳纳米管脱硫剂直接粘到导电胶上测试,其测试结果如图3所示。

图3 20%负载量SEMFig.3 SEM of 20% load
通过扫描电镜,获得了不同负载量下CuO/碳纳米管脱硫剂的形貌信息,从图3可以看出,明亮和深色部分分别对应CuO晶体颗粒和丰富的孔道结构,在不同负载量下,均能形成CuO晶体的纳米颗粒。对于20%的负载量而言,以大颗粒的CuO晶体为支撑,小颗粒的CuO晶体附着在较大颗粒上,形成包围较为紧凑的团簇状CuO晶体颗粒,这与TEM结果基本吻合,图中并未能明显观察到碳纳米管的结构,这是因为CuO和氧气的共同作用,在高温下将大部分碳纳米管氧化的结果,因而未能在SEM中清晰的观察到碳纳米管结构的存在。
如图4所示,相对于20%的负载量来说,40%的负载量情况下团聚和出现簇状结构现象更为明显,这样会使样品有较多的中孔及介孔,更有利于样品气的渗透,但表面积会相应减少,这与氮气物理吸附分析的结果相吻合,如此会减少与硫化氢气体分子的接触及反应。结合TEM分析,该吸附剂同样拥有高比表面积、丰富的孔道结构,并提供了更好的吸附性,满足吸附剂对于去除硫化氢的核心要求。

图4 40%负载量SEMFig.4 SEM of 40% load
3.4 热重分析
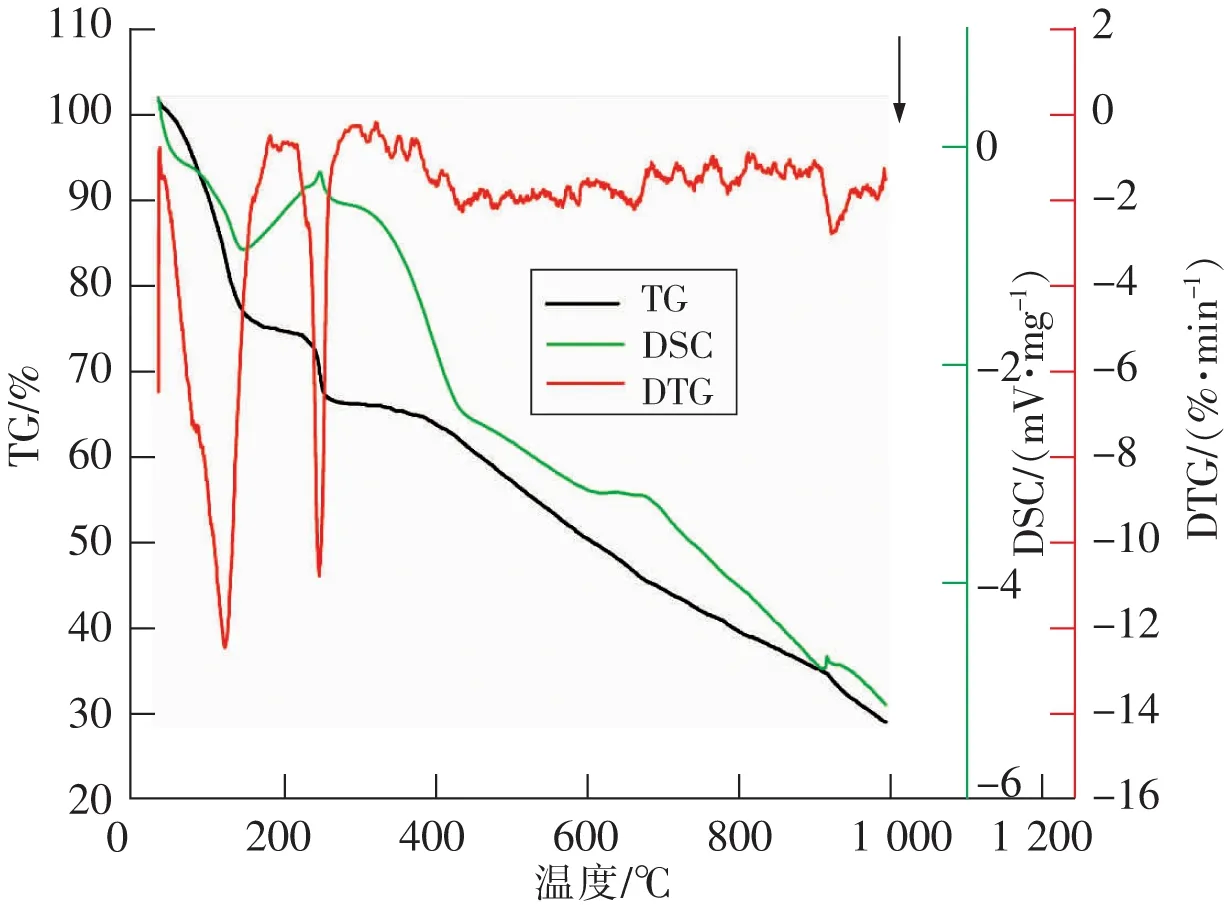
图5 热重法和差示扫描量热法Fig.5 Thermogravimetry and differential scanning calorimetry
使用Labsys 1600 Setaram热分析仪,对脱硫剂进行分析。从图5可以看出,DTA曲线在100 ℃左右时,出现一个强放热峰,这是因为前驱体受热分解,Cu(NO3)2·3H2O脱去结晶水从而形成Cu(NO3)2,在此阶段其质量减少了28.48%;在250 ℃左右时,出现另一个强放热峰,此时Cu(NO3)2分解形成CuO,NO2和O2。此过程质量变化了11.37%。
上述过程表示分解反应基本完成。但曲线在400 ℃以后质量百分比持续下降,且DTA曲线并没有出现明显的强吸热峰,这是由于碳纳米管在高温下慢慢被氧化的原因,此过程其质量变化了32.82%,使得大量的纳米碳结构遭到破坏和坍塌。这与SEM中未能明显观察到碳纳米管相吻合。
3.5 XRD分析
为了比较负载和未负载情况下,宽范围的XRD结果如图6所示。

图6 不同负载的情况下XRD的衍射图Fig.6 Diffraction patterns of XRD under different loads
从图6可知,其衍射峰形较为尖锐,峰面较窄,衍射强度较大,可以由衍射图谱准确得到是该种氧化物为氧化铜晶体,其中衍射图谱得到较为尖锐的峰形可知,在焙烧过程中,因为无法通过其他途径最大限度地减少晶粒的过度生长,使得CuO晶体在煅烧过程中晶粒稍大。
根据XRD衍射数据,导入MDI-jade上进行数据分析,并根据Scherrer公式计算纳米CuO晶体颗粒的大小,计算公式如下所示。
(2)
式中D为晶粒垂直于晶面方向的平均厚度,nm;K为Scherrer常数;λ为X射线波长,0.154 056 nm;β为衍射峰的半高宽;θ为布拉格衍射角。
据此分别计算得到负载量为20%,30%,40%,50%CuO晶体的平均晶粒尺寸为14.5,15,15.7,16.5 nm,这与SEM观测结果相一致。
结合TG-DSC分析可知,该吸附剂的活性相为CuO,是脱硫剂的核心脱硫物质,以氧化还原为基础去除硫化氢。形成这种单一活性相的脱硫物质,具有更好的发展前景,一方面可以更深入的而研究脱硫剂脱硫的机理,更加清晰的认识到脱硫的过程;另一方面更好的控制工业化脱硫进程,因为其材料价格便宜,制备简单,易控制,能够更好的在工业化脱硫中应用。
3.6 XPS分析
为了揭示复合材料中的电状态并进一步证实主客体相互作用,测量了脱硫剂样品的XPS-Cu2p,XPS-C1s和XPS-O1s,如图7所示。
图7中铜的结合能与标准的CuO的结合能为953.6 eV相比,没有较大差别的变化,因此,铜其中的一个主要存在形式为Cu2+的形式存在;其中XPS-O1s的结合能为531 eV,金属氧化物的结合能一般在 529~533 eV之间,进一步证明脱硫剂在焙烧过程中CuO晶体的生成。
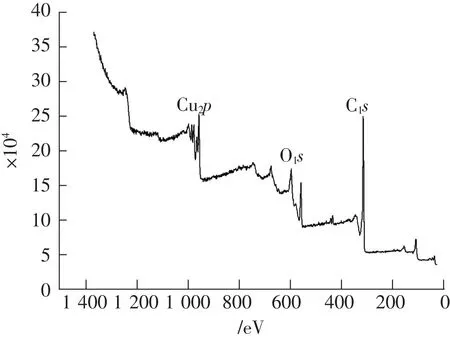
图7 脱硫剂的XPS扫描图Fig.7 XPS scanning pattern of desulfurizer
4 结 论
1)通过浸渍法制备的CuO/碳纳米管脱硫剂,并结合SEM-TEM照片可知,该法形成的多维分形结构体的脱硫剂具有丰富的孔道结构和高比表面积,利用碳纳米管的孔道结构特性和其孔道的限制作用作为载体,以纳米CuO为主的催化氧化剂,通过浸渍法将纳米CuO组装到碳纳米管上,构成CuO/碳纳米管脱硫剂。
2)通过TG-DSC、XRD和XPS分析,脱硫剂中的活性相是由Cu(NO3)2·3H2O脱去结晶水形成Cu(NO3)2而形成,进而形成CuO晶体,CuO晶体成为脱硫剂中的核心脱硫活性相。
3)结合氮气物理吸附、TEM、SEM分析可知,在20%的负载条件下,CuO晶体颗粒的团聚现象更小,脱硫剂拥有更大的比表面积、更小的CuO晶体(14.5 nm)。
4)通过浸渍法制得的CuO/碳纳米管脱硫剂,经研究证明该法操作简单、容易制取、成品质量好。

