腰椎退行性疾病行后路内固定融合术后早期感染清创的危险因素分析
向 渝,刘明永,殷 翔,张 良,薛 鑫,陈宗锋,王晨旭,柳 峰,赵建华
(陆军军医大学大坪医院脊柱外科,重庆 400042)
脊柱手术部位感染是一种十分严重的术后并发症,可使患者的致残率和病死率上升、住院时间延长、再入院率增高、医疗支出增加,且需要额外的手术干预[1-3]。在美国,2018年因脊柱术后感染导致直接或间接的医疗支出增至100亿美元,且术后5年的病死率增加近5倍[1]。脊柱术后30 d内再次入院的所有患者中,48%因发生术后感染入院[2]。随着医学的发展,脊柱术后感染的防治取得了巨大的进步,但受人口老龄化等诸多因素的影响,腰椎退行性疾病手术患者逐渐增多,手术部位感染(surgical site infections,SSI)的患者数量不断增加[4],SSI已成为脊柱术后第3常见的并发症[5]。
目前,经后路椎管减压、植骨融合内固定术是腰椎退行性疾病较常用的手术方式[6]。据文献报道,脊柱术后SSI的发生率为0.7%~12%[7-8]。明确腰椎退行性疾病SSI发生的危险因素,对腰椎术后预防SSI具有重要的临床意义。既往关于SSI的研究涵盖多种手术方式和疾病类型[8-9],研究的异质性较大,其结论并不一定适用于腰椎退行性疾病行后路内固定融合术的患者;同时,部分浅表感染诊断标准的不统一导致SSI发生率的巨大差异和危险因素结论的不一致;再者,手术清创对患者的负面影响更大。因此,本研究的对象限定为因SSI需清创的患者,通过回顾性分析因腰椎退行性疾病行后路内固定融合术患者的病历资料,探讨这类患者发生SSI需清创的危险因素,以更好地进行预防和控制。
1 资料与方法
1.1 临床资料
回顾性分析2012年9月至2018年9月2 326例在我院接受腰椎后路内固定融合术患者的临床资料,其中60例因SSI需行清创术,纳入清创组;于同期未发生SSI的患者中按照1∶4比例[10]随机抽取240例纳入无感染组。纳入标准:①年龄≥50岁;②诊断为腰椎退行性疾病,包括腰椎间盘突出症、腰椎管狭窄症、腰椎不稳/滑脱症;③行腰椎后路内固定融合术;④择期手术。排除标准:①合并脊柱畸形、结核、肿瘤或创伤;②术前合并脊柱或全身其他部位活动性感染。早期(术后30 d内)感染清创的诊断根据美国疾病控制和预防中心诊断标准[3],符合以下1项或1项以上即诊断为SSI:①手术伤口表现为红、肿、热、痛,有波动感或合并脓肿、流脓;②伤口分泌物细菌培养阳性;③再次清创手术,术中灌洗液或组织细菌培养阳性;④经实验室检查血常规、C反应蛋白(C-reactive protein,CRP)、降钙素原以及MRI检查或组织病理学检查等证实为SSI。本研究根据诊断标准诊断出术后因早期SSI需清创的患者。所有行清创的患者,在行最后1次清创后至少随访1年,未再发生SSI。本研究经陆军军医大学大坪医院伦理委员会批准(医研伦审(2020)第103号)。
1.2 观察指标
通过病历系统收集2组患者的一般资料,包括性别、年龄、疾病类型(腰椎间盘突出症、腰椎管狭窄症和腰椎滑脱症)、合并糖尿病和高血压情况、吸烟、美国麻醉医师协会(American Society of Anesthesiologists,ASA)评分、诊断SSI的时间、术前住院时间、总住院时间和住院花费;手术相关资料,包括脊柱侵袭性指数(spinal invasiveness index,SII)[11]、手术时间、手术椎体数、失血量和术中输血;影像和实验室资料,包括皮下脂肪厚度、椎旁肌肉厚度、术前血红蛋白、术前白细胞、血小板、淋巴细胞、CRP、血沉(erythrocyte sedimentation rate,ESR)、血清白蛋白、糖化血红蛋白、术前血糖和伤口分泌物培养结果。ASA评分系统是1个5分制量表,常用于衡量患者术前的整体健康状况,Ⅰ级:正常健康,除局部病变外,无系统性疾病;Ⅱ级:有轻度或中度系统性疾病;Ⅲ级:有严重系统性疾病,日常活动受限,但未丧失工作能力;Ⅳ级:有严重系统性疾病,已丧失工作能力,威胁生命安全;Ⅴ级:病情危重,生命难以维持,濒临死亡。SII可以反映手术入路、椎体减压、内固定和融合的椎体数量,该指数是前路减压、前路融合、前路内固定、后路减压、后路融合和后路内固定6种手术操作均赋值为1,最终求其总和[11]。术前腰椎矢状位MRI测量椎旁肌肉厚度和皮下脂肪厚度,测量患者所有手术椎间盘水平的厚度并求取其平均值(图1)。
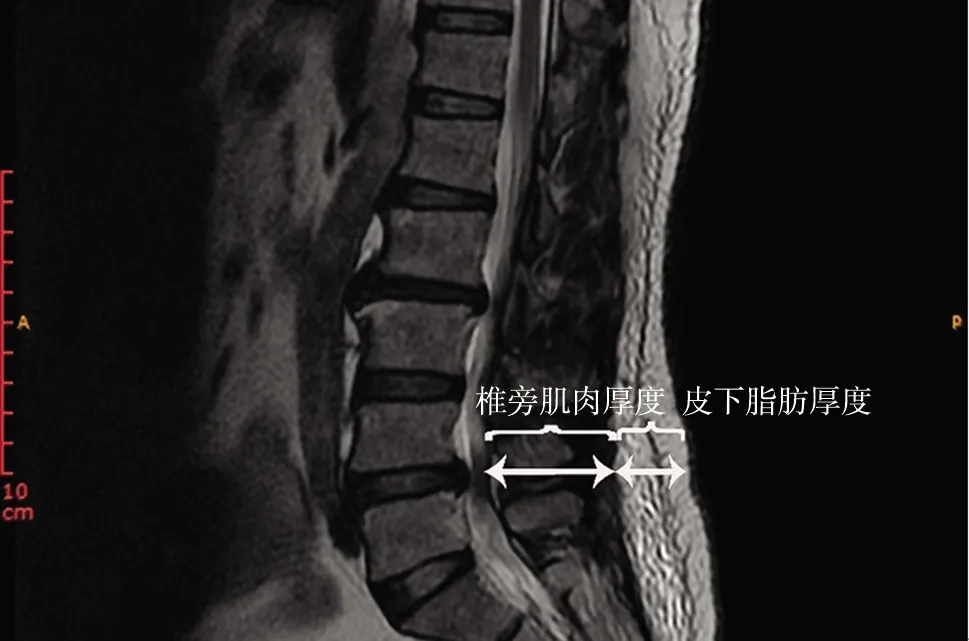
图1 矢状位MRI T2加权像下测量椎间盘水平皮下脂肪厚度和椎旁肌肉厚度
1.3 统计学方法
2 结果
2.1 单因素分析
2组患者ASA评分、合并糖尿病、总住院时间和住院花费比较,差异有统计学意义(P<0.05),清创组住院花费费用较无感染组增加76.3%,总住院时间延长244.9%;而2组患者性别、年龄、疾病类型、术前住院时间、吸烟和合并高血压等比较,差异均无统计学意义(P>0.05),见表1。2组患者SII、手术时间、手术椎体数、失血量和术中输血比较,差异有统计学意义(P<0.05),见表2。2组患者皮下脂肪厚度、术前血红蛋白、术前白细胞、淋巴细胞、CRP、血清白蛋白、术前血糖比较,差异有统计学意义(P<0.05);而2组患者椎旁肌肉厚度、血小板、ESR、糖化血红蛋白比较,差异无统计学意义(P>0.05),见表3。清创组患者组织或分泌物培养结果显示金黄色葡萄球菌最为常见,占31.7%(19/60),见表4。清创组诊断为SSI的时间最短为4 d,平均(14.83±5.89)d,10~16 d占比最大(60%),见图2。
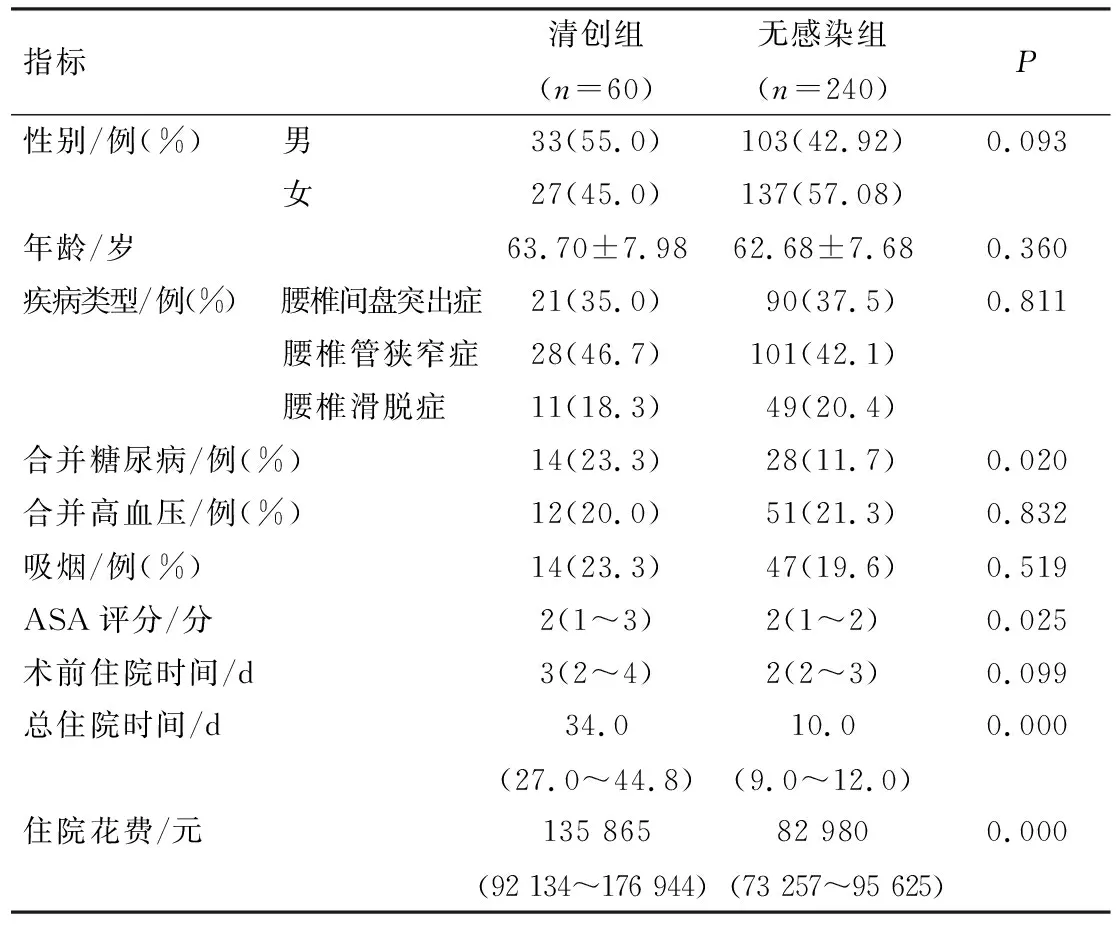
表1 患者一般资料比较

表2 患者手术相关资料比较
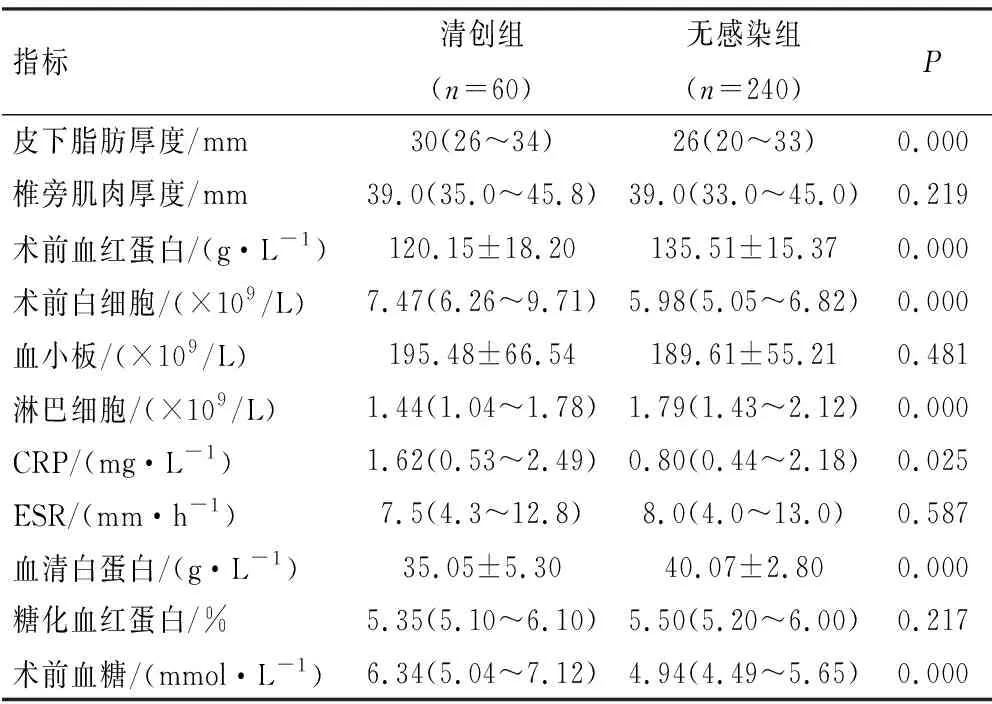
表3 患者影像和实验室资料比较
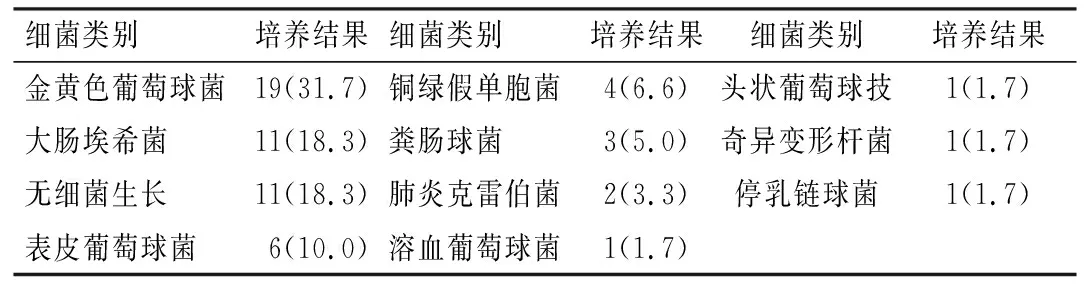
表4 清创组患者组织或分泌物培养结果[n=60,例(%)]
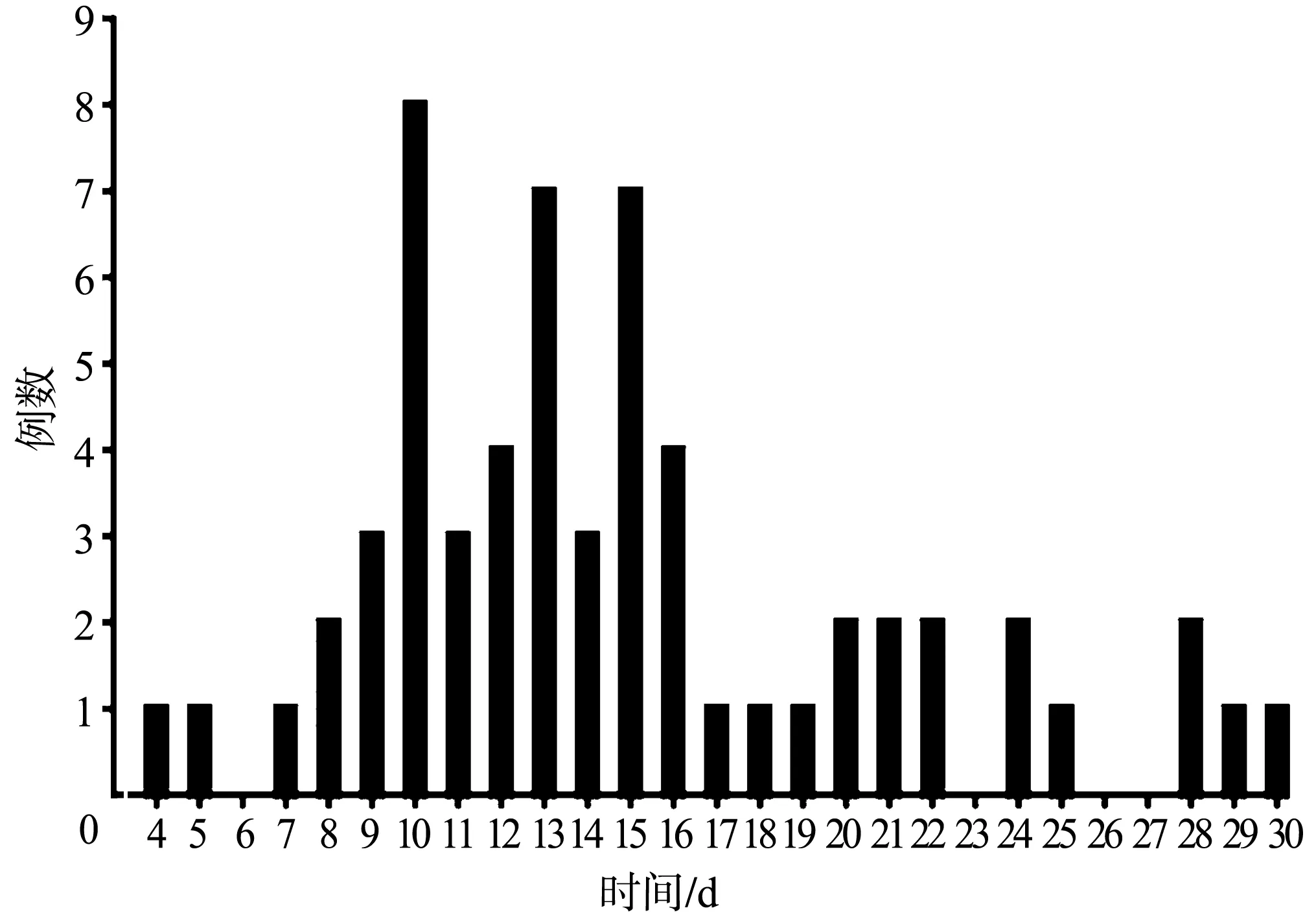
图2 清创组初次手术至诊断为SSI时间频数分布直方图
2.2 二元Logistic回归分析
将组间比较中具有统计学意义的指标为自变量,进行二元Logistic回归分析。在调整混杂因素的干扰之后,最终SII、血清白蛋白、术前血糖和皮下脂肪厚度是腰椎退行性疾病行后路内固定融合术后发生感染需清创的危险因素(P<0.05),见表5。
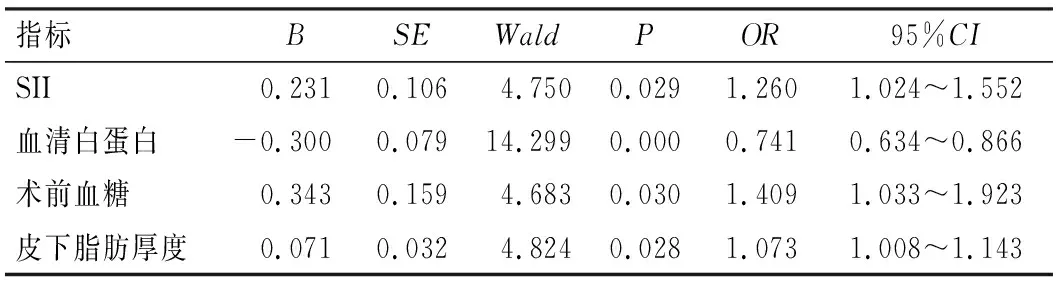
表5 腰椎内固定融合术后感染清创危险因素的Logistic回归分析
2.3 ROC曲线分析
对确定为危险因素的计量资料绘制ROC曲线,结果显示SII曲线下面积为0.768,约登指数为0.425时到达临界值9.5;血清白蛋白曲线下面积为0.801,约登指数为0.475时到达临界值35.8 g/L;术前血糖曲线下面积为0.712,约登指数为0.413时到达临界值6.18 mmol/L;皮下脂肪厚度曲线下面积为0.653,约登指数为0.363时到达临界值23.5 mm(图3)。
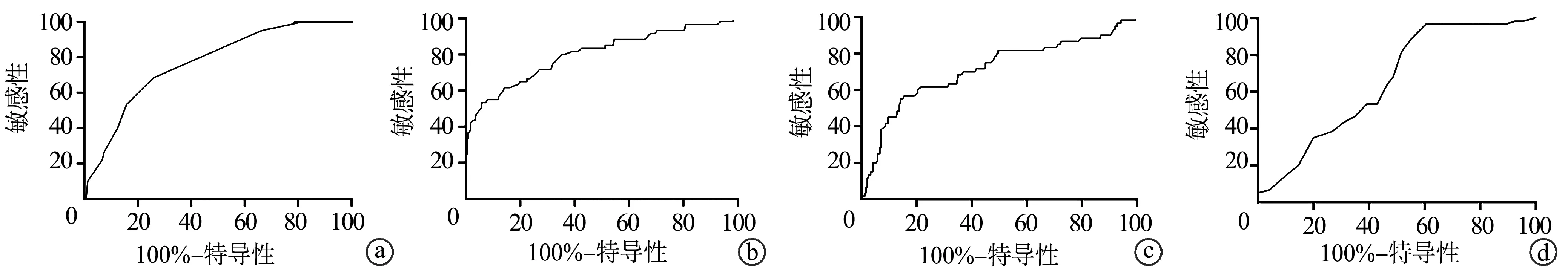
a:SII;b:血清白蛋白;c:术前血糖;d:皮下脂肪厚度
3 讨论
需手术清创的腰椎SSI是一种极为严重的并发症,相较于保守治疗即可治愈的SSI患者,其更大幅度地延长住院时间、增加医疗支出及患者的痛苦[12-13]。本研究聚焦于因腰椎退行性疾病而行后路内固定融合术的患者,通过严格的纳入标准来构建更加统一的患者群体,得出了4个术前可予以调整的危险因素,对其进行适当的干预将有望降低需清创SSI的发生率。
本研究结果显示,金黄色葡萄球菌为术后感染最常见的病原菌,原因可能是金黄色葡萄球菌就是皮肤常见菌群之一。本研究清创组11例患者分泌物培养结果显示无细菌生长,因回顾性研究的限制,无法再做深入分析以明确是否存在厌氧菌、支原体等感染的可能。但本研究中各病原菌的占比,对临床经验性使用抗生素有一定指导意义。
既往研究报道手术时间和出血量都是SSI的危险因素[8,12],本研究并未得出此结论,这2项指标可能无法客观反映手术方式的复杂程度。SII通过对手术入路、椎体减压、内固定和融合数量的分析,能够量化特定的脊柱手术方式,且已被证实与手术复杂程度具有相关性[13],但鲜有文章报道SII与脊柱SSI的联系。本研究结果显示,SII是SSI清创的危险因素。一项瑞典的研究比较了椎间盘退变相关疾病不同手术方式并发症的发生率发现:未行内固定融合术的并发症发生率为12%、内固定融合术为22%、前后路联合融合术为40%,且随着手术复杂程度的增加,并发症的发生率也随之增加[14]。因此,本研究推测,如果备选几种手术方式的有效性相似或者未知,术前通过对不同手术方式SII的分析可以对并发症的风险和整体医疗花费进行评估。
全球成年男性和女性肥胖人数分别从1975年的3 100万和6 900万增加到2016年的2.81亿和3.9亿[15]。研究显示,BMI>30 kg/m2的肥胖患者发生颈椎和腰椎SSI的风险更高[11-12,16]。但也有研究报道BMI不是SSI的危险因素[13,17],BMI虽是最简单常用的评估肥胖的指标,但由于脂肪分布可变且不均以及计算时包含肌肉的质量,因此,BMI并不能准确评估肥胖。皮下脂肪厚度可能是描述手术部位局部肥胖情况更好的指标[9]。肥胖患者往往拥有更厚的皮下脂肪,本研究中皮下脂肪厚度是SSI清创的危险因素,尤其是皮下脂肪厚度超过23.5 mm。Mehta等[9]对颈椎的研究中发现,C5水平皮下脂肪厚度是SSI的危险因素,SSI组平均皮下脂肪厚度达27 mm,Sang等[18]在对腰椎的研究中也得出类似的结论。手术部位皮下脂肪较厚需要更大的切口和软组织剥离,可能形成大的浆液瘤,延长引流时间[9,18]。此外,肥胖患者皮下脂肪血管化不良,易发生脂肪组织低灌注,使伤口愈合延迟和局部组织坏死形成死腔[19]。术前减肥可降低SSI发生的风险,但不鼓励过快过激地减肥,其可能导致营养不良及对手术的耐受降低[20]。
低白蛋白往往标志着营养不良[17],营养不良被报道是SSI发生的危险因素[18]。既往有研究报道白蛋白低于35 g/L与SSI显著相关[21];本研究结果也显示,低白蛋白是SSI清创的危险因素,其临界值为35.8 g/L。因此在入院后应评估患者营养状况,术前营养支持是扭转营养不良的有效方法[22],但是否输注人血白蛋白还需谨慎。有研究报道无论患者是否存在低白蛋白血症,输注人血白蛋白都会增加发生SSI清创的风险[17]。根据欧洲医学会对白蛋白的使用指南,除大手术(大面积肠切除或肝切除超过40%)和白蛋白浓度低于20 g/L外,不建议输注人血白蛋白来纠正低白蛋白血症和促进伤口愈合[23]。
糖尿病可引起微血管病变,导致局部组织出现缺血,延缓创面愈合[24]。糖尿病患者血红蛋白显著升高,使得氧解离曲线左移,组织慢性缺氧,易诱发感染;此外,若糖尿病患者病程较长,可因周围神经功能病变而产生感觉异常,不利于感染的早期发现与治疗[25-26]。诸多原因使得糖尿病患者SSI清创的风险增加,但本研究中合并糖尿病并不是发生SSI清创的危险因素,但术前血糖却是其危险因素。分析原因可能为高血糖才是导致伤口感染的关键因素,而非是否有糖尿病史。Pennington等[25]也发现,即使患者未合并糖尿病,围术期血糖升高也会导致SSI风险增加。因此无论是否患有糖尿病,术前都应根据患者情况有效控制血糖,确保血糖在合理范围内再实施手术,术后也应严格控制血糖。本研究发现术前血糖低于6.18 mmol/L可显著降低SSI清创风险,但过于激进的血糖控制又会引起低血糖,增加患者摔倒的概率,从而引起相关的骨折。为平衡血糖控制的风险和益处,美国外科医师学会建议将围术期血糖控制在6.11~8.33 mmol/L[27]。
本研究结果显示,年龄不是SSI清创的危险因素,可能与本研究仅纳入年龄≥50岁的腰椎退行性疾病高发的群体有关,因此组间无明显差异。老年患者往往合并其他基础疾病,免疫系统较弱,营养状况较差,理论上比年轻患者出现SSI清创的风险更高。既往得出高龄为腰椎术后SSI危险因素的研究多纳入年龄≥18岁的患者[12,18],其中纳入研究的部分中青年患者选择开放手术的指征是否合理,是否对研究结果产生了影响,还需进一步的研究来说明。本研究对所有行清创的患者随访至少1年,未再发生SSI,说明对早期SSI的患者行清创可避免其发展为迟发性感染。
本研究也存在一些局限性。首先,研究数据来自单中心,为回顾性研究,难以避免存在选择偏倚;其次,其他可能与SSI清创相关的因素,如术中冲洗次数、缝线种类和缝合方式等,因回顾性资料未记录,故无法探究其与感染清创的关系;再者,对于既往报道的部分危险因素,在本研究中未得到证实,可能与本研究样本量较小有关,未来还需更大样本的前瞻性研究进一步证实。
综上,腰椎退行性疾病内固定融合术后发生感染清创的因素是多方面的。本研究发现SII越高、皮下脂肪越厚、术前白蛋白越低、术前血糖越高,患者发生感染清创的风险也就越高。因此慎重选择手术方式、控制体质量、改善营养和控制血糖,可预防或减少腰椎后路内固定融合术后感染清创的发生。

