骨肉瘤肺转移大鼠模型建立及清肺固金汤的干预研究
徐叶峰 刘云霞 姚勇伟 王翌庆 杨洁文
杭州市第三人民医院 杭州 310009
骨肉瘤(osteosarcoma)好发于儿童及青少年,是最常见的原发性骨恶性肿瘤。 骨肉瘤恶性程度极高,易发生侵袭转移,肺是其最常见的转移部位。 肺转移是导致骨肉瘤治疗失败及低生存率的根本原因,约85%~90%的患者就诊时已存在微小转移灶[1]。 目前临床上骨肉瘤肺转移的治疗主要依靠大剂量多药联合化疗,甲氨蝶呤、多柔比星、顺铂和异环磷酰胺是常用的化疗药物。 近年来,尽管靶向、免疫治疗有了较大发展,骨肉瘤患者的总体预后仍然较差,Ⅳ期患者5年生存率低于20%。 骨肉瘤属于中医学中的“骨瘤”“骨疽”“下石疽”等病证范畴,多由禀赋不足,正气亏虚,邪气趁虚而入,随经络气血走行,深入骨髓,导致气血凝滞,经络受阻,伤筋蚀骨,日久结毒成瘤。 邪毒乘虚随经气或血脉流窜,客于脏腑,日久成积而导致骨肉瘤的复发和转移。 本病以肺(气)虚为本,痰阻为标,肺气虚后期形成的“痰浊”是肺组织免疫抑制微环境形成的重要条件,随着病情进展,最终形成适宜转移性肿瘤细胞定植生长的“土壤”,促进肺转移的发生。本课题组在临床上选用清肺固金汤(黄芪、浙贝、薏苡仁、白花蛇舌草、桔梗)化裁防治骨肉瘤肺转移,获得良好的疗效[2]。 为了进一步明确该复方对骨肉瘤肺转移的作用, 本研究针对骨肉瘤肺转移的核心病机,构建“肺虚痰阻证”骨肉瘤肺转移病证结合大鼠模型,以期阐明清肺固金汤对骨肉瘤肺转移的干预作用及其内在机制。
1 材料和方法
1.1 细胞和实验动物 大鼠骨肉瘤细胞株UMR-106购于中国科学院细胞库,由浙江中医药大学动物实验研究中心提供。雄性无特殊病原体(special pathogen free,SPF)级SD大鼠80只,6周龄,体质量(180±20)g,购于上海西普尔-必凯实验动物有限公司[实验动物生产许可证号码:SCXK(沪)2018-0006],饲养于浙江中医药大学动物实验研究中心[实验动物使用许可证号码:SYXK(浙)2018-0012]SPF级环境,笼具、垫料、饮水、 饲料等均严格消毒。 所有大鼠适应性饲养1周后用于实验。
1.2 药物与试剂 清肺固金汤由生黄芪30g(产地内蒙古,批号:160412)、浙贝母10g(产地浙江,批号:160517)、薏苡仁30g(产地浙江,批号:160328)、白花蛇舌草30g(产地浙江,批号:160201)和桔梗6g(产地安徽,批号:160301),共5味中药组成,所有药材均购于华东医药公司, 将以上药物浓煎为生药浓度2.0g·mL-1的药液,调整pH值至7.0~7.2,分装后0.22μm过滤除菌,4℃保存备用。 胎牛血清、洛斯维尔帕克纪念研究所(Roswell Park Memorial Institute,RPMI)1640培养基均购于Gibco公司(批号:42F6555K、AAJ206662);磷酸缓冲盐溶液(phosphate buffer saline,PBS)购于Hyclone公司(批号:NAH1449);胰蛋白酶、青霉素/链霉素双抗均购于北京索莱宝科技有限公司 (批号:20160431、20160318); 二甲基亚砜购于Amersco公司(批号:0564C328);白细胞介素-10(interleukin-10,IL-10)、 转化生长因子-β1(transforming growth factor-β1,TGF-β1)酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)检测试剂盒均购于酶免生物公司(批号:MM-0181R1、MM-0195R1);趋化因子受体4(CXC motif receptor 4,CXCR4)抗体购于Novus公司(批号:NB100-56437)。
1.3 仪器 LDZ5-2型自动平衡离心机购于北京医用离心机厂;HEPA Class100型培养箱购于Thermo公司;生物安全柜为Thermo公司产品;双缸中药煎药机ZG-280购于吉首市中诚制药机械厂;RE-300型旋转蒸发器为上海亚荣生化仪器厂产品;MLS-3750高压灭菌锅购于日本SANYO 公司;Thermo Varioskan Flash多功能酶标仪购于Thermo公司;Nikon Eclipse 80i显微镜购于Nikon公司;Carl Zeiss Imaging Systems为Carl Zeiss公司产品。
1.4 方法
1.4.1 动物分组、 造模 将80只SD大鼠随机分为空白对照组、骨肉瘤模型组、骨肉瘤肺转移模型组、清肺固金组4组,每组20只。 实验第1天,将对数生长期的UMR-106细胞制成单细胞悬液,调整细胞浓度为2.5×108个/mL。 除空白对照组外,在无菌条件下用25μL微量进样器将肿瘤细胞接种于其余3组大鼠右后肢胫骨近端骨髓腔内,接种量为20μL/只,即5×106个细胞。接种第8天起, 骨肉瘤肺转移模型组和清肺固金组大鼠以冷风刺激加烟熏法建立“肺虚痰阻证”模型,将两组大鼠置于较饲养环境温度低5℃的冷风下刺激10min,然后置于烟熏柜中,将0.2g硫磺粉均匀撒于半根清艾条内,点燃艾条,艾条燃尽后2h取出大鼠。 以上操作2次/d,共30d。
1.4.2 动物模型判定标准
1.4.2.1 骨肉瘤肺转移大鼠模型判定 骨肉瘤肺转移大鼠模型判定参照骨肉瘤患者临床、影像、病理三结合的诊断原则,具体如下:(1)患肢胫骨干增粗,伴有周围软组织肿胀;(2)患肢X线检查提示病灶部位存在骨质破坏现象,骨密度增高,呈梭形改变;(3)肿块部位及肺结节病灶病理提示细胞核大深染, 异型性明显,局部肿瘤中心有坏死[3]。
1.4.2.2 “肺虚痰阻证”大鼠模型判定 判断标准如下:(1)大鼠毛发枯槁,口鼻分泌物增多,精神萎靡,活动迟缓,出现咳嗽或咳痰,可闻及明显痰鸣音,伴气促,饮食、饮水量增加,体质量增加缓慢;(2)病理切片提示有气道上皮脱失、杯状细胞和腺体增生等表现[4]。
1.4.3 干预方法 空白对照组大鼠正常饲养,不进行药物干预;骨肉瘤模型组与骨肉瘤肺转移模型组接种后第8天开始以0.9%氯化钠溶液2.5mL/250g灌胃,1次/d,持续8周;清肺固金组以清肺固金汤2.5mL/250g灌胃,1次/d,持续8周。 清肺固金汤剂量按《中药药理研究方法学》[5]中人鼠等效剂量进行换算,成人体质量以60kg计算,SD大鼠体质量以250g计算,清肺固金汤为106g/(剂·d),计算得出人鼠等效剂量为20g/(kg·d)。
1.4.4 检测指标 各组大鼠末次灌胃后4h,腹主动脉取血,3 000r/min离心15min后, 小心吸取上层血清,灭活后过滤除菌,-20℃保存备用。将取血后的荷瘤大鼠置于冰上,迅速开胸分离双侧肺组织,并取右侧胫骨,剥离瘤块,测量原发灶及各转移灶瘤体直径,同时称取瘤体质量。 采用椭球体体积公式计算瘤体体积,瘤体体积(mm3)=a×b2/2(a为长径,b为短径)。 以0.9%氯化钠溶液冲洗后分别保存,用于后续病理及ELISA检测。 甲醛溶液固定的骨组织及肺组织以石蜡包埋,逐级乙醇脱水,依次进行1%苏木素染色,分化,伊红染色,脱水,透明封片后光镜下观察
1.4.4.1 原发灶评估 依据瘤体体积计算体积抑瘤率,体积抑瘤率(%)=1-(清肺固金组平均瘤体体积/各模型组平均瘤体体积)×100%。 依据原发灶瘤块质量计算质量抑瘤率,质量抑瘤率(%)=1-(清肺固金组平均瘤体质量/各模型组平均瘤体质量)×100%。
1.4.4.2 转移灶评估 在40倍光镜下观察并计数肺脏表面及内部转移灶数量,取典型病灶,行常规苏木素伊红(hematoxylin eosin,HE)染色,由高年资病理科医师确认诊断。 以刀片小心分离所有转移灶,游标卡尺测定大小,并进行分级。 转移灶分级标准:Ⅰ级,直径<0.5mm;Ⅱ级,直径0.5~1.0mm;Ⅲ级,直径1.0~2.0mm;Ⅳ级,直径>2.0mm。 总转移级数=Ⅰ级×1+Ⅱ级×2+Ⅲ级×3+Ⅳ级×4。 肺转移率(%)=发生转移的例数/总例数×100%。
1.4.4.3 ELISA法检测血清及瘤体IL-10、TGF-β1含量各组分别取10份采集后冻存的血清,采用ELISA双抗体夹心法检测血清IL-10、TGF-β1含量, 在多功能全波长酶标仪450nm处读取数据。 再分别取对应的10份肿瘤组织, 充分匀浆后采用同样的方法检测瘤体内IL-10、TGF-β1含量。
1.4.4.4 Western blot法检测大鼠右胫骨组织CXCR4蛋白表达 各组分别取另10份右胫骨组织,脱钙后每20mg加入放射免疫沉淀 (radio immunoprecipitation assay,RIPA)裂解液200μL,充分研磨,匀浆后提取组织蛋白质,Lowry法测定蛋白质浓度。 每孔上样量为60μg/20μL,电泳后转膜,脱脂奶粉封闭后加入目标蛋白一抗,4℃孵育过夜,洗涤后加入二抗,最后以电 化 学 发 光 技 术(electrochemiluminesence,ECL)检测,以甘油醛-3-磷酸脱氧酶(glyceraldehyde-3-phosphote dehydrogenase, GAPDH) 为内参照计算各目标蛋白灰度值,检测CXCR4蛋白相对表达量。
1.5 统计学分析 应用SPSS 20.0统计软件进行统计学分析,计量资料以x±s表示,多样本均数间比较采用单因素方差分析,满足方差齐性时,组间两两比较采用最小显著性差异(least significant difference,LSD)法;方差不齐时,采用Games-Howell法。 多因素比较采用析因设计的方差分析。 等级资料组间比较采用秩和检验。 以P<0.05为差异有统计学意义。
2 结果
2.1 模型建立结果 与空白对照组比较,下肢X线检查提示,骨肉瘤模型组大鼠右胫骨干骺端骨质破坏,呈团片状密度增高影, 局部可见成骨性软组织肿块。解剖后可见肿瘤位于右胫骨干骺端, 切面呈灰白色,质地硬,并向骨髓腔内浸润性生长。 两肺表面可见多处散发灰白色转移瘤结节,边界清楚,形态、大小、质地不一,触之较硬,有颗粒感。 病理检查可见骨肉瘤模型组右胫骨存在大量核大深染的异型细胞,核质比增大,核分裂像多见;肺组织内肺泡结构破坏,细胞异型性增加,可见骨母细胞,伴钙化。 结合影像学表现,符合骨肉瘤肺转移,证明大鼠骨肉瘤肺转移模型成功建立。 见图1、2。
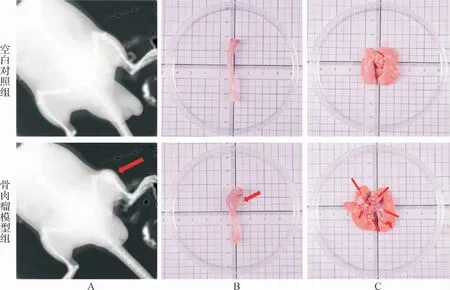
图1 大鼠下肢X线摄片及右胫骨及肺大体形态Fig.1 X-ray film of lower limbs and gross morphology of right tibia and lung of rats
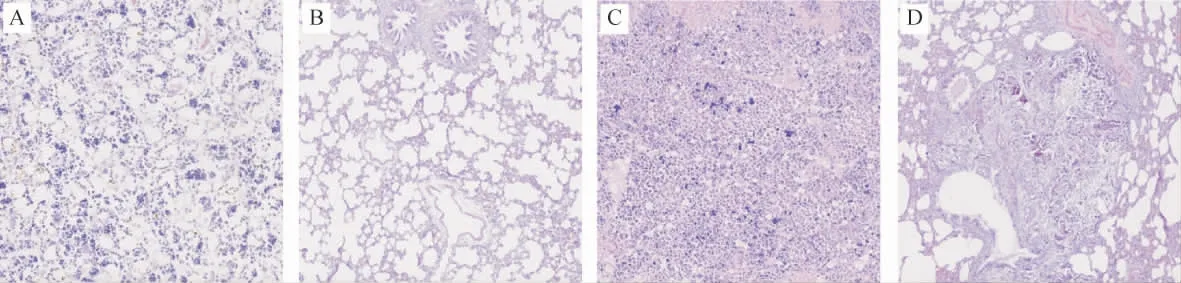
图2 空白对照组及骨肉瘤模型组右胫骨及肺组织病理切片(HE染色,10×)Fig.2 Blank control group and osteosarcoma model group right tibia and lung pathology(HE staining, 10×)
进一步建立“肺虚痰阻证”病证结合模型发现,骨肉瘤肺转移模型组大鼠毛发枯槁,活动迟缓,精神萎靡,口鼻分泌物增多,常出现咳嗽或咳痰,可闻及明显痰鸣音,伴气促,饮食、饮水量增加,但体质量增加缓慢。 而空白对照组大鼠毛发洁白光泽, 活泼好动,反应灵敏,食欲旺盛,无咳嗽气促、痰鸣等异常表现。
2.2 各组大鼠体质量、 瘤体质量及抑瘤率比较 给药前各组大鼠体质量差异无统计学意义(P>0.05)。药物干预8周后,各组间总体比较,大鼠体质量差异有统计学意义(P<0.05)。 与空白对照组比较,骨肉瘤模型组、骨肉瘤肺转移模型组、清肺固金组大鼠体质量均减轻,差异有统计学意义(P<0.05,P<0.01),其中骨肉瘤肺转移模型组平均体质量最轻,清肺固金组平均体质量最重,接近于空白对照组。与骨肉瘤模型组比较,骨肉瘤肺转移模型组瘤体质量增加18.70%, 体积增大31.85%;清肺固金组瘤体质量减轻6.5%,体积减少31.26%。 与骨肉瘤肺转移模型组比较,清肺固金组瘤体质量、 体积均明显减低, 差异有统计学意义(P<0.01)。 见表1。
2.3 转移灶评估结果 骨肉瘤模型组、 骨肉瘤肺转移模型组、清肺固金组均可见肺转移灶,两肺表面可见多处散发灰白色肺转移瘤结节,形态、大小、质地不一,触之较硬,有颗粒感。 骨肉瘤肺转移模型总转移级数及(Ⅲ+Ⅳ)肺转移灶数目最高,骨肉瘤模型组次之,清肺固金组最低;而清肺固金组(Ⅰ+Ⅱ)较低级别肺转移灶数目最高,但组间差异无统计学意义(P>0.05)。 见表2。
2.4 各组大鼠血清及瘤体IL-10、TGF-β1含量比较 空白对照组血清中IL-10、TGF-β1均有一定表达。 与空白对照组比较,骨肉瘤模型组、骨肉瘤肺转移模型组血清中IL-10、TGF-β1明显上调, 差异有统计学意义(P<0.05,P<0.01)。 与骨肉瘤模型组比较,骨肉瘤肺转移模型组血清及瘤体内IL-10、TGF-β1含量均增加,清肺固金组含量均有降低, 差异有统计学意义 (P<0.01,P<0.05)。 与骨肉瘤肺转移模型组比较,清肺固金组血清及瘤体内IL-10、TGF-β1含量均明显降低,差异有统计学意义(P<0.01)。 见表3。2.5 各组大鼠右胫骨组织CXCR4表达比较 与空白对照组比较,骨肉瘤模型组与骨肉瘤肺转移模型组的CXCR4蛋白表达增加(P<0.05)。 与骨肉瘤模型组比较,骨肉瘤肺转移组的CXCR4蛋白表达明显增加,差异有统计学意义(P<0.05)。 与两模型组比较,清肺固金组蛋白表达量明显减少,差异均有统计学意义(P<0.01)。 见图3、表4。

表1 各组大鼠体质量、瘤体质量及抑瘤率比较Tab.1 Comparison of body weight, tumor weight and tumor inhibition rate in each group

表2 各组大鼠肺转移情况及肺转移灶大小比较Tab.2 Pulmonary metastasis and size of pulmonary metastases in each group

表3 各组大鼠血清及瘤体IL-10、TGF-β1含量比较(x±s)Tab.3 Comparison of the contents of IL-10,TGF-β1 in serum and tumor in each group(x±s)

图3 各组右胫骨组织中CXCR4蛋白表达Fig.3 CXCR4 protein expression in right tibial tissue in each group

表4 各组大鼠CXCR4总光密度值比较(x±s,×106)Tab.4 Comparison of total optical density of CXCR4 in each group(x±s, ×106)
3 讨论
骨肉瘤是最常见的原发性骨恶性肿瘤,好发于儿童及青少年,每年发病率约为2~3/100万人,占所有骨恶性肿瘤的35%[6]。 在我国,每年约新增6 000~7 000例患者[7],严重威胁儿童和青少年的身心健康。 骨肉瘤恶性程度极高,容易发生侵袭转移,虽然有手术、化疗等综合治疗手段,仍有32%~46%患者发生肺转移,Ⅳ期患者5年生存率低于20%[8]。 因此,肺转移是导致骨肉瘤治疗失败及患者低生存率的根本原因,也是目前限制疗效的最主要因素。 寻找安全有效的药物以改善肺组织局部微环境,降低远处转移发生率,已成为当前骨肉瘤研究新的突破方向。
骨肉瘤属于中医学中的 “骨瘤”“骨疽”“下石疽”等病证范畴。 本病多由禀赋不足,正气亏虚,邪气趁虚而入,随经络气血走行,深入骨髓,导致气血凝滞,经络受阻,伤筋蚀骨,日久结毒成瘤。 如李中梓[9]在《医宗必读》中云:“积之成也,正气不足,而后邪气踞之。 ”邪毒乘虚随经气或血脉流窜,客于脏腑,日久成积, 从而导致骨肉瘤的复发和转移。 肺主一身之气,调节全身气机,宣发肃降,布散全身津液;肺朝百脉,全身血液朝会于肺, 故不论是气的走行还是津液、血液的运行,均通过经脉上达于肺;且肺为娇脏,五脏华盖,不耐寒热,易被邪侵,因此肺首当其冲成为骨瘤最易侵袭转移的部位。 化疗、 手术治疗后脾胃受损,运化失司,气血生化乏源,常引起肺气不足。 《素问·六节藏象论》谓:“肺者,气之本,魄之处也。 ”肺气虚,不能行气运血、布津化痰,进而痰浊阻滞、痰瘀互结,复感癌毒,肺积乃成。正如《医门法律》所言:“肺气清肃,则周身之气莫不服从而顺行;肺气壅浊,则周身之气易致横逆而犯上。 ”[10]本病以肺(气)虚为本,痰阻为标,本虚标实,由此笔者推测,肺气虚后期形成的“痰浊”等病理产物可能是导致肺组织免疫抑制微环境形成的重要条件,随着病情进展,最终形成适宜循环肿瘤细胞定植生长的“土壤”,促进肿瘤转移的发生。 因此,在肿瘤治疗中,特异性地保护靶器官微环境,正契合中医治未病思想,“未病先安未受邪之地”[11], 调整气血阴阳平衡,阻断肿瘤转移扩散的途径,对于预防肿瘤转移有着重要的实践价值。
本课题组依据中医有关骨肉瘤的病因病机,结合肺转移的病理基础,采用浙江省名中医刘云霞的经验方“清肺固金汤”配合化疗预防骨肉瘤术后的复发和转移,取得了显著的疗效[2]。 全方由黄芪、浙贝、薏苡仁、白花蛇舌草、桔梗组成,其中黄芪、浙贝、薏苡仁均入肺经,桔梗更是肺之引经药,共奏化痰清肺、益气固金之效,能够有效防治骨肉瘤肺转移。 张红翠[12]研究发现,黄芪多糖可通过提高淋巴细胞增殖率,增强自然杀伤(natural kiuer,NK)细胞和巨噬细胞活性,进而提高机体的免疫功能,发挥抗肿瘤的作用。 薏苡仁多糖对肿瘤细胞不仅具有直接杀伤作用,还能通过激活免疫细胞如NK细胞、T细胞等间接攻击肿瘤细胞,并且在相对浓度较低情况下就可以表现出免疫调节作用[13]。 白花蛇舌草包括171种化合物,包括环烯醚萜、三萜类、黄酮类、蒽醌类等,具有抗氧化、抗肿瘤、抗炎、抗成纤维细胞、免疫调节和神经保护等多种作用,并能调节多个基因的表达[14]。
肿瘤转移是在多基因调控、多靶点作用下的复杂病理过程,包括肿瘤细胞运动迁移、免疫逃逸、归巢定植、黏附浸润、新生血管生成等[15-17]。 对于骨肉瘤患者,肺组织作为循环肿瘤细胞特异性亲和器官,其局部微环境中免疫活性细胞的种类、密度、分布和功能状态与肿瘤的发展和预后都有着极其密切的联系。肿瘤微环境中聚集的大量免疫抑制细胞及其分泌的负性免疫调节因子是其发挥免疫监视逃逸效应的主体。研究表明,调节性T细胞(T regulatory cells,Tregs)作为最典型的免疫抑制细胞,在肿瘤病变部位普遍存在,可大量分泌TGF-β1、IL-10等负性免疫调节因子,其免疫抑制作用已被证实[18-19]。 TGF-β1和IL-10通过促进叉头框蛋白P3(forkhead box protein P3,FoxP3)和细胞毒性T细胞相关抗原-4 (cytotoxic T lymphocyte-associated antigen-4,CTLA-4)的表达来增强诱导型Treg的分化,从而促进肿瘤的免疫逃逸[20]。Sawant等[21]研究报道,在肿瘤微环境中Tregs细胞亚群分泌IL-10和IL-35, 并通过调节多种抑制性受体表达,协同促进肿瘤内T细胞功能衰竭。 TGF-β1在免疫抑制微环境形成过程中起先导作用,其主要通过抑制机体的免疫功能[22],造成Treg/Th失衡,进而募集髓源抑制性细胞(myeloid derived suppressor cell,MDSC),抑制细胞毒性T细胞 (cytotoxic T lymphocyte,CTL)及NK细胞浸润, 促使循环肿瘤细胞 (circulating tumor cells,CTCs)逃避机体的免疫监视;同时上调血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达,增加新生血管生成,从而促进肿瘤的恶化和转移[23]。
CXCR4是编码352个氨基酸的G蛋白偶联受体,有7个跨膜结构域,高度保守,其基因位于第4号染色体。 研究表明,CXCR4在超过23种恶性肿瘤细胞中表达,普遍存在于骨肉瘤细胞中,与骨肉瘤肺转移关系密切[24-25]。 CXCR4的异常表达与肿瘤的存活增殖、血管生成、归巢转移密切相关。 研究显示,CXCR4在胰腺癌、子宫内膜癌等肿瘤中均呈高表达状态,同时与生存率密切相关[26-27]。 在骨与软组织肉瘤中,荟萃分析证实了CXCR4表达与较高的转移率及不良预后密切相关[25]。Pollino等[28]研究也显示,骨肉瘤中CXCR4的高表达使肿瘤复发的可能性更高。 动物实验发现,阻断趋化因子配体12(cxcligand 12,CXCL12)/CXCR4表达可以减少小鼠骨肉瘤肺转移的发生[29]。 因此,CXCR4可能是监测患者预后的重要预测因子。
本研究成功建立了“肺虚痰阻证”骨肉瘤肺转移病证结合大鼠模型,进一步研究发现,与骨肉瘤模型组比较,骨肉瘤肺转移模型组体质量减轻,清肺固金组体质量增加。 说明清肺固金汤在维持荷瘤大鼠体质量、提高生存质量方面具有明显的作用。 与骨肉瘤模型组、骨肉瘤肺转移模型组比较,清肺固金组瘤体质量、体积均明显减少。 病理检查发现,骨肉瘤肺转移模型组的肺转移灶数目最多,Ⅲ+Ⅳ级结节比例最高,而清肺固金组肺转移灶数目及Ⅲ+Ⅳ级结节比例均为最低。 该结果提示,清肺固金汤对骨肉瘤细胞的增殖和转移行为均具有显著的抑制作用。 ELISA及Western blot结果显示,与空白对照组比较,骨肉瘤模型组、 骨肉瘤肺转移模型组的血清IL-10、TGF-β1含量以及右胫骨CXCR4蛋白表达均增加; 与骨肉瘤模型组比较,骨肉瘤肺转移模型组血清及瘤体内IL-10、TGF-β1含量,右胫骨CXCR4蛋白表达进一步增加,而清肺固金组能够抑制IL-10、TGF-β1含量及CXCR4蛋白表达。 由此可见,清肺固金汤具有较好的抗骨肉瘤肺转移作用,其作用可能与下调肺组织免疫微环境相关细胞因子IL-10、TGF-β1表达, 抑制趋化因子受体CXCR4表达有关。
综上所述,本研究初步探讨了清肺固金汤通过调控肺组织免疫微环境及靶向CXCR4受体发挥抗肿瘤转移的分子机制,但其具体有效作用成份及结合位点尚不明确, 有待进一步深入研究。 本研究的开展,为揭示中医药靶向治疗的可行性及科学内涵,以及清肺固金汤等中药复方更好地研究开发和临床应用提供了可靠的理论和实验依据。

