消瘀泄浊饮对CKD2~4 期患者免疫调节功能及微炎症状态的影响
王安妮 鲁科达 夏璁 朱梦洁 来洁 何灵芝
1.杭州市中医院 杭州 310007 2.浙江中医药大学附属第一医院 3.浙江绿城心血管病医院4.浙江中医药大学第一临床医学院
微炎症状态是一种非微生物感染引起的、以促炎症因子释放增加为关键环节的持续而轻微的炎症反应。 研究认为,微炎症状态能够刺激循环免疫复合物生成,加重营养不良、贫血状态,增加心血管事件发生风险等, 从多方面加速慢性肾脏病(chronic kidney disease,CKD)的进展[1-3]。“消瘀泄浊饮”系国家级名中医李学铭教授治疗慢性肾衰竭气虚夹瘀浊证的自拟方,本课题组通过前期研究证明“消瘀泄浊饮”能够降低促炎因子白介素-6(interleukin-6,IL-6)、白介素-17(interleukin-17,IL-17)水平,升高抑炎因子白介素-10(interleukin-10,IL-10)水平,从而改善CKD患者的微炎症状态[4]。IL-17由辅助性T细胞17(helper T cell 17,Th17) 特异性分泌,IL-17水平升高提示患者体内Th17细胞比例升高;IL-10是调节性T细胞(regulatory T cell,Treg) 发挥免疫抑制作用的重要参与因子,IL-10水平降低预示着Treg的不足。Th17、Treg在维持人体免疫平衡中起到重要作用。 维甲酸相关孤儿受体γt(retinoid-related orphan receptor γt,RORγt)、叉头框转录因子p3(forkhead box p3,Foxp3) 分别是Th17、Treg的特异性转录因子, 在Th17、Treg分化发育、分泌效应因子等过程中发挥重要作用[5-6]。 本研究拟观察消瘀泄浊饮对CKD 2~4期患者免疫平衡及微炎症状态的影响,并探讨其可能的作用机制。
1 对象和方法
1.1 病例资料 选取2015年11月1日至2018年9月30日在浙江中医药大学附属第一医院肾病科门诊及住院诊治的CKD2~4期患者80例, 采用随机数字表法分为对照组和治疗组各40例。 两组患者的性别、 年龄、病程、分期、原发病差异均无统计学意义(P>0.05),具有可比性。 见表1。

表1 两组患者一般资料比较
1.2 纳入标准、 排除标准与退出标准 本研究已通过浙江中医药大学附属第一医院伦理审查委员会审查。
1.2.1 纳入标准 (1)符合改善全球肾脏病预后(Kidney Disease Improving Global Outcomes,KDIGO)组织2012年发布的《KDIGO慢性肾脏病评价管理临床实践指南》[7]中“慢性肾脏病定义与分期”CKD 2~4期标准,即15mL·min-1≤双肾肾小球滤过率(glomerular filtration rate,GFR)<90mL·min-1。 本研究中双肾GFR以99m锝-二乙三胺五乙酸肾动态显像法测定。(2)中医证型为气虚夹瘀浊证,辨证分型参照《中药新药临床研究指导原则》[8]。 (3)年龄18~65岁。 (4)自愿参与临床研究,并签署知情同意书。
1.2.2 排除标准 (1)6个月内使用过血管紧张素转换酶抑制剂/血管紧张素Ⅱ受体拮抗剂、 激素和免疫抑制剂者;(2) 急性肾功能衰竭以及行肾脏替代治疗者;(3)合并酸中毒、水电解质紊乱、难以纠正的感染或出血者,以及脏器功能严重受损者;(4)合并恶性肿瘤者;(5)妊娠或哺乳期女性。
1.2.3 剔除标准 (1)依从性差,不规律用药者或对药物成分过敏者;(2)治疗过程中出现血肌酐(serum creatinine,sCr)持续升高,达到或超过707μmol·L-1者;(3)治疗过程中出现难以纠正的酸中毒、 高血钾、肿瘤、脑血管意外、重症感染等严重合并症者;(4)治疗过程中发生妊娠者。
1.2.4 脱落标准 (1)治疗过程中主动退出临床试验者;(2)随访过程中联系中断者。
1.3 干预方案
1.3.1 对照组 予基础治疗, 主要包括:(1)规律起居,避免剧烈运动;(2)优质低蛋白饮食(蛋白质摄入量0.6~0.8g·d-1);(3)复方α-酮酸制剂口服,1片/5kg体重(北京费森尤斯卡比医药有限公司产品, 剂量:0.63g/片,国药准字:H20041442);(4)控制血压,目标为130/80mmHg。
1.3.2 治疗组 在对照组基础上,结合中医辨证加用消瘀泄浊饮治疗,药物统一由浙江中医药大学附属第一医院中药房提供。 具体组成:生黄芪30g,牛膝12g,桃仁12g,地龙12g,制大黄10g,车前草20g。随症加减:尿中蛋白多者,加蝉衣6~9g、僵蚕9g;镜下血尿多者,加茜草12g、白茅根15g、蒲黄炭10g;水肿明显者,加茯苓皮30g、车前子30g;纳呆苔腻,加米仁30g、六神曲12g;腰酸腰痛者,加炒川断15g、炒狗脊15g、制川乌6g;夜尿多者,加覆盆子15~30g、金樱子15g、芡实10g;寐差者,加丹参15g、五味子6g。 用法:1剂/d,水煎服,分温二服,共服12周。
1.4 指标评估
1.4.1 安全性指标 入组前及治疗开始后每14d监测患者血压、心电图和肝功能、电解质水平。
1.4.2 疗效性指标 入组前及治疗后分别以反转录-聚合酶链反应检测RORγt、Foxp3 mRNA相对表达量,以免疫比浊法检测超敏C反应蛋白(high sensitivity-C reactive protein,hs-CRP)水平。 sCr、血尿素氮(blood urea nitrogen,BUN)、24h尿蛋白定量(24-hour urinary protein quantity,24Upr)水平检测采用全自动生化分析仪完成。
1.5 统计学分析 应用SPSS 19.0统计软件进行统计学分析。 计量资料以x±s表示,两组间比较,满足正态分布和方差齐性的采用t检验, 不满足的采用Wilcoxon Mann-Whitney秩和检验; 两组治疗前后组内比较,满足正态分布的采用配对t检验,不满足的采用配对秩和检验。 计数资料组间比较采用χ2检验。 以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗前后RORγt mRNA、Foxp3 mRNA表达比较 治疗前两组患者RORγt mRNA、Foxp3 mRNA表达差异均无统计学意义(P>0.05)。 与治疗前比较, 治疗组治疗后RORγt mRNA水平下降、Foxp3 mRNA水平升高,差异均有统计学意义(P<0.05);对照组治疗后RORγt mRNA、Foxp3 mRNA表达差异无统计学意义(P>0.05)。两组治疗前后指标差值组间比较, Foxp3 mRNA差值、RORγt mRNA差值差异有统计学意义(P<0.05)。 见表2。
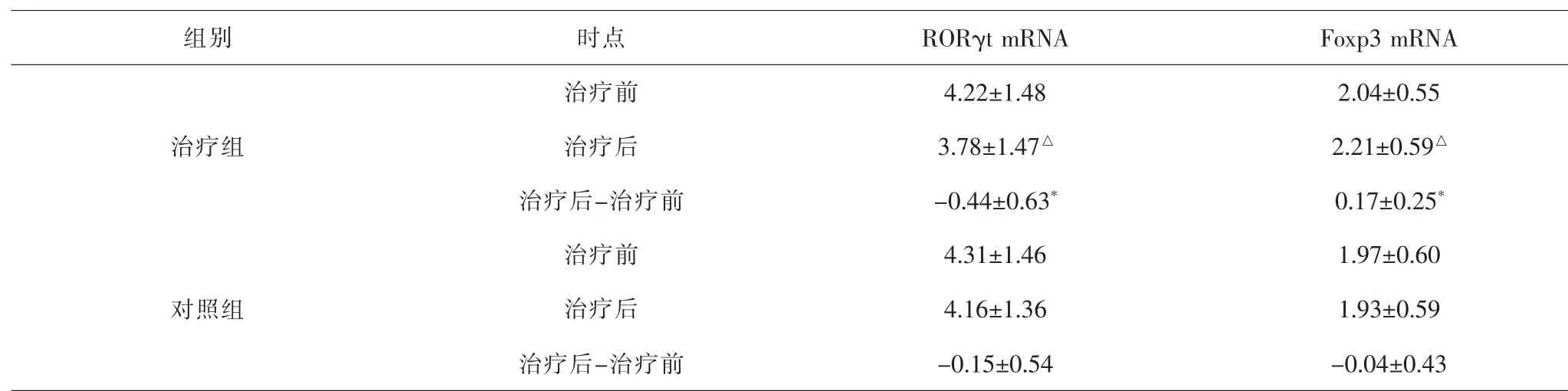
表2 两组患者治疗前后RORγt mRNA、Foxp3 mRNA表达比较(×10-4)
2.2 两组患者治疗前后hs-CRP水平比较 治疗前两组hs-CRP水平差异无统计学意义(P>0.05)。 与治疗前比较,治疗组治疗后hs-CRP水平下降,差异具有统计学意义(P<0.05);对照组hs-CRP水平差异无统计学意义(P>0.05)。 两组治疗前后指标差值组间比较,hs-CRP水平差值差异有统计学意义(P<0.05)。 见表3。
2.3 两组患者治疗前后sCr、BUN、24Upr水平比较 治疗前两组sCr、BUN、24Upr水平差异无统计学意义(P>0.05)。 与治疗前比较,治疗组治疗后sCr、BUN、24Upr水平下降,差异有统计学意义(P<0.05);对照组治疗后sCr、BUN、24Upr水平差异无统计学意义(P>0.05)。两组治疗前后指标差值组间比较,sCr、BUN水平差值差异有统计学意义(P<0.05);24Upr水平差值差异无统计学意义(P>0.05)。 见表4。
2.4 安全性指标 本研究期间,对照组有1例患者血钾轻度升高,予利尿排钾治疗后,血钾恢复正常。 两组均无患者退出研究。
3 讨论
消瘀泄浊饮是国家级名中医李学铭教授治疗慢性肾衰竭气虚夹瘀浊证的自拟方, 全方由生黄芪、制大黄、牛膝、桃仁、地龙、车前草组成。 方中重用生黄芪,使气旺血行、瘀去络通;制大黄荡涤肠胃积滞,使邪从大便而去,共为君药。 牛膝活血化瘀,性善下行,使小便通利、大便易泻;地龙善走窜,通经络,利小便,可引诸药通行肾络;桃仁祛瘀通便;车前草通下利水,四药共用,可荡涤瘀浊,使邪从二便而去,共为臣药。方中六药同行,共奏益气行血、祛瘀化浊之效。 研究表明,黄芪能够上调基质金属蛋白酶2表达,下调转化生 长 因 子-β1(transforming growth factor-β1,TGFβ1)、基质金属蛋白酶抑制因子1和血管紧张素Ⅱ的表达,抑制p38丝裂原活化蛋白激酶(mitogen activated protein kinases,p38 MAPK)信号通路,并能降低氧化应激损伤,从而保护肾脏[9-10]。 大黄能通过改善氨基酸循环、胰岛素抵抗和血脂紊乱状态来改善肾功能[11-12]。牛膝可下调p53基因表达, 上调鼠双微体2(murine double minute 2,mdm2)基因表达,抑制肾组织细胞凋亡[13]。地龙可通过抗氧化和调节细胞因子水平来抑制肾小球系膜细胞增殖,降解细胞外基质[14]。 桃仁能降低核因子-κB(nuclear factor-κB,NF-κB)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平,延缓肾间质纤维化进程[15]。车前草能够通过增强蛋白分子CD2相关蛋白(CD2-associated protein,CD2AP)及nephrin的表达, 从而维持肾足细胞的生物学功能[16]。可见消瘀泄浊饮能从调节免疫功能、减少氧化应激损伤、改善营养物质代谢等多方面延缓肾病进展。 本研究结果亦提示消瘀泄浊饮在改善免疫调节功能及微炎症状态方面起着积极作用, 其机制可能与下调RORγt mRNA、 上调Foxp3 mRNA水平、 调节Th17/Treg平衡相关。

表3 两组患者治疗前后hs-CRP比较(mg·L-1)
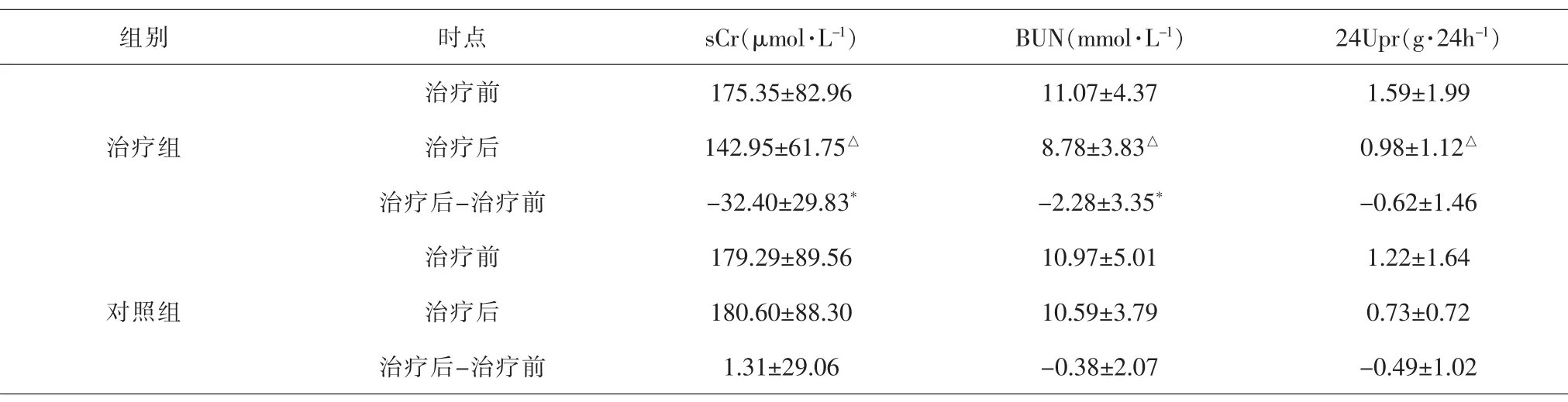
表4 两组患者治疗前后sCr、BUN、24Upr比较
Th17由初始CD4+T细胞在TGF-β、IL-6诱导下分化而来,并在RORγt作用下产生促炎因子IL-17。 微炎症状态下,Th17的分化、RORγt mRNA的表达及IL-17的分泌均会增加[17]。IL-17可促进单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1/CCL2)、巨噬细胞炎性蛋白-1α(macrophage inflammatory protein-1α,MIP-1α/CCL3)等的释放,招募T淋巴细胞和单核-巨噬细胞在肾小球系膜细胞附近浸润[18];并可诱导基质细胞产生IL-6、TNF-α等炎性因子, 促进基质金属蛋白酶的表达,导致炎性细胞浸润和组织损伤; 还能诱导足细胞凋亡, 造成肾功能减退[19]。Eller等[20]研究发现,抑制Th17活化、减少IL-17表达可延缓糖尿病肾病发展。
Treg细胞通过直接抑制及分泌IL-10等细胞因子抑制免疫应答。 Foxp3是Treg的特征性转录因子,在Treg细胞的分化及细胞因子分泌过程中起重要作用。微炎症状态可能会减弱Treg细胞的免疫抑制效应。有研究指出,促炎因子IL-6能够抑制诱导性Treg在外周的发育, 该过程可能与上调miR-34a及miR-31的表达、促进NF-κB磷酸化,导致Foxp3 mRNA翻译受阻有关[21]。 另外也有研究证明,抑制Foxp3基因表达会导致Treg抑炎因子IL-10的产生和分泌下降, 其机制可能是与其他转录共调节蛋白如活化T细胞核因子(nuclear factor of activated T cells,NFAT)、NF-κB、runt相关转录因子1 (runt related transcription factor 1,Runx1)等形成蛋白复合体相关[22]。 Foxp3的表达下降引起Treg细胞及IL-10水平降低, 使免疫平衡向炎症方向倾斜,进一步加重微炎症状态。
Foxp3 mRNA对RORγt mRNA的表达也有一定影响。Ryba-stanistawowska等[23]的研究发现,在一定浓度的TGF-β作用下,Foxp3 mRNA的特定结构域能够竞争性结合维甲酸相关孤儿核受体C (retinoic acid receptor related orphan C,RORC), 招募乙酰基转移酶(Tat-interactive protein,TIP)和去乙酰化酶,致使靶基因组蛋白转录沉默, 从而抑制RORγt mRNA的转录活性。 微炎症状态下,Foxp3表达下降,对RORγt的抑制作用减弱,使Th0更趋向于分化为Th17,产生促炎因子, 进一步加重微炎症状态。 有研究发现,增加Treg细胞损耗, 降低IL-10水平会增加小鼠模型尿蛋白/肌酐比值, 从另一角度证明适当提高Treg细胞比例和IL-10水平对肾功能具有保护作用[20]。
既往观点认为hs-CRP是一种非特异的炎症标志物,随着认识的深入现已将其作为CKD微炎症状态的重要评判指标[24],而且其本身也参与到肾脏损害的过程中。 作为促炎因子,hs-CRP主动参与炎症反应,能与肾小管上皮细胞表面的相应受体结合,释放趋化因子C-X3-C基元配体1(C-X3-C motif chemokine ligand 1,CX3CL1)和TGF-β1,使基质中Ⅰ型胶原蛋白含量增加,加速肾脏纤维化[25]。 本研究证明消瘀泄浊饮能够降低CKD2~4期患者hs-CRP水平,减轻微炎症状态。 同时本研究也提示消瘀泄浊饮能够降低sCr、BUN、24Upr水平, 证明其具有增加代谢产物排泄、保护肾功能的作用,与既往研究结果一致[26-27]。
综上所述, 消瘀泄浊饮能够改善CKD2~4期患者Th17/Treg细胞平衡及微炎症状态,从而延缓肾脏病进展。 在日后的研究中,可以采用流式细胞检测技术直接检测Th17、Treg细胞水平,进一步完善实验结果。

