实体器官移植他克莫司个体化治疗专家共识Δ
陈文倩,张 雷,张 弋,孙丽莹,陈文慧,黄 洁,王 卓,王晓星,李 沭,柳 芳,廖中凯,王学彬,张相林1,#
(1.中国药理学会,北京 100050;2.中日友好医院药学部,北京 100029;3.中国人民解放军海军军医大学第一附属医院/上海长海医院器官移植科,上海 200433;4.天津市第一中心医院药剂科,天津300192;5.首都医科大学附属北京友谊医院肝脏移植中心,北京 100050;6.中日友好医院肺移植科,北京100029;7.中国医学科学院阜外医院心力衰竭中心,北京 100037;8.中国人民解放军海军军医大学第一附属医院/上海长海医院药学部,上海 200433)
1 前言
1.1 药品概述
他克莫司的分子式为C44H69NO12,分子量为804.018,属于大环内酯类强效免疫抑制剂,目前国内外有8种剂型多种规格,其中注射剂和口服制剂主要用于器官移植的免疫抑制治疗。我国主要批准他克莫司用于肝、肾移植的抗排斥治疗[1-4];在上述适应证基础上,欧洲药品管理局、美国食品药品监督管理局批准他克莫司用于心脏移植[2-3],日本批准他克莫司用于心脏、肺、胰、小肠、骨髓和角膜移植的抗排斥治疗[4]。
他克莫司在器官移植领域使用广泛,其治疗指数窄、个体差异大、药物暴露影响因素多、药物相互作用广泛,作为狭窄治疗指数(narrow therapeutic index,NTI)类药物,治疗中的微小变化可产生较大的治疗风险,因此,推荐开展治疗药物监测(thera-peutic drug monitoring,TDM),以调整、优化其治疗方案[5-7]。
1.2 规范性文件发布概况
国内外已有大量有关器官移植领域的规范性文件,《实体器官移植他克莫司个体化治疗专家共识》(以下简称“本共识”)起草专家组梳理了1999—2020年发布的指南和共识54篇,其中循证指南和共识19篇,未描述证据水平和推荐等级标准的非循证指南和共识35篇;对偏重领域进行细分,器官移植诊疗20篇,移植并发症管理12篇,药物治疗22篇(他克莫司10篇);有29篇为中国机构制定。归纳文件中有关他克莫司的内容,主要包括:推荐使用他克莫司作为一线钙调神经磷酸酶抑制剂(calcineurin inhibitor,CNI);推荐在治疗期间监测他克莫司血药浓度;药物基因型检测有助于指导移植后免疫抑制方案;高剂量的他克莫司与新发糖尿病的风险增加相关;使用他克莫司能够更好地预防排斥反应,且与较高的移植物存活率相关。
1.3 共识制定意义
开展TDM是器官移植中免疫抑制治疗必要的药学技术支持手段,在调整优化个体化给药方案、保证免疫抑制效果和降低安全风险方面具有积极的意义。2018年对我国开展TDM的调查结果显示,205家开展TDM的医院中,监测环孢素、他克莫司和霉酚酸酯的医院分别有184、88和36家,2017年的监测总量分别为284 131、229 789和39 453例次。可以看出,医院间、药品间存在TDM技术支持差异,意味着不同医疗机构并未能提供同质化的药学技术规范性服务。目前,国家卫生健康委员会在全国已批准认定180家器官移植中心,加强和完善同质化的个体化药学技术支持很有必要。
TDM是以药物个体化治疗为核心的药学技术工作,有利于临床加强以患者为中心的全程药物治疗管理,提高药品的安全性、有效性和经济性。器官移植免疫抑制治疗的TDM已普遍开展,尚未见全面、系统的TDM规范类指南,特别是医师、药师和医疗团队的其他学科成员共同合作形成专业共识,尚属首次。本共识编制可促进他克莫司在器官移植领域的问题得到进一步解决,为临床医师、药师及医疗团队成员提供指导性参考,提高合理用药水平,为医药跨学科深度协作提供范例。
2 临床应用
器官移植是迄今治疗终末期器官功能衰竭最理想的手段,免疫抑制剂的应用是提高移植物和受者长期存活率的重要保障,大部分移植患者需要长期甚至终身服用免疫抑制剂。目前,免疫抑制治疗分为免疫诱导治疗和维持治疗。免疫诱导治疗是指移植围手术期短期实施的免疫抑制治疗,免疫维持治疗是指术后长期甚至终身采用的免疫抑制治疗[8]。2018年美国国家器官获取及移植网络/器官移植受者科学登记系统(OPTN/SRTR)的年度报告显示,实体器官移植受者多数采用以他克莫司为基础的免疫抑制维持方案[9]。根据实体器官移植的种类、维持治疗所处的时期以及他克莫司剂型的不同,他克莫司的使用方法和目标浓度也存在差异。
2.1 他克莫司在肾脏移植中的使用方法和目标浓度
2.1.1 使用方法:(1)肾移植受者的初始应用。①他克莫司胶囊的初始剂量。日总量为0.075~0.250 mg/kg,分2次服用,间隔12 h(早晨和晚上),最好用水送服。建议空腹服用,或者至少在餐前1 h或餐后2~3 h服用。如必要,可将胶囊内容物悬浮于水,经鼻饲管给药[10]。②他克莫司缓释胶囊的初始剂量。总量与常释胶囊一致,每日早晨空腹顿服。③初始应用时间。a.心脏死亡器官捐献(deceased cardiac donor, DCD)供肾移植,常规是于术后开放饮食后开始口服;部分中心于术前2 h服用首剂;连续检测他克莫司谷浓度(C0)及时调整剂量,要求在术后1周内达到目标浓度。b.活体肾移植,他克莫司胶囊的初始应用时间、给药剂量和目标血药浓度同尸体肾移植受者[10];给予他克莫司缓释胶囊时,考虑到其达到稳定的目标C0较他克莫司胶囊慢,可以在术前3~7 d开始给药,起始日剂量为0.10~0.15 mg/kg[11]。④静脉注射剂的初始应用。若受者不能口服,则需静脉给药,日总量为0.05~0.10 mg/kg[10]。一般总量不超过2 mg。于移植肾再灌注后开始24 h持续静脉泵注,根据血药浓度、患者反应以及药品不良反应调整泵速。2~3 d后或患者情况允许即转为口服给药[12]。⑤他克莫司颗粒的初始应用。另见儿童移植。
(2)维持期剂量调整。①他克莫司胶囊的剂量调整:应基于目标血药浓度进行调整,少量多次,避免“大起大落”。移植后6周内浓度“宁高勿低”,低浓度必须迅速足量上调剂量,以迅速达到治疗浓度窗口。②长期以CNI为基础免疫抑制方案且未发生过排斥反应的低危受者,如出现血清肌酐慢性升高,且有明确证据证实其与CNI肾毒性相关,可以考虑转换为无CNI免疫抑制维持治疗方案[8]。目前,无CNI免疫抑制方案的使用并不普遍且不成熟,应密切关注其安全性和耐受性问题。
2.1.2 目标浓度与监测:(1)初始使用目标浓度。如肾功能正常恢复,则通过提高监测频次,在1周内加量使C0达到10~15 ng/ml;如肾功能延迟恢复,可加用其他免疫抑制剂,降低他克莫司用量,将C0控制在6~10 ng/ml。静脉制剂因其血药浓度峰谷现象得以改善,所以其靶值应略高于口服药谷值水平[10]。
(2)维持期治疗目标浓度。根据目前国内肾移植术后常用的含有他克莫司的方案,即他克莫司+吗替麦考酚酯(mycophenolate mofetil,MMF)+糖皮质激素,建议术后各时段他克莫司目标C0维持水平为:0~3个月为8~15 ng/ml,4~6个月为6~12 ng/ml,7~12个月为5~10 ng/ml,>12个月为5~9 ng/ml(特殊情况下,遵医嘱调整)[10]。
(3)血药浓度监测。他克莫司浓度的监测频率根据临床需要而定。一般情况下,移植后1~2周,每周监测1~2次,以后逐渐减少,第3、4周每周1次,第5—12周每2周1次。特殊情况下,如出现肝功能改变、药品不良反应以及使用能改变他克莫司药动学(pharmacokinetics,PK)的药物时,必须增加监测频率。如遇剂量调整、品牌更换、其他免疫抑制剂转换为他克莫司、合用可能影响他克莫司浓度的药物时,均应监测血药浓度[10]。
2.2 他克莫司在肝脏移植中的使用方法和目标浓度
2.2.1 使用方法:(1)肝移植受者的初始应用。①他克莫司胶囊的初始剂量。起始日剂量为0.075~0.150 mg/kg,分2次服用,间隔12 h(早晨和晚上),最好用水送服。建议空腹,或者至少在餐前1 h或餐后2~3 h服用。如必要,可将胶囊内容物悬浮于水,经鼻饲管给药[13]。②他克莫司缓释胶囊的初始剂量。总量与常释胶囊一致,每日早晨空腹顿服[14]。③初始使用时间。不论口服还是静脉给药,首次剂量宜在肝移植后6~48 h内给予,肾功能不全者可根据情况推迟给药[13]。④静脉注射剂的初始应用。若受者不能口服,首剂需静脉给药,日总量为0.01~0.05 mg/kg,24 h持续静脉泵注,根据血药浓度调整泵速。⑤他克莫司颗粒的初始剂量。另见儿童移植。
(2)维持期剂量调整。维持治疗期间,在对排斥反应和受者耐受性进行综合评估的基础上,依据目标血药浓度调整剂量。
2.2.2 目标浓度:(1)初始使用目标浓度。国内外不同移植中心在移植后早期的目标浓度略有不同,常用的他克莫司C0范围为8~12 ng/ml[13]。(2)维持期治疗目标浓度。参考2018年国际肝移植学会(ILTS)专家共识中关于肝移植免疫抑制治疗的推荐,建议术后各时段他克莫司目标C0为,0~3个月为10~12 ng/ml,3~6个月为6~8 ng/ml,7~12个月5~7 ng/ml,>12个月为3~7 ng/ml(特殊情况下,遵医嘱调整)[15]。
2.3 他克莫司在心脏移植中的使用方法和目标浓度
他克莫司通常与糖皮质激素及霉酚酸酯等其他免疫抑制剂联合应用。国际心肺移植协会(ISHLT)的年度报告表明,2010年1月至2018年6月,他克莫司在心脏移植术后随访1年以内的受者中的使用比例为84%~89%,服用他克莫司的排斥反应发生率低于服用环孢素A[16]。
2.3.1 使用方法:(1)心脏移植受者的初始应用。①他克莫司胶囊的初始剂量。日总量为0.05~0.25 mg/kg,分2次服用(早晨和晚上),最好用水送服。建议空腹服用,或者至少在餐前1 h或餐后2~3 h服用。如必要,可将胶囊内容物悬浮于水,经鼻饲管给药。应保证他克莫司C0在目标范围内,保证足够的免疫抑制强度,避免排斥反应的发生。②鉴于心脏移植一般采用免疫诱导治疗,延缓他克莫司开始使用时间相对比较安全[17]。对于心脏移植术前或术后早期肾功能异常的受者,可以在肾功能好转时,从最小剂量(0.5 mg,每12 h给药1次)开始服用,逐渐加量。因血肌酐升高显著,他克莫司浓度难以达标者,可以加用西罗莫司(手术等伤口愈合良好以后)。同时,对于各种原因未达到目标浓度的,必要时进行心内膜心肌活检,甄别是否出现排斥反应[18]。
(2)维持期剂量调整。主要根据心脏移植受者的排斥反应发生情况及对免疫抑制剂的耐受性来调整剂量。部分受者属他克莫司快代谢型,大剂量仍然不能达到目标浓度,需要转换为环孢素或其他免疫抑制剂。除非出现严重感染等相关并发症,一般不能停用他克莫司。肾功能不全的受者联合应用西罗莫司后,可以适当降低他克莫司的C0。服用环孢素A反复发生排斥反应的受者,可以考虑换用他克莫司作为挽救治疗。
2.3.2 目标浓度:心脏移植受者术后不同时期他克莫司C0维持范围为,0~3个月为10~15 ng/ml;3~12个月为8~12 ng/ml;>12个月为8~10 ng/ml;术后>24个月为6~10 ng/ml。如发生排斥反应,首先需要激素负荷治疗,并根据具体情况调整他克莫司剂量或免疫抑制剂的种类。中国医学科学院阜外医院统计资料显示,心脏移植受者术后1年内的他克莫司C0为(15.2±4.1)ng/ml;术后2年为(11.9±4.9)ng/ml;术后3年为(9.6±3.6)ng/ml;远期随访总体生存率比ISHLT注册数据高5%~15%。
2.4 他克莫司在肺移植中的使用方法和目标浓度
2.4.1 使用方法:(1)肺移植受者的初始应用。他克莫司是肺移植术后经典抗排斥方案的主要组成部分,是常用初始抗排斥方案用药之一,以他克莫司胶囊最为常用。他克莫司胶囊的初始剂量,一般按0.04 mg/kg,每12 h给药1次的方案起始给药。但由于肺移植具有不同于其他实体脏器移植的特点,初始他克莫司剂量需根据不同临床情况进行调整。①由于肺是开放器官,受者术前、供者相关及术后院内获得性肺部感染发生率显著高于其他实体器官移植,获得性肺部感染是肺移植术后早期导致患者死亡的重要病因。因此,在肺移植术后的他克莫司治疗中,需兼顾患者感染状况。在初始治疗阶段,一般通过检测患者基因型,同时根据是否应用免疫诱导治疗,适度降低他克莫司起始剂量,并通过早期监测等措施,尽量避免他克莫司浓度超出目标治疗范围。在存在感染的情况下,可根据感染部位、局部并发症及系统炎症反应情况,不同程度降低目标治疗浓度。肺移植术后侵袭性真菌感染发生率高,三唑类抗真菌药是强化预防和抢先治疗的主要用药之一,为避免早期出现他克莫司浓度超出治疗目标范围,需在三唑类抗真菌药起始治疗前,提前减量或停药下调他克莫司浓度。同时,有研究结果显示,他克莫司浓度达标时间与患者远期预后相关[19]。因此,在感染控制后,应及时调整他克莫司至目标浓度,以降低急性排斥事件风险,改善远期预后。②由于肺移植早期常见缺血再灌注肺损伤,常使用大剂量利尿剂,使体循环血容量处于相对不足状态,导致急性肾损伤(acute kidney injury,AKI)发生率高。因此,在他克莫司初始治疗过程中,需密切关注AKI发生情况,及时监测血药浓度,必要时下调他克莫司剂量,避免浓度超出目标范围。对于应用免疫诱导(巴利昔单抗)的受者,为避免他克莫司的肾毒性,有研究者提出巴利昔单抗的他克莫司豁免时间窗的概念,即在应用免疫诱导过程中,考虑其对淋巴细胞激活的显著抑制作用,主张下调他克莫司的目标浓度范围至2~4 ng/ml,以减轻药物导致AKI加重的风险[20]。因此,在临床上,对于应用标准免疫诱导的受者,他克莫司起始治疗剂量可酌情调整为0.02 mg/kg,每12 h给药1次,并在术后1周后逐步上调至早期目标剂量,可避免他克莫司的肾毒性与原发性移植物失功(primary graft dysfunction,PGD)高峰期利尿致AKI发生高峰重叠,降低AKI及远期慢性肾功能不全(chronic kidney dysfunction,CKD)的发生率。
(2)维持期剂量调整。①推荐所有肺移植受者维持期采用联合抗排斥方案,通常包括1种糖皮质激素、1种CNI(他克莫司、环孢素)和1种抗代谢药(霉酚酸酯、硫唑嘌呤)[21]。②以他克莫司为基础的联合抗排斥方案是目前国内外大多数肺移植中心的维持期治疗首选方案[22-24]。③与环孢素相比,他克莫司能够降低移植物的急性排斥反应和闭塞性细支气管综合征的发生率[25]。④肺移植术后维持期抗排斥治疗时,他克莫司胶囊的剂量一般为0.04 mg/kg,间隔12 h、每日固定时间给药,后续剂量应按照不同患者的目标C0进行个体化调整。
2.4.2 目标浓度:(1)初始使用目标浓度。对于无合并症的肺移植受者,应在术后1周内将他克莫司治疗浓度调整至术后早期目标浓度范围。移植术后0~3个月他克莫司的C0推荐维持在10~15 ng/ml,术后4~12个月为8~12 ng/ml,术后>12个月为6~8 ng/ml[25]。对于术后合并不同程度感染的受者,应酌情下调他克莫司目标浓度,尤其在合并重症感染,或出现吻合口瘘、脓胸或感染性休克的受者中,目标治疗浓度可继续下调。肺移植术后早期停用他克莫司需慎重。
(2)维持期治疗目标浓度。①肺移植术后维持期治疗应避免抗排斥强度过大,因其可导致各种感染、肿瘤的发生风险增加。②对肺移植术后的维持期(>1年)治疗,大多数移植中心会降低他克莫司的目标C0至6~8 ng/ml。但应基于不同患者的基础疾病、免疫状态、感染或肿瘤发生情况等进行动态化、个体化调整[26]。③对年轻、排斥高风险的肺移植受者,建议适当提高他克莫司的目标C0[27-28]。④对高龄、发生感染、肿瘤或其他他克莫司相关毒性反应的肺移植受者,建议适当降低他克莫司的C0。
肺移植术后不同时间段和临床因素对应的他克莫司目标C0范围见表1。
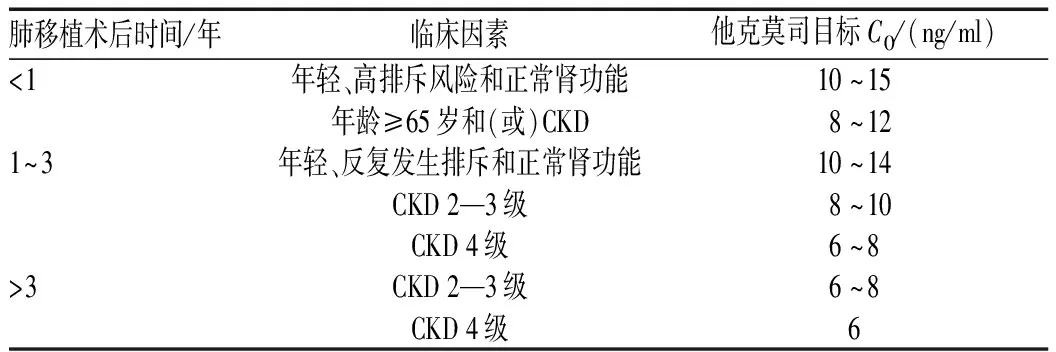
表1 肺移植术后不同时间段和临床因素对应的他克莫司目标C0范围
2.5 他克莫司在特殊移植人群中的应用
2.5.1 移植肾功能延迟恢复的受者:移植肾功能延迟恢复的免疫抑制治疗策略主要有减剂量或延迟使用CNI,并联合使用MMF和糖皮质激素,同时联合或不联合抗体治疗。使用抗体+小剂量他克莫司+MMF+糖皮质激素方案时,他克莫司的用量可采用常规剂量的1/2~2/3,将目标C0控制在治疗窗下限(5 ng/ml),以利于肾功能的恢复,并减少不良反应。待肾功能改善后,再增加他克莫司的剂量,使目标C0维持在6~10 ng/ml[10]。
2.5.2 肾功能受损的肝移植受者:对于伴有肾功能不全的受者,建议术后推迟(如5~7 d)使用他克莫司[15];可加用抗体诱导治疗,然后根据肾功能恢复情况给予最低推荐剂量(即推荐剂量下限)的他克莫司,同时根据具体情况进一步调整剂量。在治疗过程中出现肾功能受损的受者,他克莫司的剂量可减少20%,目标C0可维持在6 ng/ml(4~8 ng/ml)[13]。
2.5.3 发生移植后糖尿病(post transplantation diabete mellitus,PTDM)的受者:对于PTDM高危的受者或并发PTDM的移植受者,可采用无糖皮质激素的方案,或早期撤除糖皮质激素,同时密切监测他克莫司血药浓度,并及时调整其用量。移植术后第1个月,为了最大限度地减少急性排斥反应的风险,建议保持合理的有效治疗浓度(如移植术后2周维持血药浓度为12 ng/ml);术后>1个月,对于无排斥反应的受者,可考虑快速撤除糖皮质激素,同时早期减少他克莫司用量(如移植术后3个月时调整血药浓度至5 ng/ml),并维持治疗浓度(4~7 ng/ml)。对于绝大部分发生PTDM的受者,采取上述措施后可有效改善或逆转糖代谢紊乱[10]。
2.5.4 伴有高脂血症的受者:不同的免疫抑制剂对肾移植受者脂质代谢的影响不同。糖皮质激素、环孢素以及西罗莫司均可导致显著的血脂紊乱。与环孢素或西罗莫司相比,他克莫司对血脂的影响较小。因此,对于高脂血症受者,推荐采用以他克莫司为基础的免疫抑制方案[10]。
2.5.5 伴有高血压的受者:他克莫司治疗对移植后高血压的影响小于环孢素。如果确系因环孢素引起的高血压,可以考虑改用以他克莫司为基础的免疫抑制方案[10]。
2.5.6 儿童移植受者:他克莫司颗粒适用于儿童受者,也适用于吞咽困难或需精准剂量调整的成人受者。儿童肝移植和肾移植受者他克莫司颗粒口服初始日剂量应为0.15~0.30 mg/kg,心脏移植受者的初始日剂量为0.3 mg/kg,均分2次服用(早晨和晚上)[1]。首剂0.15 mg/kg于再灌注后24 h内的早晨给予(如果需要,心脏移植受者可延长至5 d)。根据我国临床实践的经验,儿童肝、肾移植受者中的维持C0为5~15 ng/ml[1]。如不能口服给药,则连续24 h静脉泵注。对于儿童受者,通常需用成人推荐剂量的1.5~2倍才能达到与成人相同的血药浓度(肝、肾功能受损等情况除外)。儿童肝移植受者的日剂量为0.05 mg/kg,儿童肾移植受者的日剂量为0.05~0.10 mg/kg[1]。
2.6 不同CNI药物之间的转换应用
2.6.1 环孢素与他克莫司在肾移植受者中的转换:(1)因急性排斥反应而转换者,他克莫司的起始日剂量为0.2 mg/kg,他克莫司胶囊分2次口服,他克莫司缓释胶囊1日给药1次,目标全血C0为10~15 ng/ml,此后根据具体情况调整剂量[10]。(2)因环孢素不良反应而转换者。他克莫司的起始日剂量为0.05~0.15 mg/kg,或为环孢素用量的1/50~1/30,他克莫司胶囊分2次口服。他克莫司缓释胶囊血药浓度更为平稳,可在转换初始3 d使用他克莫司胶囊,之后换为他克莫司缓释胶囊,1日1次,此后调整剂量,使1个月时的全血C0维持在5~15 ng/ml,6个月时的C0维持在4~10 ng/ml。(3)转换时机,环孢素末次给药后12 h给予首个剂量的他克莫司,若全血环孢素C0>300 ng/ml,则应延缓他克莫司的给药时间,直至环孢素C0<300 ng/ml。(4)肾功能异常的受者,根据PK原则无需调整剂量,但应仔细监测肾功能,计算肌酐清除率,监测尿量。
2.6.2 他克莫司与环孢素在肝移植受者中的转换:(1)对于从环孢素转换为他克莫司胶囊的受者,建议在停用环孢素后12 h开始使用他克莫司胶囊,空腹给药,或至少餐前1 h或餐后2~3 h口服[13]。①因排斥反应而转换者,他克莫司的日用量为0.10~0.15 mg/kg,分2次给药,目标C0为5~15 ng/ml。②因环孢素毒性而转换者,他克莫司的日用量为0.05~0.10 mg/kg,分2次给药,目标C0为5~8 ng/ml。(2)从环孢素方案转换为他克莫司缓释胶囊治疗时,要特别注意转换前患者的环孢素血药浓度和临床条件。如果环孢素血药浓度呈升高趋势,则要延迟转换,一般转换应在中断环孢素给药12~24 h后,对环孢素血药浓度监测也应在转换后继续进行,因环孢素的清除可能受到影响[1]。
2.6.3 从环孢素换用他克莫司颗粒:不推荐环孢素与他克莫司颗粒合用。在使用他克莫司颗粒前,应考虑环孢素的血药浓度和受者的临床状况。如果环孢素的血药浓度升高,应延缓给药。临床一般在中止环孢素治疗后12~24 h才开始给予他克莫司颗粒。转换后环孢素清除率可能受影响,故应持续监测环孢素的血药浓度[1]。
2.6.4 不同他克莫司剂型之间的转换:(1)他克莫司胶囊转换为他克莫司缓释胶囊。①肾移植转换方案。移植术后早期,由他克莫司胶囊转换为他克莫司缓释胶囊,应在肠运动恢复后进行[29]。如果他克莫司C0稳定在目标范围内或高于目标范围10%~20%(通常为移植术后第2周内),按照1∶1的剂量比由他克莫司胶囊转换为他克莫司缓释胶囊;如果C0低于目标范围,应该延迟转换;如果转换后C0降低幅度在目标范围的10%~15%内或保持稳定,无需调整剂量;如果C0降低幅度>目标范围的30%,应该增加剂量。②肝移植转换方案。a.肝移植术后早期(1个月内),由他克莫司胶囊转换为他克莫司缓释胶囊,按照1∶1.1~1∶1.2的剂量比进行转换,住院期间和出院后定期检测C0水平[30]。b.稳定期肝移植受者由他克莫司胶囊转换为他克莫司缓释胶囊的方案,适合转换的受者包括肝移植术后至少6个月、转换前2周他克莫司胶囊剂量保持稳定、肾功能保持稳定(肌酐≤2.0 mg/dl)、肝功能稳定(丙氨酸转氨酶及天冬氨酸转氨酶<2倍正常值上限),按照1∶1~1∶1.2的剂量比进行转换,转换后早期阶段密切监测他克莫司C0,C0较转换前升高或降低>20%的受者,应进行剂量调整[31-33]。③肺移植转换方案。a.推荐肺移植受者保持他克莫司单剂型给药[34]。b.维持期的肺移植受者,由他克莫司胶囊(1日2次)转换为他克莫司缓释胶囊(1日1次)给药时,推荐按照1∶1(mg∶mg)的日总剂量比进行转换,且转换前与转换后应密切监测他克莫司血药C0,并持续至转换后的2周内[35]。c.他克莫司胶囊与他克莫司缓释胶囊2种剂型中,他克莫司C0与全身暴露量[药时曲线下面积(AUC0~24)]具有相关性。d.在不进行监测的情况下,他克莫司胶囊与他克莫司缓释制剂之间的转换治疗是不安全的,将导致移植物排斥或增加不良反应发生[36]。故推荐在有经验的肺移植中心、在移植专家的严密监督下进行不同剂型间的转换。
(2)他克莫司颗粒与其他剂型间的转换:①对以他克莫司颗粒维持治疗的稳定移植受者,需换成他克莫司胶囊时,应按照1∶1(mg∶mg)的日总剂量比进行转换。如果不能等剂量转换,应尽可能将他克莫司胶囊日总剂量上调至最接近的量,早晨使用较高剂量,晚上使用较低剂量。因无法排除生物利用度方面的临床相关差异,他克莫司颗粒不应与他克莫司缓释胶囊转换使用。②将他克莫司胶囊换成颗粒时,他克莫司颗粒日总剂量最好等于他克莫司胶囊日总剂量。如果不能等剂量转换,应尽可能用0.2 mg和1 mg规格将他克莫司颗粒的日总剂量下调至最接近的量。他克莫司颗粒日总剂量应分2次等剂量给药。如果不能等剂量给药,早晨使用较高剂量,晚上使用较低剂量。应在转换前和转换后1周内检测他克莫司全血C0。适时调整剂量,以维持相似的全身暴露量。
(3)他克莫司注射剂转为他克莫司胶囊:在受者情况允许时,应尽早从静脉转为口服给药。对于肝移植受者,推荐静脉初始日剂量为0.01~0.05 mg/kg,术后约6 h开始使用;口服胶囊初始日剂量为0.075~0.150 mg/kg,分早、晚2次服用。对于肾移植受者,静脉给药的起始日剂量为0.05~0.10 mg/kg,术后24 h内持续泵注;口服胶囊的初始日剂量应为0.075~0.250 mg/kg,分早、晚2次服用[1]。
(4)他克莫司注射剂转为他克莫司缓释胶囊:成人肝移植受者在胃肠功能恢复时,静脉给予他克莫司可改为口服他克莫司缓释胶囊,1日1次,目标C0为15 ng/ml。转换第1日,使用缓释胶囊替换1/4的静脉剂量;第2日,参照C0水平,用缓释胶囊替换1/2的静脉剂量;当C0水平不稳定时,可暂停转换;最后,口服全剂量他克莫司缓释胶囊后,停止静脉给药,缓释胶囊最佳初始剂量为静脉给药剂量的8倍[37]。
2.7 转换应用他克莫司仿制药的注意事项
他克莫司属于NTI类药物,剂量或血药浓度的较小变化即可引起严重不良反应或治疗失败,因此,NTI类药物的生物等效性标准更为严格,其95%置信区间为90%~111%[38]。有荟萃分析结果显示,他克莫司仿制品未满足欧洲药品管理局(EMA)和加拿大卫生署(HC)的NTI类药物生物等效性标准,与原研制剂存在差距[39]。另外,欧洲多项研究结果证实,移植受者由他克莫司原研制剂转换为仿制品会导致血药浓度波动,增加排斥反应及不良事件发生风险,影响移植物长期存活[40-42]。基于此,改善全球肾脏病预后组织(KDIGO)、美国移植协会(AST)和欧洲器官移植协会(ESOT)均提出,器官移植受者使用免疫抑制剂仿制药必须非常谨慎[43-45]。
2.8 降低他克莫司C0个体内变异度的策略
他克莫司为NTI类药物,应重视其血药浓度监测,他克莫司C0个体内变异度可反映血药浓度波动幅度。他克莫司C0个体内高变异度可显著降低移植物长期存活[46-47]。因此,需采取有效措施降低其变异度,例如,服药时间保持一致,避免应用与他克莫司具有相互作用的药物,及时治疗肠道疾病,提高患者依从性等[48]。此外,转换为他克莫司缓释胶囊治疗也可有效降低C0个体内变异度,改善移植受者长期存活[30,49-50]。
3 药学监测
他克莫司药动学/药效学(pharmacokinetics/pharma-codynamics,PK/PD)个体差异大,在器官移植相关免疫抑制治疗中,普遍推荐实施基于TDM的个体化用药。他克莫司受食物、年龄、疾病、基因多态性和联合用药等多种因素影响,存在较大的受者个体间变异;剂量调整、药品(剂型、品牌、规格和配伍药物等)替换、受者状态(生理、病理等)都可以影响药物的体内暴露,即个体内变异也较大。上述因素可导致药物疗效和安全性发生较大变化,开展给药方案设计、PK/PD监测和专科药师干预,有助于他克莫司个体化的合理应用,提高受者疗效获益[51-52]。
3.1 他克莫司治疗方案设计
3.1.1 给药方案基本因素考虑:(1)剂型品规。①用于器官移植适应证的他克莫司有注射液、口服液、胶囊、片剂、缓释胶囊、缓释片剂和颗粒剂等多种剂型(见表2),应根据受者的治疗需要和药品保障情况选择[1-4]。②剂型品规之间的替代更换,需要了解使用药品的生物利用度、AUC、峰浓度(Cmax)和达峰时间(Tmax),并以测定他克莫司全血药物浓度为基准,进行剂量调整[31,34,53-61]。a.口服给药更换为静脉给药,对于不能口服他克莫司的受者,静脉剂量应为口服日剂量的1/5~1/3,静脉连续输注24 h。b.速释制剂更换为缓释制剂,应基于依从性、体内变异改善调整方案,注意参考本品牌规格缓释制剂的PK参数,适当调整给药剂量、间隔。c.口服速释制剂更换为舌下速释制剂,从口服他克莫司更换为舌下他克莫司制剂时,给药剂量应为口服剂量的50%,该方案涉及超说明书用药,应考虑药事政策。

表2 他克莫司剂型品规
(2)药物相互作用:①某些药物或食物会升高他克莫司的全血C0,增加严重不良反应(如神经毒性、心电图QT间期延长)的发生风险,合用时应适度减少他克莫司剂量,根据C0调整[1-2,53]。a.与CYP3A抑制剂合用(见表3)[62-68]。b.与氢氧化铝、氢氧化镁和甲氧氯普胺合用。c.与葡萄柚或葡萄柚汁合用。②某些药物或食物可能降低他克莫司的全血C0,增加排斥反应的发生风险。a.与CYP3A诱导剂合用时,应根据诱导强度的不同相应增加他克莫司的剂量,并监测其C0(见表3)[1-4,43,57]。b.食物可降低吸收速率和程度,在高脂饮食(3 548.03 kJ,脂肪含量为46%)下上述降低作用最为明显,从而影响他克莫司血药浓度达标,推荐空腹服用他克莫司。③影响PK/PD状态,可能导致合用药物的治疗效果改变。a.可能降低激素类避孕药的清除率,导致其暴露量增加,使用该类避孕药时应谨慎选择。b.由于竞争性蛋白结合可能会影响高蛋白结合率的配伍药物的游离浓度改变,常见如口服抗凝血药、口服抗糖尿病药等。④他克莫司与某些药物合用可能增加风险,须谨慎。a.与其他免疫抑制剂合用,可增加感染发生风险。不推荐在肝脏移植和心脏移植受者中联合应用他克莫司与西罗莫司。在新发肝移植受者的研究中发现,同时使用西罗莫司和他克莫司出现了较高的死亡率、移植失败和肝动脉血栓发生率。研究结果显示,心脏移植受者同时使用西罗莫司(2 mg/d)和他克莫司时,发生肾功能受损、伤口愈合并发症和胰岛素依赖型PTDM的风险增加;尚未见肾移植受者联合应用西罗莫司与他克莫司时的安全性和有效性证据[2]。b.与有肾毒性或神经毒性的药物合用可增加肾毒性或神经毒性,合用时应谨慎,如万古霉素、阿昔洛韦和两性霉素B等。⑤使用他克莫司时应避免或注意的情况。a.免疫抑制剂可影响疫苗接种的应答,他克莫司治疗期间接种疫苗可能导致疫苗效力降低,应避免使用减毒活疫苗。b.酒精可能增加他克莫司缓释胶囊的释放速率,增加严重不良反应(如神经毒性、心电图QT间期延长)的发生风险,用药期间应避免饮用含酒精的饮料。c.他克莫司可能导致高钾血症,与其他可能升高血钾的药物(保钾利尿剂、血管紧张素转换酶抑制剂和血管紧张素Ⅱ受体阻断剂等)合用时需谨慎,治疗期间注意定期监测血钾水平[2]。⑥他克莫司与中药五味子及五酯制剂合用。中药五味子及五酯制剂(五酯胶囊、五酯片、五酯软胶囊和五酯滴丸)对他克莫司的药物暴露有显著影响,器官移植受者术后联合用药可显著提高他克莫司全血浓度[69-73]。a.初步研究结果显示,合用五酯制剂可保护肝功能,降低他克莫司给药剂量。b.针对联合用药的有效性、安全性,有待进一步的多中心真实世界研究和干预性实验研究,使数据转化为证据。

表3 与他克莫司存在药物相互作用的CYP3A抑制剂和诱导剂
(3)生理病理。①儿童尤其是幼儿期受者的剂量调整。a.儿童的PK与成人具有较大差异,建议儿童受者的起始剂量应酌情高于成人,目标浓度参考成人范围[74-76]。b.与成人移植受者相似,较高的C0与肾毒性相关。c.他克莫司对人体外貌的影响小于环孢素,在制定儿童受者药物治疗方案时需适当考虑该因素。②妊娠期可考虑使用最低有效剂量的他克莫司。a.妊娠后体重和体内分布容积增加,他克莫司用量可能有所增加,建议根据血药浓度及时调整剂量。b.妊娠期女性使用他克莫司,可能增加妊娠糖尿病和高血压的风险,建议密切监测[77]。c.他克莫司在乳汁中含量较低,建议根据受者个体监测情况和需要,评估母乳喂养的必要性。③在设计他克莫司用药方案时,应考虑疾病的影响。a.重度肝损伤者,需要考虑减量,及时监测血药浓度,以保证有效、安全的暴露剂量[78]。b.患有半乳糖不耐症、Lapp乳糖酶缺乏症或葡萄糖-半乳糖吸收障碍等罕见遗传疾病的受者,应避免使用含有乳糖成分的颗粒剂。
3.1.2 药物基因多态性:(1)他克莫司在体内主要经CYP3A酶系代谢,初始剂量应参考CYP3A5*3和CYP3A4*22基因型检测结果,但我国人群仅建议参考CYP3A5*3。①CYP3A5。CYP3A5*3(rs776746)位点突变减慢他克莫司的体内代谢,CYP3A5*3突变与他克莫司浓度具有相关性,参考CYP3A5*3基因型可以确定他克莫司初始剂量。CYP3A5*3等位基因频率,非洲人约为3%,亚洲人约为67%,欧洲人约为93%[75,79-84]。②CYP3A4。CYP3A4*22(rs35599367)位点突变降低CYP3A4酶活性,对他克莫司的影响比CYP3A5*3弱,将CYP3A4*22和CYP3A5*3组合纳入模型中,可以更好地预测他克莫司初始剂量。该位点在亚洲人中突变率极低,不推荐我国人群检测该突变以指导他克莫司用药[75,83,85-89]。③基于基因多态性的剂量调整。推荐参考CYP3A5*3和CYP3A4*22基因多态性设计他克莫司初始剂量[75,83,88]。a.快代谢型(CYP3A5*1携带者+CYP3A4*1/*1),他克莫司初始日剂量为0.3~0.4 mg/kg。b.中间代谢型(CYP3A5*3/*3+CYP3A4*1/*1),他克莫司初始日剂量为0.2~0.25 mg/kg。c.慢代谢型(CYP3A5*3/*3+CYP3A4*22携带者),他克莫司初始日剂量为0.14 mg/kg。d.我国人群CYP3A5表达者(CYP3A5*1/*1和CYP3A5*1/*3)的他克莫司起始剂量应比CYP3A5非表达者(CYP3A5*3/*3)高50%。(2)药物效应靶点基因。NFAT调控的靶基因白细胞介素2(IL-2)、γ干扰素(IFN-γ)和粒细胞-巨噬细胞集落刺激因子(GM-CSF)的表达,可以作为他克莫司的PD参考指标,临床中注意患者靶浓度的差异性需求[90-96]。
3.1.3 PK信息:(1)吸收。①口服他克莫司生物利用度低(平均约为20%~25%),经小肠吸收,个体差异显著,首过效应限制了他克莫司生物利用度[1-4,63,97-98]。②缓释制剂存在时辰PK效应;缓释片夜间给药的AUC比晨间给药低15%;缓释胶囊夜间给药的AUC比晨间给药低35%[1-4]。③他克莫司缓释制剂与速释制剂相比,生物等效参数(如Cmax、Tmax和AUC)发生改变。④关注消化系统疾病对药物吸收的影响,脂肪类食物会降低吸收速率和程度。
(2)分布。①他克莫司在人体内分布广泛,稳态分布容积以全血浓度计约为47.6 L[1-4,52]。静脉滴注给药呈双相分布,主要被红细胞摄取,血浆蛋白结合(主要为白蛋白和α1-酸性糖蛋白)率约为99%。②他克莫司主要蓄积于肺、脾、心脏、肾脏和胰腺。③他克莫司可穿过胎盘屏障,一部分会进入母乳,应慎重用药。
(3)消除。①他克莫司主要由肝脏中的CYP3A酶代谢,肠道黏膜内也有少量代谢。代谢物31-O-去甲基-他克莫司与原型药具有相当的药效。②他克莫司平均总体清除率(以全血浓度估算),健康受试者为2.25 L/h,成人肝、肾和心脏移植患者分别为4.1、6.7和3.9 L/h,儿童肝移植患者的总体清除率约为成人肝移植患者的2倍。③他克莫司的半衰期具有较大的个体差异,一般应考虑年龄周期、不同器官移植、肝功能和剂型特点等。④他克莫司几乎完全代谢后,主要由胆汁排至肠道后经粪便排出[53,63,93,99-100]。
3.2 实验室监测分析
3.2.1 血药浓度监测:他克莫司全血浓度是实施个体化给药的主要参考指标,通过测定特定时间点浓度常规判定药物暴露有效性,根据表现出的PK/PD特征,设计或调整他克莫司用药方案。
(1)分析技术。建议优先采用技术先进、方法可靠、试剂有保障的体内药物分析测定方法,多种方法在比对参数评价达标的基础上可以使用,但要建立实验室室内和室间质量控制体系加以保证。①免疫测定法。目前常用的免疫分析法主要有化学发光微粒子免疫分析(chemiluminescent microparticle immunoassay,CMIA)、酶放大免疫分析(enzyme-multiplied immunoassay,EMIT)和电化学发光免疫分析(electroche-miluminescence immunoassay,ECLIA);此外,还有酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)、抗体偶联磁免疫分析法(antibody-conjugated magnetic immunoassay,ACMIA)、克隆酶供体免疫分析(clone denzyme donor im-munoassay,CEDIA)、浊度定量微球系统(turbidimetric quantitativemicrosphere systems,QMS)以及早期的微粒子捕捉酶免疫发光分析(microparticle enzyme immunoassay,MEIA)等[101-111]。多种免疫测定方法被推荐使用,其中CMIA由于与色谱方法之间偏倚小、精密度高而成为主导的免疫方法[75]。②液相色谱-串联质谱法(liquid chromatography-tandem mass spectrometry,LC-MS/MS)。LC-MS/MS是专属性、灵敏度、检测通量和分析深度较高的方法,从技术发展趋势和临床信息需要上推荐液质联用技术为主导监测分析方法。③建议关注不同方法学检测结果的差异性,推荐患者在卫生管理部门认定的医疗机构接受血药浓度监测和评估!
(2)方法结果的换算关系:由于方法中多技术环节的差异,不同检测方法出具的结果要进行标准换算,无论多克隆试剂、单克隆试剂的免疫测定法之间,还是与液相色谱、液质联用测定法之间,检测结果都要根据本医疗机构采用的治疗窗统一标准,不同来源的检测结果要确定换算关系[112-119]。他克莫司不同检测方法之间的比较见表4。
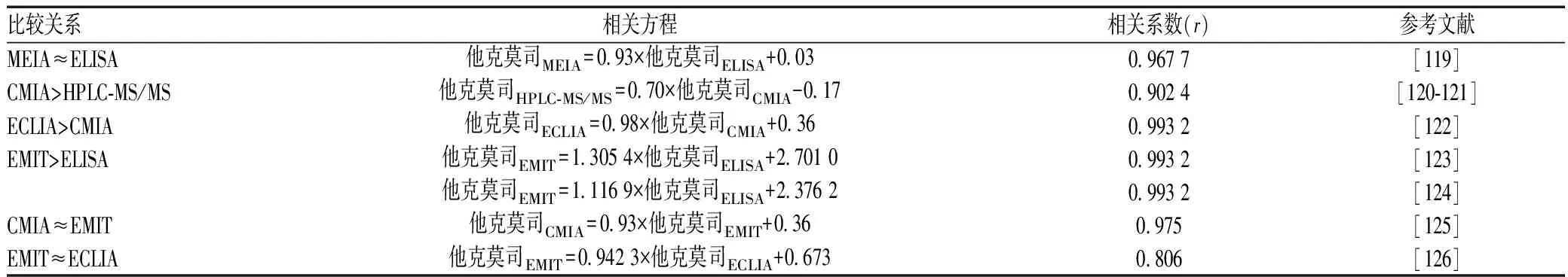
表4 他克莫司不同检测方法之间的比较
(3)监测时机选择及医嘱开具。①监测采样时间点,一般选择C0常规测定,初始监测受者可以考虑峰浓度(C2)、C0同时测定1次,以了解他克莫司处置特征。C0采样时间点,速释制剂和缓释制剂分别为用药后12和24 h[43]。②监测频度,血药浓度监测要根据临床需要设计频度或临场开具医嘱,常规可参考如下。在他克莫司治疗开始2~3 d后或剂量调整后测定;受者术后住院期间,通常每日或每2日测定1次C0;出院后第1个月每周测定1次或2次血药浓度,然后每周测定1次,直至移植后3个月;术后3~6个月,每2周测定1次血药浓度;术后>6个月,每月测定1次血药浓度,病情稳定的低风险受者可每2~3个月测定1次血药浓度;若加用或停用影响他克莫司代谢的药物,则需增加C0的监测频率;推荐至少在术后1个月时和3个月后各测算1次AUC/C0,以评估受者个体差异[120-122]。③不同适应证的监测频度。不同器官移植受者的他克莫司监测频率见表5[10,13,123-125]。④注意事项。腹泻时他克莫司血浓度会有明显变化,影响疗效或引起不良反应,推荐腹泻期间密切监测血药浓度。

表5 不同器官移植受者的他克莫司监测频率
3.2.2 药物基因检测:(1)药物基因多态性检测。①检测技术。推荐使用国家药品监督管理局批准的聚合酶链式反应-序列特异性引物(PCR-SSP)、PCR芯片杂交法和荧光-PCR法;美国食品药品监督管理局批准了基因芯片法,常见的还有聚合酶链式反应-限制性片段长度多态性(PCR-RFLP)、PCR-熔解曲线法或全基因测序方法,检测受者CYP3A5*3位点突变可参考使用[126-132]。②监测管理。a.药物基因唯一性。药物基因是患者合理用药的遗传影响因素,具有天然属性特征,建议针对患者的遗传信息进行规范化管理,对于已经具有相关基因多态性信息的受者,不推荐再次检测相关基因。b.药物基因检测指征。受者无他克莫司相关基因信息;药物基因信息与用药结果不一致,存在疑点;药物基因信息不完整。上述3种情况下,征得受者或受者监护人知情同意,方可进行药物基因检测。
(2)基因多态性对他克莫司血药浓度的影响。①CYP3A5。CYP3A5存在4个等位基因,即CYP3A5*1、CYP3A5*3、CYP3A5*6和CYP3A5*7,其中只有CYP3A5*1与CYP3A5表达相关,另外3个等位基因为非表达体[75,80,84,133-134]。a.CYP3A5表达者(CYP3A5*1/*1和CYP3A5*1/*3)的他克莫司清除率为CYP3A5非表达者(CYP3A5*3/*3)的1.88和1.74倍,他克莫司血药浓度与剂量的比值(C/D)显著低于CYP3A5非表达者。CYP3A5表达者使用他克莫司剂量需要比非表达者约高50%,以达到目标浓度范围。b.快代谢型受者(CYP3A5*1/*1),他克莫司给药剂量可增至起始剂量的1.5~2倍;中间代谢型受者(CYP3A5*1/*3、CYP3A5*1/*6和CYP3A5*1/*7),他克莫司给药剂量可增至推荐起始剂量的1.5~2倍;慢代谢型受者(CYP3A5*3/*3、CYP3A5*6/*6和CYP3A5*7/*7)为非表达者,维持他克莫司推荐起始剂量。c.在肝移植受者中,供体的CYP3A5基因表型差异对他克莫司C/D的影响比受体更明显。携带CYP3A5*1的受体移植了携带CYP3A5*1的肝脏,他克莫司清除率约为非携带者的1.7倍;携带CYP3A5*1的受体移植了不携带CYP3A5*1的肝脏,他克莫司清除率约为非携带者的1.3倍。②CYP3A4。CYP3A4基因的多态性主要包括CYP3A4*1B(rs2740574)、CYP3A4*18B(rs2242480)和CYP3A4*26,可对他克莫司的PK产生影响,有指南推荐结合CYP3A5基因多态性进行剂量调整,但尚未有批准上市的该基因多态性检测方法[75,128,134-141]。③三磷酸腺苷结合盒转运子B亚家族成员1(ATP-binding cassette subfamily B member 1,ABCB1)[142-148]。a.编码外排P糖蛋白的ABCB1在他克莫司的PK中也发挥重要作用。ABCB1基因多态性主要单核苷酸多态性位点为rs1128503(1236C>T,Gly412Gly)、rs2032582(2677G>T/A,Ala893Ser/Thr)和rs1045642(3435C>T,Ile1145Ile)。一般认为,ABCB1基因突变导致P糖蛋白表达和活性降低,导致他克莫司外排减少。b.在肝移植受者中,ABCB1基因多态性主要影响淋巴细胞或外周血单个核细胞他克莫司浓度,且与移植后第7日测定的组织排斥评分(Banff评分)之间具有良好的相关性;供体ABCB1基因多态性显著影响肝脏他克莫司浓度,而对血药浓度影响并不明显。④SLCO1B1/3。SLCO1B1和SLCO1B3基因分别编码有机阴离子转运蛋白(organic anion transporter,OAT)OATP1B1和OATP1B3,其为调控他克莫司经肝脏代谢和胆道排泄的关键转运体[147,149-150]。在肝移植受者中,供体SLCO1B1 388 A>G(rs2306283)杂合突变显著降低第1剂他克莫司的C0,而供体SLCO1B1 521T>C(rs4149056)基因突变增加他克莫司C0。我国人群仅在CYP3A5非表达者中,SLCO1B1 388 A>G(rs2306283)GG基因型他克莫司剂量校正C0显著高于GA和AA基因型。⑤SLC28A3。SLC28A3负责编码转运蛋白CNT3。SLC28A3(rs10868152)TT基因型的肾移植受者,移植后60 d的他克莫司C0与日剂量D的比值(C0/D)较CC和CT基因型受者低,表明TT基因型受者可能需要较高的他克莫司剂量才能获得理想的疗效。我国研究者在肝移植受者中发现,受体为SLC28A3(rs7853758)CC基因型,移植后2~4周他克莫司C0/D较CC和TT基因型受者高[151-152]。
(3)基因对他克莫司不良反应的影响:他克莫司具有肾毒性、PTDM、高血压和神经毒性等严重的不良反应,可能与特定的基因型相关。①肾毒性。我国肝移植受者中,CYP2C8*3携带者术后使用他克莫司发生早期肾小管间质损伤的风险更高;肾移植受者中,FOXP3(rs3761548)A等位基因携带者发生急性肾损伤的风险更高[129,153-154]。②PTDM。a.ABCC8基因编码MRP8,SLC30A8基因编码锌离子转运体ZNT8,上述2个基因突变都可能增加PTDM风险。b.转录因子7类似物2基因(transcription factor 7-like 2,TCF7L2)突变与糖尿病患病风险和肥胖相关。在肾移植中,TCF7L2(rs7903146)TT基因型与PTDM显著相关;在汉族肝移植受者中,供体和受体TCF7L2 rs290487多态性均与PTDM显著相关[155-158]。③高血压。实体器官移植后长期服用他克莫司可能导致高血压发生,ABCB1和CYP3A5基因多态性与高血压有关;在肝移植受者中,受体SLC28A3(rs7853758)基因突变增加高血压风险[152,159]。④神经毒性。他克莫司的神经毒性包括震颤、头痛、失眠和周围神经病变等。造血干细胞移植受者CYP3A5*1等位基因会增加神经毒性的风险;肝移植受者ABCB1 2677G>T/A(rs2032582)突变增加他克莫司诱发神经毒性的风险[160-163]。
3.2.3 基于监测数据的分析:(1)群体模型。评价他克莫司在实体器官移植术后的群体药动学特征可采用一级吸收单室或二室模型[75,102,164-169]。①固定效应中给药剂量、年龄、术后时间、血红蛋白和C反应蛋白显著影响他克莫司的表观清除率(CL/F),血清肌酐和血胆红素显著影响他克莫司群体患者的分布容积(V)和外周室清除率(Q)。②CYP450酶及转运体P糖蛋白基因多态性影响他克莫司代谢,考虑CYP3A5、CYP3A4基因多态性确定他克莫司的起始剂量,有助于提高目标浓度的达标率。③群体药动学模型可将联合用药纳为协变量,评价联合用药对他克莫司代谢的影响。
(2)PK/PD特征。他克莫司在器官移植、免疫性疾病不同患者群体中的PK均呈现明显个体差异[170-171]。①不同患者他克莫司口服生物利用度在5%~93%之间,平均为25%~30%。②他克莫司主要分布于红细胞,血浆中的浓度<1%,而红细胞中药物最大结合容量与血细胞比容相关,药物结合容量和结合常数存在明显的个体间变异,分别为27%和29%。③在以相同体重矫正后的剂量给药时,PK参数Cmax、Tmax、AUC及半衰期均存在显著个体差异。④肝、肾、心和肺移植患者的他克莫司CL/F、表观分布容积(V/F)存在个体差异,其中CL/F受日剂量、血细胞比容、总蛋白及联合用药影响。⑤与肾移植相比,心、肺移植术后,尤其是移植术后早期,他克莫司的PK存在更大变异,其口服生物利用度的周期间变异为55%,明显高于肾移植术后早期(23%~28%),CL/F、V/F及吸收速率常数(ka)的周期间变异可达29.5%、35.1%和98.3%[172]。
(3)药物暴露指标判定。他克莫司的AUC、C0是代表体内暴露水平的PK指标,其与移植排斥、感染等临床治疗结局相关,主要推荐基于C0的目标范围作为常规监测标准[173-174]。①肾移植受者,术后第1个月内他克莫司平均C0>8 ng/ml时,急性排斥反应的发生率降低。C0/D可作为他克莫司代谢速率的指标,他克莫司快速代谢[C/D<1.05 ng/(ml·mg)]与肾移植术后排斥率高、CNI肾毒性相关[175]。②当C0在目标范围的时间>78%时,术后1年的肾移植受者具有较高的无排斥、无感染生存期[176]。③以他克莫司(TAC)及霉酚酸(MPA)的TAC TDM*(MPAAUC+MPAG/10AUC)为评分模型可预测药品不良反应和排斥反应发生,依据PK模型优化剂量可使血药浓度更早达到目标范围[177]。
4 临床药师
国家规章明确要求,医疗机构药师应“参与临床药物治疗,进行个体化药物治疗方案的设计与实施,参与药学查房,为患者提供药学专业技术服务”[178]。临床药师作为专业治疗团队一员,应参与患者的全程治疗药物管理,包括用药评估、药品保障、治疗方案设计与调整、用药教育与指导等,协助医师开展药物个体化治疗。在他克莫司的临床应用方面,药师参与对于解决临床问题具有积极意义[179-180]。
4.1 药学监测评估
4.1.1 药品选择:移植专科药师或岗位责任药师应详尽了解患者的用药史、过敏史和用药依从性情况,建立患者药历,考虑药品保障情况,针对患者治疗需要选择药品、制定他克莫司方案。(1)对于初次使用他克莫司的患者,应考虑患者合并症的用药需要、用药禁忌情况,获取药物基因信息。(2)对于有他克莫司治疗史的患者,应获取、整理既往监测信息,结合当前状态考虑药品、剂型和规格的再选择。(3)选择药品时,应考虑患者的认知度、依从性和经济性,考虑医护操作的可及性和适宜性。
4.1.2 用药教育:用药期间,应充分评估患者用药依从性,为患者制定详细的服药计划[181]。针对医师、护士、药师、检验技术人员和患者(包括患者家属)提供他克莫司合理用药咨询、指导,必要时进行系统用药培训,提高用药和治疗监测的规范性及依从性。
4.1.3 药物重整:针对患者新入院、转换病房、更换主治医师或护士或药师、出院继续医疗或居家用药等情况,药师应收集、整理患者的详细用药清单,评估药物治疗方案、医嘱执行、操作规范及患者依从情况,比较与分析合理性,及时制定出药物重整方案。
4.2 治疗监测实施
(1)制定他克莫司TDM指导书、质量控制标准及风险管控计划书,明确样本检测设备、定量计算模型和临床解读报告。(2)制定与药房、TDM实验室、病区、门诊及相关部门的联络路径,建立健康畅通的业务联系,以及时提供患者监测所需。(3)整理他克莫司治疗监测信息,包括治疗窗、PK/PD、遗传药理和相互作用等,对医师、护士、患者进行普及,提高其治疗认知。(4)及时掌握、监测患者的治疗状态、TDM指征、医嘱执行、样本采集及实验室测定等信息,保证监测效果。(5)针对测定结果中的异常值,要了解医嘱执行、患者用药情况和效果,准确判定给药方案的合理性。(6)针对血药浓度在治疗窗内而药效未达到预期的患者,要分析患者用药及治疗情况,以准确判定患者的个体药物暴露需要。(7)临床药师应根据TDM结果和分析报告,结合患者临床治疗情况,出具TDM报告,为医师提供他克莫司个体化调整依据。(8)临床药师应加强与主治医师、护士、TDM药师或检验师的沟通,及时协调解决监测中遇到的技术问题,提高个体化治疗规范性。(9)针对监测患者,临床药师应开展他克莫司TDM咨询和相关合理用药普及教育,提高患者用药依从性,改善用药获益。(10)患者因出院或转换病区结束监测状态,应进行包括他克莫司在内的药物重整、出院带药教育,发给患者用药指导文字信息,提供必要的咨询联系方式[75,182]。
4.3 监测评价
(1)重视他克莫司治疗监测中的病案分析和特殊案例收集,在个体化治疗实践中发现问题、完善措施、解决问题。(2)总结血药浓度监测、药物基因检测数据及临床治疗指标,探索真实世界中他克莫司个体化治疗的量效规律,积累数据,完善定量模型。(3)分析他克莫司监测中的药品保障、监测流程、部门关系及规章制度的适宜性,做出改进措施和报告,上报医务部门或药事管理与药物治疗学委员会,完善TDM工作[183]。
5 附则
5.1 共识制定利益声明
本共识得到了中国药理学会立项批准并提供专项经费支持;同时,按照学会相关规定,合法接受不限于1家企业的资助,以承担课题组成员参与本共识制定的费用,但资助企业不参与共识证据综合、评价和推荐意见制定的过程。
5.2 共识文件更新周期
本共识全文预计将于2021年发布,共识及共识解读将在相关领域的期刊上发表。本共识计划在2~3年间更新版本。
共识指导组专家(10名)
杜冠华(研究员,中国药理学会)
郑树森(主任医师,浙江大学附属第一医院)
张相林(主任药师,中日友好医院)
石炳毅(主任医师,中国人民解放军总医院第八医学中心)
缪丽燕(主任药师,苏州大学附属第一医院)
张伶俐(主任药师,四川大学华西第二医院)
赵荣生(主任药师,北京大学第三医院)
曹俊岭(主任药师,北京中医药大学东方医院)
陈静瑜(主任医师,无锡市人民医院)
郭代红(主任药师,中国人民解放军总医院第一医学中心)
共识外审专家(26名)
郭瑞臣(主任药师,山东大学齐鲁医院)
刘皋林(主任药师,上海交通大学附属第一人民医院)
史录文(教授,北京大学医学部药学院)
赵志刚(主任药师,首都医科大学附属北京天坛医院)
李朋梅(主任药师,中日友好医院)
肇丽梅(主任药师,中国医科大学附属盛京医院)
王春革(主任药师,天津市眼科医院)
邱 峰(主任药师,重庆医科大学附属第一医院)
姜 玲(主任药师,中国科技大学附属第一医院)
张毕奎(主任药师,中南大学湘雅二医院)
刘茂柏(主任药师,福建医科大学附属协和医院)
张 峻(主任药师,昆明医科大学第一附属医院)
李晓宇(主任药师,复旦大学附属中山医院)
林厚文(主任药师,上海交通大学医学院附属仁济医院)
张晓坚(主任药师,郑州大学第一附属医院)
徐 骁(主任医师,浙江大学附属第一医院)
张水军(主任医师,郑州大学第一附属医院)
陈知水(主任医师,华中科技大学同济医学院附属同济医院)
何晓顺(主任医师,中山大学附属第一医院)
朱志军(主任医师,首都医科大学附属北京友谊医院)
蒋文涛(主任医师,天津市第一中心医院)
吕国悦(主任医师,吉林大学白求恩第一医院)
田 野(主任医师,首都医科大学附属北京友谊医院)
吴建永(主任医师,浙江大学附属第一医院)
林 涛(主任医师,四川大学华西医院)
吴 波(主任医师,无锡市人民医院)
共识制订组秘书(17名)
柳 芳,杜雯雯,张 丹,秦 伟,李 博,李 沭,阎 雨,陈 玮,王晓雪,赵 莉,郭丽娟(中日友好医院)
王一竹(清华大学附属华信医院)
陈 凡,杨云云(中国人民解放军海军军医大学第一附属医院)
闫美玲,张瑞霞(天津市第一中心医院)
景志坚(中国药理学会)
(审议意见稿日期:2021-05-13;审回修订日期:2021-05-28,2021-07-23,2021-09-24)

