基于网络药理学和分子对接技术探讨柴胡-桂枝治疗急性缺血性脑卒中的作用机制Δ
张丽曼
(石家庄市中医院脑病科,河北 石家庄 050051)
急性缺血性脑卒中(acute ischemic stroke,AIS)是由于大脑动脉堵塞或狭窄导致脑部供血不足,局部脑组织缺血缺氧引起软化或坏死,导致神经控制区功能障碍的一种疾病,临床可出现肢体运动障碍、言语障碍、情感障碍和吞咽障碍等一系列功能障碍[1]。AIS具有高发病率、高致残率、高死亡率、高复发率和高经济负担五大特点,是我国成年人致死、致残的主要原因[2-3]。脑卒中急性期的治疗是脑血管疾病治疗的核心,其中以静脉溶栓治疗及血管取栓治疗为最有效的恢复脑再灌注的方法[4]。但由于溶栓时间窗以及溶栓风险等原因,我国大多数脑卒中患者没有机会静脉溶栓[5]。因此,需要研究临床适应性更好、疗效更好的疗法。AIS属于中医“中风”范畴,中医药防治脑卒中历史悠久,一项横断面研究结果表明,83.1%的患者在发病时使用中药治疗,约1/3的患者出院后仍采用中药治疗[6]。柴胡加龙骨牡蛎汤为《伤寒论》中的经典方,国内学者在临床中应用其治疗脑卒中取得了较好的临床疗效[7]。该方具有和解清热、镇惊安神之效,其中柴胡透泄少阳、疏泄气机,桂枝温通血脉、通阳复脉,柴胡散中有升,桂枝升中有降,二者合而为用,共为君药。君药针对主病或主证起主要治疗作用[8]。因此,本研究以柴胡-桂枝作为研究对象,采用网络药理学及分子对接方法挖掘并初步验证柴胡-桂枝治疗急性脑梗死的机制,为进一步深入研究提供参考。
1 资料与方法
1.1 柴胡-桂枝活性成分及作用靶点筛选
通过中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)(https://tcmsp-e.com)检索“柴胡、桂枝”的主要成分,并以类药性(drug-likeness,DL)≥0.18和口服生物利用度(oral bioavailability,OB)≥30%为条件筛选药物的活性成分及其对应的靶点[9]。将靶点信息录入UniProt数据库(https://www.uniprot.org)进行标准化处理,转换成人源性标准基因名。
1.2 AIS疾病基因的获取
以“Acute Ischemic Stroke”为检索词,通过人类孟德尔遗传综合数据库(online mendelian inheritance in man,OMIM)(https://omim.org)和人类基因组注释数据库(GeneCards)(https://www.genecards.org)进行检索,剔除重复基因后得到AIS疾病相关基因。将柴胡-桂枝作用靶点基因与AIS疾病基因取交集,并绘制维恩图。
1.3 “活性成分-疾病靶点”网络构建及可视化分析
利用Excel软件整理活性成分-靶点信息,建立柴胡-桂枝“活性成分-疾病靶点”数据库,借助Cytoscape 3.8.2软件制作“活性成分-疾病靶点”可视化网络。
1.4 蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络构建及可视化分析
将“1.2”中得到的药物疾病共同基因导入STRING数据库(https://www.string-db.org)获取PPI信息,并制作PPI图。导出TSV文件,采用Cytoscape 3.8.2软件中的“Analyze Network”拓扑功能对PPI网络进行分析。
1.5 基因本体(gene ontology, GO)功能富集分析与京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析
采用Metascape数据库(https://metascape.org)对药物疾病共同基因进行GO功能和KEGG通路富集分析,并生成可视化图。其中GO功能富集分析从细胞组分、分子功能及生物学过程3个方面对靶点进行作用机制分析,KEGG通路富集分析是对靶点所参与的信号通路进行分析。
1.6 分子对接技术
通过PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)下载药物活性成分的2D结构,借助ChemBio 3D软件进行能量优化,并转化成“mol2”格式的3D结构文件;通过PDB数据库(https://www.rcsb.org/)下载“pdb”格式的靶蛋白晶体结构文件,然后利用 PyMOL软件进行去水、去磷酸根等处理。借助AutoDock Tools-1.5.6将药物小分子和蛋白大分子统一转换为“pdbqt”格式文件,设置活性口袋并进行对接。得到的“pdbqt”格式对接结果经Open Babel软件转换为“pdb”格式文件,然后利用PyMol软件绘制可视化网络图。
2 结果
2.1 柴胡-桂枝药物活性成分筛选
通过TCMSP数据库检索,以OB≥30%、DL≥0.18为筛选条件,筛选出柴胡-桂枝24个成分,其中柴胡17个,桂枝7个。药物成分作用靶点去重后经UniProt数据库转换成人源标准基因,得到203个基因。
2.2 AIS疾病基因的获取
以“Acute Ischemic Stroke”为检索词,在OMIM数据库检索出相关疾病基因179个,在GeneCards数据库中检索出相关疾病3 049个。去除2个数据库中的重复基因后共得到3 197个疾病基因。与柴胡-桂枝203个靶点基因比对,共得到150个交集基因,见图1。

图1 柴胡-桂枝治疗AIS靶点韦恩图
2.3 构建“活性成分-疾病靶点”网络
将柴胡-桂枝药物活性成分、交集基因录入Cytoscape 3.8.2软件,生成“活性成分-疾病靶点”网络图,见图2。图2中,圆形部分为药物疾病交集基因,三角形部分为柴胡-桂枝作用于AIS的活性成分。共得到19个与治疗AIS有关的活性成分对应150个药物疾病共同靶点基因,其中13个来自柴胡,6个来自桂枝。槲皮素(quercetin)对应113个靶点,山柰酚(kaempferol)对应44个靶点,因此认为槲皮素、山柰酚为柴胡-桂枝治疗AIS的关键成分。

图2 柴胡-桂枝“活性成分-疾病靶点”网络
2.4 PPI网络图及核心靶点分析
将上述150个共同基因导入STRING数据库进分析,共同基因产生2 683条相互作用关系,平均度值(Degree)为35.8。应用STRING平台生成PPI关系网,导出TSV文件采用Cytoscape 3.8.2 进行网络拓扑学分析并生成可视化网络图,选择Degree由大至小排序居前20位的靶点,其中关键靶点有AKT1、IL-6、VEGFA、TNF、TP53和CASP3等,见图3—4。

图3 柴胡-桂枝治疗AIS潜在靶点的PPI网络

图4 柴胡-桂枝治疗AIS的核心基因
2.5 GO功能富集分析
利用Metascape数据库对柴胡-桂枝治疗AIS的150个关键靶点从细胞组分、分子功能和生物学过程3个方面进行GO功能富集分析,选取P值由大至小排序居前20位的靶点。结果显示,柴胡-桂枝有效成分主要通过薄膜筏、囊泡腔、树突、细胞质核周区、膜侧和突触后膜等细胞组分参与对无机物的反应、对药物的反应、活性氧类代谢、对伤害的反应、炎症反应、凋亡信号通路和循环系统过程等生物学过程,发挥蛋白质结合、转录因子结合、蛋白激酶结合和细胞因子受体结合等分子功能,从而起到治疗AIS的作用,见图5。

A.细胞组分;B.分子功能;C.生物学过程
2.6 KEGG通路富集分析
通过Metascape数据库对150个靶点基因进行KEGG通路富集分析,得到186条通路,选取P值由大至小排序居前20位的通路,主要涉及癌症信号通路、AGE-RAGE信号通路、HIF-1信号通路和NF-κB信号通路等通路,见图6。采用Cytoscape 3.8.2软件构建“成分-靶点-通路”,并生成个可视化网络图,见图7。图7中,六边形节点代表药物活性成分,圆形节点代表作用靶点,三角形节点代表信号通路,可以看出,柴胡-桂枝的多个活性成分作用于多个靶点、参与不同的信号通路,体现了多成分、多靶点和多通路的作用特点。

图6 KEGG通路富集气泡图

图7 柴胡-桂枝“成分-靶点-通路”网络
2.7 分子对接技术
通过“活性成分-疾病靶点”网络可知,槲皮素、山柰酚是柴胡-桂枝治疗AIS的关键成分。由PPI网络图可知,AKT1、IL-6、VEGFA、TNF、TP53和CASP3等靶点是柴胡-桂枝治疗AIS的关键靶点。利用Auto Dock软件将槲皮素和山柰酚与相应关键靶点进行对接,通过结合能评估对接结果,见表1。一般认为结合能<-17.79 kJ/mol提示配体与受体有一定的结合活性,<-20.93 kJ/mol提示有较好的结合活性,<-29.30 kJ/mol提示有强烈的结合活性[10]。由表1可见,槲皮素与TNF的结合性最好。以槲皮素为例,借助PyMol软件将结合能(≤-20.93 kJ/mol)的对接结果可视化,见图8。
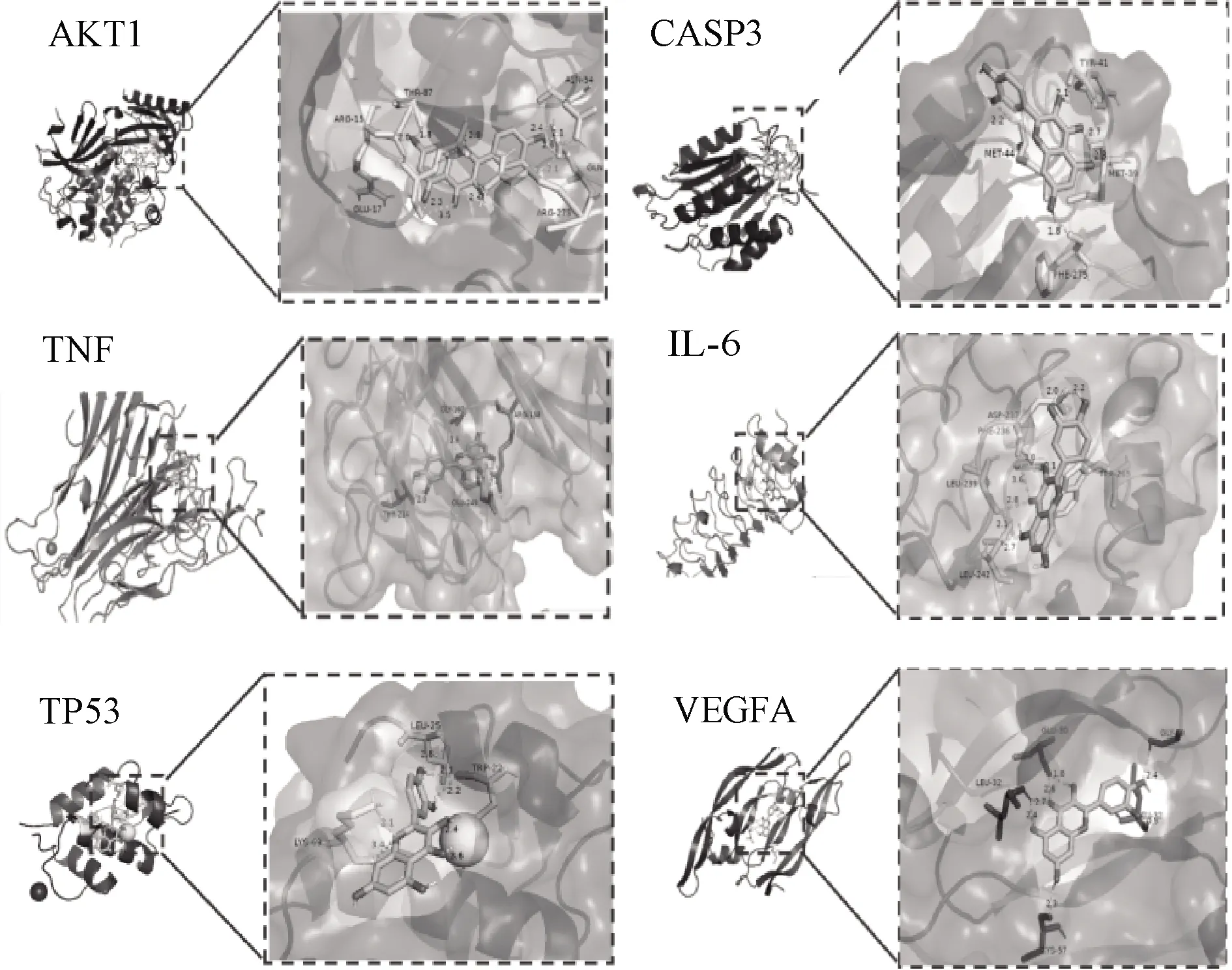
A.AKT1;B.CASP3;C.TNF;D.IL-6;E.TP53;F.VEGFA

表1 分子对接结果
3 讨论
缺血性脑卒中的病因病机较为复杂,涉及神经炎症、能量衰竭、细胞凋亡及自噬等,并且各环节相互影响、重叠发生,更导致了其过程的复杂性[11]。中医学防治脑卒中具有悠久历史,在常规治疗的基础上联合使用中医药治疗能更好地改善患者神经功能缺损情况[3]。其中,柴胡加龙骨牡蛎汤作为《伤寒论》中的经典名方,被广泛用于脑血管疾病的治疗[7,12-13]。本研究采用网络药理学及分子对接技术对该方中君药柴胡-桂枝药对进行分析,对药物的内在机制进行更深的理解[14]。
本研究以柴胡-桂枝为研究对象,初步探讨其对AIS的作用机制。利用TCMSP数据库,以DL≥0.18和OB≥30%作为条件得到柴胡-桂枝有效成分24个。通过Cytoscape生成的“活性成分-疾病靶点”网络,筛选出治疗AIS的19个活性成分,按照其所对应的疾病靶点统计,其中槲皮素、山柰酚、谷甾醇、β-谷甾醇、异鼠李素和豆甾醇等成分对应靶点较多,考虑为柴胡-桂枝治疗AIS的关键成分。槲皮素是一种多羟基黄酮类化合物,具有抗氧化、抗炎、抗病毒、抗菌、抗肿瘤和心血管保护等多种生物活性[15]。脑组织耗能较高,一旦发生脑缺血,活性氧(ROS)产生过多,引起神经炎症反应,可对脑细胞产生不可逆损伤[16]。槲皮素通过直接清除ROS、鳌合金属离子以及抑制低密度脂蛋白氧化损伤等过程,发挥抗氧化的生物学功能,从而起到保护神经的作用[17-18]。Han等[19]通过对PD小鼠模型的研究,发现槲皮素能促进线粒体自噬,抑制mtROS介导的小胶质细胞NLRP3炎症小体激活,从而阻止神经细胞损伤。山柰酚是一种强效的天然抗氧化剂,具有抗氧化、抗肿瘤和抗炎等多种作用[20]。Liu等[21]的研究结果发现,山柰酚可以通过下调ROS依赖的MAPKs-NF-κB号通路,减轻氧化应激和炎症反应。Li等[22]的研究结果也发现,山柰酚能减弱ox-LDL诱导的HUVECs炎症反应、氧化应激和细胞凋亡。Han等[23]认为,山柰酚能减轻脂质沉积和过氧化以及由此导致死亡也有研究结果证实,山柰酚能通过提高小鼠脑海马超氧化物歧化酶和谷胱甘肽水平,改善其空间记忆障碍[24]。谷甾醇、β-谷甾醇和豆甾醇等属于植物甾醇类成分,具有较好的血-脑脊液屏障通透性,能透过血-脑脊液屏障发挥抗氧化的生物活性,抑制氧化应激诱导的神经细胞死亡,起到改善神经功能的作用[25]。Jiang等[26]的研究结果表明,β-谷甾醇能作用于miRNA靶点,具有血管内皮保护和抗动脉粥样硬化的作用,能降低AIS的高危因素以及改善预后。异鼠李素是一种黄酮类物质,具有保护血管内皮细胞、抗肿瘤、抗炎和抗病毒等作用[27]。Wu等[28]发现异鼠李素能通过Akt/SIRT1/Nrf2/HO-1信号通路对缺血再灌注脑损伤起到保护作用。Rodríguez等[29]发现,异鼠李素能在不影响ROS的情况下具有抗血小板、抗血栓的作用。
本研究中,通过STRING数据库及Cytoscape软件分析柴胡-桂枝抗脑缺血的作用靶点包括AKT1、IL-6、VEGFA、TNF、TP53和CASP3等。AKT1为PI3K/AKT信号通路中的核心因子,参与代谢、增殖、细胞存活和血管生成等多种生物学过程[30]。AKT可通过促进NF-κB蛋白的表达,扰乱下丘脑-垂体-肾上腺轴功能,使炎症反应失调[31]。IL-6和TNF是重要的炎症因子,参与机体免疫应答和炎症反应,与脑血管疾病的炎症过程密切相关[32]。VEGFA为血管内皮生长因子,是一种缺氧诱导信号糖蛋白,具有维护内皮细胞完整、促进血管再生的作用,还可以通过坏死物的清除、氧和代谢物的交换,促进神经功能的恢复[33]。但是,VEGFA参与了缺血早期的炎症和脑水肿过程。Stavchanskiǐ等[34]通过研究发现,缺血会增加大鼠脑中VEGFA mRNA水平,并且采用多肽semax抑制缺血早期VEGFA基因表达的激活,可以起到神经保护作用。TP53为细胞增殖调节基因,在细胞代谢、增殖、生长以及凋亡等方面发挥重要作用[35]。CASP3是细胞凋亡基因,参与缺血再灌注损伤过程,能加重脑梗死程度。庞艳利等[36]通过降低CASP3的表达,抑制细胞凋亡及缩小缺血再灌注损伤造成的脑梗死体积,起到了保护脑组织的作用。AKT1、IL-6、VEGFA、TNF、TP53和CASP3等6个核心靶点与炎症、血管、细胞凋亡和神经调节等相关,也说明柴胡-桂枝的抗AIS机制与上述生物功能有关。
GO功能和KEGG通路富集分析结果显示,柴胡-桂枝有效成分可能过参与对无机物的反应、对药物的反应、活性氧类代谢、对伤害的反应、炎症反应、凋亡信号通路和循环系统过程等生物学过程,在薄膜筏、囊泡腔、树突、细胞质核周区、膜侧和突触后膜等部位,发生蛋白质结合、转录因子结合、蛋白激酶结合和细胞因子受体结合等分子反应,进而调控癌症通路、AGE-RAGE通路、丙型肝炎通路、HIF-1 信号通路和铂耐药等通路,发挥抗脑缺血损伤的作用。晚期糖基化终末产物(AGE)一方面可以增加血管通透性,导致血管舒张功能障碍;另一方面可以增加血小板聚集,导致动脉粥样硬化[37-38]。晚期糖基化终末产物受体(RAGE)是晚期糖基化终产物受体,可促进ROS、促炎细胞因子产生,激活NF-κB,以及促进细胞黏附分子的产生[39-40]。田玉双等[41]通过对人脑梗死组织标本进行研究,发现患侧脑组织中的RAGE水平明显升高,提示RAGE与细胞的凋亡有关。Sapkota等[42]的研究结果表明,RAGE参与了脑缺血发生后溶血磷脂酸受体5介导的脑损伤。HIF-1为缺氧诱导因子,参与了生物体的氧气供应、细胞代谢等病理过程[43];其具有介导糖酵解相关酶的产生、介导促红细胞生成素基因表达、提高血液载氧能力和介导线粒体自噬途径促进细胞存活的作用,在缺氧性损伤中发挥重要作用[44-45]。同时,AKT1、IL-6、VEGFA、TNF、TP53和CASP3等关键靶点,大部分也显著富集在上述信号通路上,表明柴胡-桂枝具有多靶点、多通路的协调治疗作用。
为了验证结果的可靠性,本研究对筛选出的2个对应疾病靶点基因最多的成分(槲皮素、山柰酚)与其对应的关键靶点进行分子对接。结果发现,上述2个核心成分与对应的关键靶点均具有较好的结合活性(结合能<-20.93 kJ/mol),其中槲皮素与TNF,山柰酚与TNF、CASP3均具有较强的结合活性(结合能均<-29.30 kJ/mol),进一步验证了预测结果的可靠性。
综上所述,本研究采用网络药理学方法对柴桂-桂枝抗AIS的活性成分、关键靶点及作用通路进行预测,并采用分子对接的方法进行验证。结果显示,柴胡-桂枝可能通过槲皮素、山柰酚等主要活性成分,作用于AKT1、IL-6、VEGFA、TNF、TP53和CASP3等关键靶点,参与氧化应激、炎症反应、细胞凋亡和循环等生物学过程,调控癌症通路、AGE-RAGE信号通路和HIF-1信号通路,发挥治疗AIS的作用,具有多成分、多靶点和多通路的特点。本研究也为后续的实验提供了依据,可作为下一步实验的前期基础。

