幽门螺杆菌不同菌型感染对慢性非萎缩性胃炎血清PG、G-17及IL-10表达的影响
黄更新,陈玲红,连丽凤,黄永德,胡团敏
解放军第九一〇医院消化内科,福建泉州 362000
幽门螺杆菌(Hp)是一种革兰阴性细菌,有极强的易感性,Hp感染率全球范围内有所区别,发达国家人群感染率为40%;发展中国家感染率相对较高,中国Hp感染率为40%~60%[1]。根据Hp基因抗体的不同主要分为Ⅰ型和Ⅱ型两种类型,Ⅰ型Hp产生细胞毒素,毒力较强,致病性强;Ⅱ型Hp不产生细胞毒素,毒力较弱,致病性弱。不同菌型Hp感染与慢性非萎缩性胃炎发生发展过程的相关性差异是值得探讨的课题[2-5]。由于Hp感染可显著影响患者血清胃蛋白酶原(PG)的表达,诱发胃蛋白酶原I与胃蛋白酶原Ⅱ比值(PGⅠ/PGⅡ)降低,后者是胃癌的高危信号,因此了解不同菌型Hp感染慢性非萎缩性胃炎患者血清相关因子的表达,有助于为干预慢性非萎缩性胃炎向胃癌发展的序变过程提供监测指标。该研究随机选取2017年1月—2018年1月该院收治的60例患者为研究对象,旨在探讨不同菌型Hp感染慢性非萎缩性胃炎患者血清中胃蛋白酶原I与胃蛋白酶原Ⅱ比值(PGR)、胃泌素17(G-17)、白介素10(IL-10)的表达及其临床意义。现报道如下。
1 资料与方法
1.1 一般资料
随机选取因胃胀、胃痛、恶心、嗳气等上消化道不适症状到该院就诊患者60例,所有患者均经13碳呼气试验以及胃镜和病理组织学检查,明确诊断为Hp感染慢性非萎缩性胃炎,排除并发上消化道症状的其他疾病,其中男39例,女21例;平均年龄(39.67±4.81)岁;发病时间10~32个月,平均发病时间(16.20±7.11)个月。所有患者均在1年内未接受抗Hp治疗,未服用糖皮质激素类或非甾体抗炎药物,既往无心、肝、肾等脏器疾病,均自愿参加该研究。按照H p基因抗体检测结果将患者分成两组,Ⅰ型H p感染组45例,Ⅱ型H p感染组15例,两组年龄、病史等差异无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 Hp基因抗体检测 所有患者采集静脉血4 mL,用免疫印迹法测定血清中Hp细胞毒素相关基因(CagA)、空泡毒素相关(VacA)、尿素酶B(UreB)、尿素酶A(UreA)抗体。试剂盒由深圳市伯莱特生物科技术有限公司生产,操作及结果判定按说明书进行。根据Hp分型标准,对VacA和CagA两者均阳性或者其中一项阳性者判定为Ⅰ型Hp感染;否则为Ⅱ型Hp感染。
1.2.2 血清PGI/PGⅡ比值(PGR)测定 采用微孔双抗体夹心法检测血清PGI和PGⅡ的含量,并测算出PGR。试剂盒由芬兰Biohit公司生产,操作及结果判定按说明书进行。
1.2.3 血清G-17、IL-10检测 采用酶联免疫吸附法检测血清G-17、IL-10的含量。试剂盒北京百奥莱博科技有限公司生产,操作及结果判定按说明书进行。
1.3 统计方法
采用SPSS 19.0统计学软件对数据进行分析,计量资料采用(±s)表示,进行t检验,P<0.05为差异有统计学意义。
2 结果
60例Hp感染慢性非萎缩性胃炎患者中,Hp基因抗体阳性表达分别为CagA 42例、VacA 36例、UreB 22例、UreA 27例,按照Hp分型标准判定为Ⅰ型Hp感染者45例(感染率75%),Ⅱ型Hp感染者15例(感染率25%),Hp感染慢性非萎缩性胃炎中Ⅰ型Hp感染率高于Ⅱ型Hp感染率。慢性非萎缩性胃炎以Ⅰ型Hp感染为主。
Ⅰ型Hp感染组中PGR比值(13.97±4.38)、IL-10指标(35.21±4.48)pg/mL均低于Ⅱ型Hp感染组,两组比较差异有统计学意义(t=2.984、3.156,P<0.05)。两组G-17比较差异无统计学意义(P>0.05),见表1。
表1 两组血清PGR、G-17、IL-10水平比较(±s)
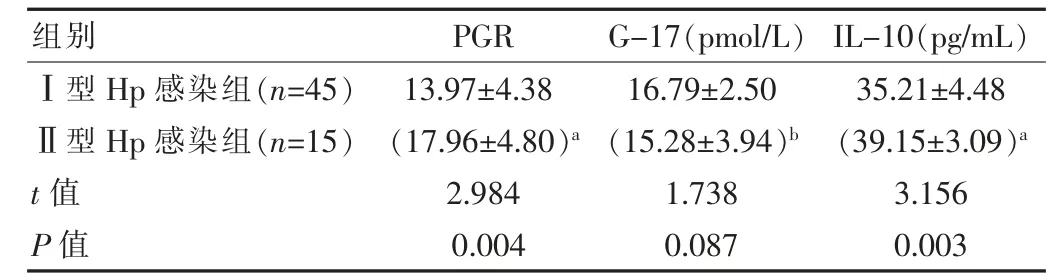
表1 两组血清PGR、G-17、IL-10水平比较(±s)
注:与Ⅰ型HP感染组比较,a P<0.05,b P>0.05
?
3 讨论
Hp感染与慢性非萎缩性胃炎、胃癌前病变以及胃癌的相关性研究颇多,目前一致认为在慢性非萎缩性胃炎演变至胃癌的过程中,胃黏膜经历了Hp感染、慢性非萎缩性炎症、萎缩性炎症、肠上皮化生、不典型增生、直至胃癌的不同阶段。由此可见,慢性非萎缩性胃炎是胃癌发生的始发站,Hp感染是慢性非萎缩性胃炎发病的重要致病因素,目前研究已表明Ⅰ型Hp更具有毒力、致病性更强,因此不同菌型Hp感染慢性非萎缩性胃炎患者血清相关因子表达水平是否存在差异以及与胃黏膜癌前病变的相关性仍然是临床探讨的热点。不同菌型Hp感染及其血清PG、G-17、IL-10表达与慢性非萎缩性胃炎发生发展的相关性研究目前鲜少报道。
PG属于胃蛋白酶的前体,在胃酸的作用下形成胃蛋白酶,发挥水解蛋白质的生物学功能。PG被认为是体现胃黏膜功能的最重要血清学指标之一[6-7];Hp感染后出现血清PG水平升高,可能是通过增加主细胞内磷酸肌醇和cAMP浓度、引起胃黏膜多形核粒细胞和单核细胞浸润,使主细胞分泌PG增加,其中PGⅡ的水平升高更明显,故可表现为PGⅠ/PGⅡ比值下降[8-11]。而PGⅠ/PGⅡ比值的持续降低则是胃癌发生的高风险因素检测指标之一。G-17是胃泌素主要的存在形式[12],有研究证实Hp带菌者存在高胃泌素血症,根除Hp后可使高胃泌素血症明显下降;然而血清G-17表达的持续低下,应注意胃窦黏膜萎缩,因此血清G-17亦是胃癌发生的高风险因素检测指标之一。IL-10是人体重要的免疫调节因子,已有研究表明IL-10在Hp相关性胃炎中充当炎症抑制因子,IL-10可抑制Hp感染过程中促炎因子的合成及其活性,与抗炎介质产生协同作用,发挥抗炎效应,因此IL-10可作为活动期胃炎的炎症程度及抗Hp治疗效果的评价指标之一[13]。由此可见PG、G-17、IL-10在Hp感染慢性非萎缩性胃炎的发病过程中扮演着重要的角色。
该研究结果提示,①Hp感染慢性非萎缩性胃炎以Ⅰ型Hp感染为主,Ⅰ型Hp是Hp感染相关性胃炎的优势菌种,在Hp感染的分型分布中占有绝对优势。Ⅰ型Hp具有更强的毒力,对肠型胃癌的发生有更强的诱导作用,加速了非萎缩性胃炎向萎缩性胃炎、肠上皮化生、不典型增生直至胃癌的转化,因此对Ⅰ型Hp感染慢性非萎缩性胃炎患者进行Hp根除治疗具有重要意义[14-15]。②Ⅰ型Hp感染慢性非萎缩性胃炎PGI/PGⅡ比值低于Ⅱ型Hp感染者,其结果表明Ⅰ型Hp感染慢性非萎缩性胃炎更具有发生肠型胃癌的风险,因此对于Ⅰ型Hp感染慢性非萎缩性胃炎患者的药物治疗要求更规范并且要有定期的追踪。③不同菌型Hp感染慢性非萎缩性胃炎的血清G-17表达水平相当,由此表明无论是Ⅰ型Hp感染或Ⅱ型Hp感染均可影响胃窦G细胞的分泌功能,Hp感染慢性非萎缩性胃炎出现血清G-17表达水平的持续下降,均应重视胃窦萎缩性炎症的可能[16]。④Ⅰ型Hp感染慢性非萎缩性胃炎患者IL-10指标(35.21±4.48)pg/mL均低于Ⅱ型Hp感染组,这与黄懋敏等[17]学者在相关研究中得出,Ⅰ型Hp感染慢性非萎缩性胃炎患者IL-10为(33.48±5.10)pg/mL低于Ⅱ型Hp感染组的结论相近,表明Ⅰ型Hp感染慢性非萎缩性胃炎在胃黏膜炎症反应过程中抗炎能力低于Ⅱ型Hp感染者,因而胃黏膜炎症的严重程度以及向肠型胃癌演变的可能性均大于Ⅱ型Hp感染者。
综上所述,不同菌型Hp感染对慢性非萎缩性胃炎血清相关因子表达的影响,表现为Ⅰ型Hp感染组PGR及IL-10表达水平均明显低于Ⅱ型Hp感染组,而胃泌素表达水平两者大致相当。因此Hp感染慢性非萎缩性胃炎的Hp分型判定及血清相关因子的检测有助于临床医师对慢性非萎缩性胃炎发生发展及其预后的判断。

