发酵乳杆菌B44 益生性能的体外评价
韩 瑨 吴燕婷 万嗣宝 吴正钧
(1.光明乳业股份有限公司乳业研究院, 上海 200436;2.上海大学生命科学学院, 上海 200444)
龋病是一种多因素复合作用导致的慢性感染性牙科疾病, 其表型特征为无机质矿化.龋齿成因与口腔细菌的不平衡发展关联密切, 而变形链球菌(Streptococcus mutans)是目前被公认的主要致龋菌之一, 其能在牙齿表面形成牙菌斑生物膜, 为致病菌的聚集和生长提供微生态环境, 增强致病菌本身的致病力[1].在口腔中, 生物膜的形成是具有平衡代谢活动的永久过程, 因此减少甚至抑制生物膜的产生是防治龋齿的重要手段.
目前, 治疗龋病的主要方法是抗生素治疗法和传统药物[2-3].长期使用抗生素不但会破坏正常口腔微生物菌群, 引起口腔微生态失衡, 而且会增强口腔致病菌的耐药性, 导致疗效降低甚至产生潜在的致病风险.传统药物如黄连等由于气味特殊而难被病患接受.因此, 研究人员开始将目光转向益生菌, 关注益生菌对龋病的干预效果.
大量研究表明, 益生菌可以缓解多种胃肠道疾病, 防治上呼吸道感染等[4], 然而对口腔健康的促进作用却是一个相对生疏的研究领域.利用无致病性的细菌(益生菌)替代口腔中的致病微生物, 从而调整口腔菌群的生态平衡, 达到防龋治龋的目的便是口腔益生菌疗法的核心目标.S¨oderling 等[5]发现4 种益生菌乳杆菌菌株(Lactobacillus rhamnosusGG、Lactobacillus229v、Lactobacillus reuteriSD2112、PTA5289)均能抑制玻璃表面上变形链球菌生物膜的形成.Megha 等[6]指出嗜酸乳杆菌La-1 和La-2 可以显著降低唾液中变形链球菌水平和斑块生物膜量.通过筛选获得具有特定生理功能(如抑制变形链球菌)的益生菌可在龋齿人群中发挥其特异性干扰口腔微生态的潜力, 因此, 益生菌可能是继抗生素、传统药物之后的第三类防龋治龋手段.
发酵乳杆菌是食品中常见的乳酸菌之一, 其安全性相对较高.本实验所用供试菌株发酵乳杆菌(Lactobacillus fermentum)B44 分离自保加利亚家庭手工制作酸奶, 通过体外实验研究了该菌株对变形链球菌生物膜的抑制作用, 并分析了其作为口腔益生菌防治龋病的应用潜力.
1 材料与方法
1.1 材料
1.1.1 材料与试剂
变形链球菌(S.mutansCGMCC1.2499), 中国普通微生物保藏中心.
发酵乳杆菌B44, 乳业生物技术国家重点实验室.
MRS(de Man-Rogosa-Sharpe) 培养基: 酪蛋白胨(10 g/L), 牛肉提取物(8 g/L), 酵母抽提物(4 g/L), 葡萄糖(20 g/L), 磷酸氢二钾(2 g/L), 柠檬酸氢二铵(2 g/L), 醋酸钠(5 g/L),MgSO4·7H2O(0.2 g/L), MnSO4·4H2O(0.04 g/L).调节pH=6.2∼6.6.
BHI 培养基、M17 培养基, 英国OXOID 公司.
TPY 培养基, 青岛海博生物技术有限公司.
结晶紫染料、99%乙醇、TYC 培养基(酪朊水解物、L-胱氨酸: 上海阿拉丁生化科技股份有限公司;Na2SO4、Na2HPO4·12H2O、NaCl、NaHCO3、蔗糖、酵母提取物、乙酸钠).
1.1.2 实验仪器
超净工作台(TH-CB-402), 英国Labconco 公司;高压蒸汽灭菌锅(HVE-50), 日本Hirayama 公司;厌氧培养箱(Bug Box DUAL), 英国Jouan S.A公司;酶标仪(Spectra M5 型), 美国Molecular Devices 公司;紫外可见分光光度计(SPECORD), 德国耶拿公司;微生物全自动生长曲线分析仪(Bioscreen C), 上海谓载商贸发展有限公司;电子天平(XW-80A), 美国奥立龙公司.
1.2 实验方法
1.2.1 菌悬液的制备
将新鲜活化的B44 和S.mutans分别接种于MRS 和脑心浸液(brain heart infusion,BHI)液体培养基中, 37◦C 厌氧培养24 h, 离心(4◦C, 10 000 g, 10 min)取菌体;用pH 值为6.8 的无菌磷酸盐缓冲液(phosphate buffered, saline, PBS)洗涤菌体3 次, 重悬于少量PBS 中,分别调整菌悬液至光密度(optical density, OD)OD600=0.1±0.02, 0.6±0.02 备用.
1.2.2 最适生长培养基的筛选
将新鲜平板上的B44 挑于MRS 液体培养基中制成菌悬液,并调节活菌数为106CFU/mL,取50µL 菌悬液于100 孔板,分别加入200µL 的MRS、M17、TPY、TYC 液体培养基,并置于37◦C 静置培养24 h, 用微生物全自动生长曲线分析仪每隔1 h 测一次OD600值, 每组测试3个平行组, 实验重复2 次.以培养时间为横坐标, OD600为纵坐标, 绘制生长曲线.
1.2.3 最适生长温度的选择
将B44 菌悬液(初始OD600=0.1±0.02)分别置于37、42、45◦C 中水浴培养, 每隔1 h 测定600 nm 处的吸光值.每个温度设置3 个平行组, 实验重复2 次.
1.2.4L.fermentumB44 对口腔中溶菌酶的耐受性
将10 µL B44 菌悬液(初始OD600为0.1±0.02)与100 µL 不同浓度梯度的溶菌酶溶液(0、0.2、0.4、0.6、0.8、1.0 mg/mL)混合均匀, 并分别处理1、2、3 h, 之后取20 µL 处理后的菌悬液与180 µL 空白MRS 混合均匀, 加入100 孔板, 37◦C静置培养24 h, 用全自动微生物生长曲线分析仪每隔1 h 测定OD600的值, 共测24 h.实验重复2 次实验, 每组设置2 个平行组.
1.2.5L.fermentumB44 的疏水性
菌体表面的疏水性能可通过菌株对碳氢化合物的亲和力来反映, 通常采取微生物粘着碳氢化合物法测定菌株细胞表面疏水性[7].实验步骤如下: 取3 mL B44 菌悬液(初始OD600=0.6±0.02)与200 µL十六烷和1 mL 二甲苯混合(PBS 为空白对照), 充分振荡1 min 后静置15 min, 分层后取水相, 以PBS 为空白对照测定OD600, 记为A1.上述实验独立进行5次, 每组设置5 个平行, 分别记录吸光值再将吸光值代入下式计算表面疏水率Sw,
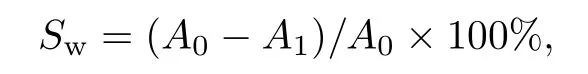
式中:A0为B44 菌悬液初始吸光值;A1为静置分层后水相部分的吸光值.
1.2.6L.fermentumB44 的表面电荷量
选择乙酸乙酯作为路易斯碱, 三氯甲烷作为路易斯酸[8], 参照1.2.7 节的方法测试菌株B44 的表面电荷量.
1.2.7L.fermentumB44 的自动聚集能力
在24 孔板中添加1 mL B44 菌悬液(初始OD600= 0.6±0.02), 于37◦C 厌氧培养, 每隔1 h 测定上清在600 nm 处的吸光值, 共测3 h, 每组设置3 个平行实验, 再将吸光值代入下式计算自聚集率J0,

式中:A0为B44 菌悬液初始吸光值;At为静置培养th 后B44 菌悬液上清液的吸光值.
1.2.8L.fermentumB44 和变形链球菌的共聚集率测定
将两种菌悬液(初始OD600=0.6±0.02)等比混合, 分别取1 mL 于24 孔板中, 37◦C 厌氧培养, 具体测定方法参照1.2.7 节.将吸光值代入下式计算共聚集率J:

式中:Ax为S.mutans菌悬液初始吸光值;Ay为B44菌悬液初始吸光值;At(x+y)为静置培养th 后混合菌悬液上清液的吸光值.
1.2.9L.fermentumB44 对S.mutans生物膜形成量的影响
将Ciandrini 等[9]提出的生物膜量化方案稍作修改, 得到图1 所示的生物膜检测方法.收集健康志愿者的唾液, 离心(4◦C、15 000 g、15 min)取上清, 以0.22 µm 无菌水相滤膜进行过滤除菌.将磁力搅拌子(5 mm×10 mm)沸水浴灭菌后放入上述唾液中温和振荡孵育4 h, 取出用pH=7 PBS 淋洗搅拌子, 备用.调整S.mutans和B44 活菌数为106CFU/mL, 分别取200 µL 于24 孔培养板, 同时加入1.6 mL 液体BHI 培养基, 最后加入上述搅拌子进行共培养,以空白MRS 液体培养基作为阴性对照, 置于37◦C 厌氧培养24 h.取出搅拌子用pH=7 PBS淋洗数次, 接着浸入质量分数为0.1%的结晶紫(crystal, violet, CV)染料中孵育15 min.接着取出搅拌子以PBS 淋洗除去未结合的CV, 自然干燥后, 用无水乙醇将结合于搅拌子表面上生物膜的CV 染料溶解下来, 取上述无水乙醇200 µL 转移至96 孔板内, 测定OD570(CV 浓度所对应的OD570与生物膜形成量呈线性关系).每组设置3 个平行组, 实验3 次重复.菌株对S.mutans生物膜形成量的生物膜抑制率(biofilm inhibition, BI)BI= (A1−A2)/A1×100%, 其中A1为对照组生物膜的形成量,A2为实验组生物膜的形成量.
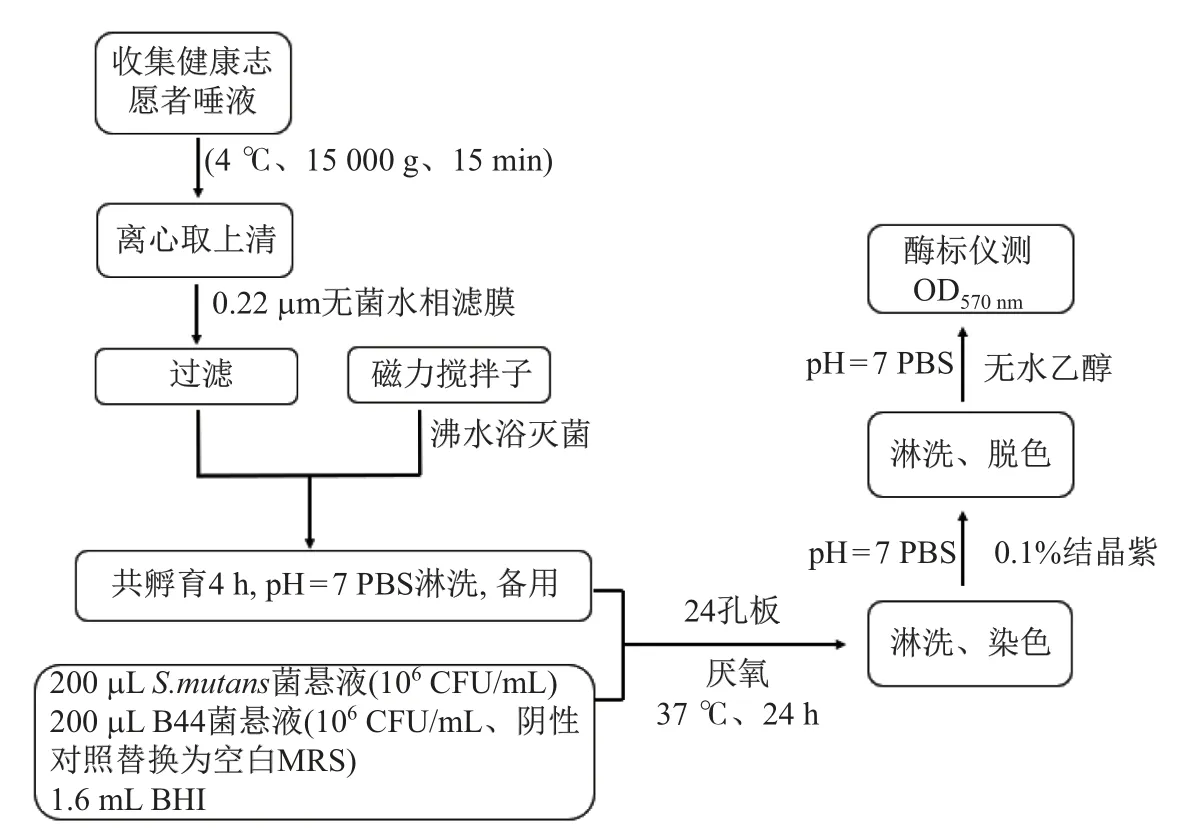
图1 生物膜检测方法Fig.1 Biofilm detection method
2 结果与分析
2.1 L.fermentum B44 最适生长环境
通过浊度测定法对接种于不同培养基中的B44 的生长情况进行对较, 绘制不同营养环境下的生长曲线(见图2), 筛选出适合B44 生长的优选培养基.接种于TYC、M17、BHI(brainheart infusion)和TPY 4 种培养基的B44, 其OD600基本不变或略微增加, 说明B44 无法正常代谢上述培养基中的营养物质来增殖, 因而生长缓慢甚至停滞.但在MRS 培养基中, B44 在接种后4 h 即可进入生长对数期, 并于12 h 后进入稳定期.经测定, 发酵终点处(24 h)活菌总数达108CFU /mL 以上, 显著高于其他培养基.上述现象表明, MRS 培养基中可能含有B44迅速代谢增殖所必需的特定组分, 因此是培养B44 的最适培养基.从最适培养基而言, B44 与大部分乳杆菌类似, 如干酪乳杆菌[10]、植物乳杆菌[11]等菌株的优选培养介质均与MRS 培养基有关.然而, 从对培养基的苛刻度而言, B44 又不同于常规乳杆菌, 前者只在MRS 中有增殖效果, 后者除了最适培养基外, 往往还有一种或多种其他备选的发酵介质, 如植物乳杆菌可通过TPY 等多种介质达到增殖目的.

图2 B44 在不同培养条件下的生长曲线Fig.2 Growth curve of B44 under different culture condition
将B44 菌悬液置于不同温度培养, 每隔1 h 测定OD600, 结果如图3 所示.随着培养时间的延长, 各温度下培养的菌株均有不同程度的增长, 当培养至3 h 时, 42◦C 和45◦C 样品的OD600均达到了目标值0.6.进一步分析后发现, 42◦C 样品组所有时间点的样品OD600始终高于其他组, 因此, 42◦C 是发酵乳杆菌B44 的优选生长温度.微生物的增殖效果与其菌体内部的代谢水平有关, 当B44 的环境温度高于或低于最适温度(42◦C)时, 菌体细胞内与代谢相关酶会发生部分失活, 从而无法为菌体提供充足的增殖“原料”.到目前为止, 大部分已披露的发酵乳杆菌的最适生长温度主要集中于30∼37◦C[12-13], 但菌株间存在一定个体差异, 例如洪梅等[14]就从中国青贮窖中分离出一株在42◦C 培养条件下生长最为旺盛的发酵乳酸菌BLF 01,该菌株的发酵特点与B44 极为相似.

图3 B44 在不同培养温度下的生长情况Fig.3 Growth of B44 at different culture temperatures
2.2 对口腔溶菌酶的耐受性分析
口腔是人体抵抗外源性微生物的第一道屏障, 而口腔溶菌酶是该屏障的重要成分之一,这是一类能够分解细胞壁而杀死多种细菌的蛋白质, 口服益生菌只有对溶菌酶具有一定耐受性才能以活菌形态定植于口腔中或进入胃肠道, 进而发挥益生作用.B44 对不同浓度溶菌酶的耐受性如图4 所示.由图4 可以看出, 低质量浓度(0.2∼0.4 mg/mL)溶菌酶短时间(1∼2 h)处理对菌株生长基本没有影响, 而高质量浓度(0.6∼1.0 mg/mL)溶菌酶短时间(1∼2 h)处理或不同浓度(0.2∼1.0 mg/mL)溶菌酶长时间(3 h)处理均会不同程度地延长B44 进入生长指数期的时间, 但各测试组最终OD600保持一致, 说明菌株B44 至少可耐受1 mg/mL的溶菌酶.健康人群口腔内的溶菌酶质量浓度为1∼57 µg/mL[15], 远低于B44 的耐受值, 由此推测B44 在口腔中存活性能较强.除了发酵乳杆菌以外, 其他乳酸菌同样具备这种溶菌酶高耐受能力.Boricha等[16]发现在发酵辣椒和秘鲁果实中分离得到的大部分乳酸菌(如Lactobacillus pentosusCHIG、Lactobacillus pentosusNAG1、Lactobacillus fermentumPRS1 等)均对溶菌酶具有较强的耐受性.
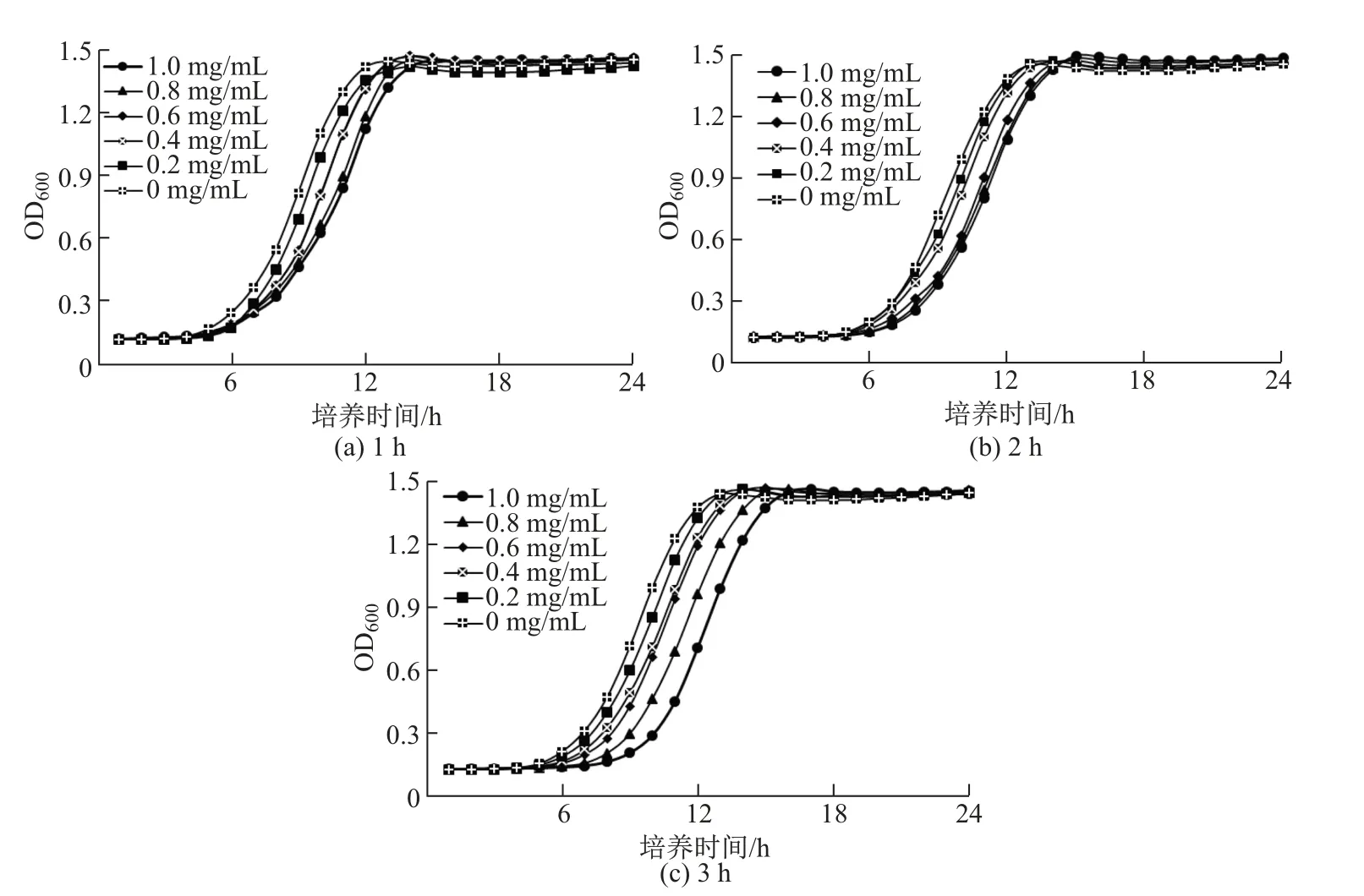
图4 溶菌酶处理不同时间对B44 生长曲线的影响Fig.4 Effects of lysozyme on the growth curve of B44 at different time
2.3 L.fermentum B44 疏水性和静电作用分析
口腔中的益生菌能否特异或者非特异地黏附于口腔粘膜上, 取决于其黏附能力、疏水性以及表面电荷量.由B44 对二甲苯的黏附实验可知, 菌株的疏水率为(79.67±1.47)%, 碱电荷占比为(82.10±0.84)%, 酸电荷占比为(13.32±1.67)%, 菌株的疏水性较强.研究表明, 疏水性强的菌株不但能较好地保护细胞, 而且可以促进细胞与口腔粘膜的黏附.Yousra 等[17]从突尼斯自发发酵的山羊奶中新近分离的菌株的益生菌特征进行了评估, 发现表面疏水性高达77.3%.
此外,L.fermentumB44还有低酸、高碱的膜表面电荷分布特点.姚沛琳[18]认为, 拥有此类电荷分布特点的益生菌不仅更容易黏附于口腔, 而且能与变形链球菌竞争细胞黏附位点, 进而降低口腔中致龋菌的总量, 减少后者生物膜的形成量, 达到抗龋的益生性能.
2.4 自聚和共聚能力分析
菌株自聚和共聚能力是考察菌株可否作为口腔益生菌发挥作用的重要指标.菌株的自动聚集能力或共聚能力越强, 越有利于菌株在口腔中定植、繁殖和存活, 这是菌株在口腔中发挥益生性能的重要前提[19].如图5 所示, 菌株B44 的自聚率和共聚率与孵育时间正相关, 即孵育时间越长, 菌体的自聚集和共聚集效果越好, 培养2 h 和4 h 后B44 的自聚率分别为6.45%和13.34%, 与变形链球菌的共聚率分别为12.49%和17.45%.
蔗糖是引发龋齿的重要诱因之一[20], 本研究进一步探索了蔗糖浓度对B44 聚集率的影响.结果发现, 蔗糖对菌株B44 自聚能力的影响不显著, 含不同蔗糖浓度的培养基中B44自聚率基本处于同一水平.然而, B44 与S.mutans的共聚率与蔗糖质量分数、孵育时间正相关, 增加培养基中蔗糖含量或延长孵育时间, 可增强共聚效果.由图5 可知, 培养体系中的蔗糖质量分数分别为0.25%、0.5%、2%、5% 时, B44 与S.mutans的共聚能力分别为31.15%、35.74%、36.76%和46.23%.从效果来看, 高糖环境确实对B44 菌株与致龋菌的共聚性有积极作用, 但鉴于蔗糖自身存在诱发龋齿的潜在风险.因此, 在实际应用过程中需进行多角度、全方位的综合权衡, 力求实现B44 菌株高成效、低风险的治龋应用.

图5 B44、S.mutans 共聚和B44 自动聚集能力Fig.5 Self-aggregation of B44 and coaggregation of B44 with S.mutans
2.5 L.fermentum B44 对S.mutans 生物膜形成量的影响
众所周知,S.mutans可利用蔗糖合成(不溶性)胞外多糖, 并通过后者在牙釉表面的黏附作用与其他细菌发生共聚, 且黏附于牙齿表面形成牙菌斑生物膜.其中定植的致龋菌在特定生境中进一步发酵产酸致使牙齿无机质脱矿, 进而侵蚀牙面或牙根形成龋洞, 即为龋齿[21].因而从根源上控制S.mutans定植口腔的关键性物质基础——生物膜的形成便可有效控制龋齿的产生.本工作考察了B44 对S.mutans生物膜的影响, 结果如图6 所示.可以看出: 与B44 菌体共培养的S.mutans的生物膜形成量比单独培养时降低了63.043%(P <0.01), 表明B44 可有效调控S.mutans生物膜的形成, 具备防龋治龋的应用前景.杨娟等[22]从健康志愿者的牙菌斑样品中分离获得一株具备防治口腔疾病能力的发酵乳杆菌Y29, 该菌株对S.mutans的生长有抑制作用, 因而其益生机制与本研究完全不同.
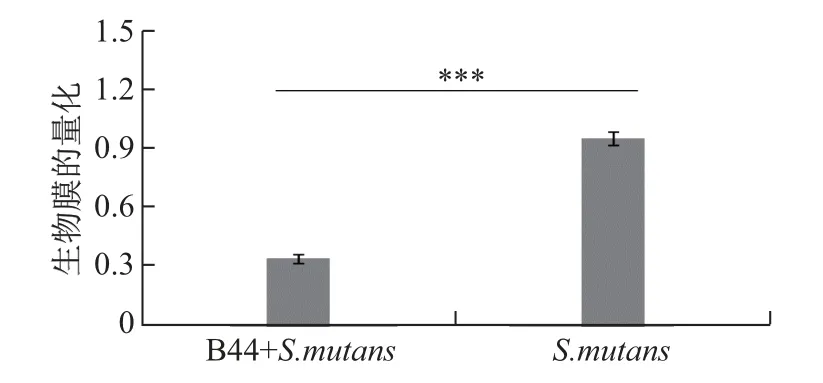
图6 B44 对S.mutans 生物膜形成的影响Fig.6 Effect of B44 on the formation of S.mutans biofilm
3 结束语
发酵乳杆菌属于乳杆菌科中的乳杆菌属, 广泛分布于植物和胃肠道中.其作为一类典型的异型发酵乳酸菌, 在传统上多用于谷类食品的发酵和生产, 此外, 在发酵食品(如面包、酸奶、泡菜等)的制备中也有应用.研究表明,L.fermentans在促进胃肠道蠕动、防治上呼吸道感染、促进B 族维生素的吸收等领域发挥着重要功能, 然而在改善口腔健康方面的研究尚处于起步阶段.
本工作采用的发酵乳杆菌B44 是一株分离自保加利亚手工酸奶的乳酸菌, 其最适生长培养基是MRS 培养基, 最适生长温度为42◦C.该菌株具有较强的疏水性和低酸高碱的表面电荷分布, 在口腔中具有良好的黏附能力.较强的溶菌酶耐受能力、自聚能力以及共聚能力有利于其菌体在口腔中的定植、存活以及与S.mutans竞争占位.更重要的是, B44 还能有效遏制S.mutans牙菌斑生物膜的形成, 从而达到防治龋病的目的.综上所述,L.fermentansB44 具备作为一株口腔益生菌应用的潜力.

