九香虫i型溶菌酶基因的克隆与细菌诱导表达分析
黄海 杜娟 李尚伟 龚涛 齐小浪









摘要
溶菌酶是一組进化上保守的酶,在昆虫中主要分为c型和i型两类。为明确i型溶菌酶在九香虫Coridius chinensis体内的表达模式与功能,我们对九香虫的两个i型溶菌酶基因CcLysi1和CcLysi2进行了克隆,这两个基因的编码区分别为504 bp和432 bp,分别编码167和143个氨基酸。序列分析显示,CcLysi1和CcLysi2缺乏与催化活性相关的谷氨酸(E)和丝氨酸(S)。同源性和聚类分析显示,CcLysi1和CcLysi2与斯氏珀蝽Plautia stali的i型溶菌酶相似性最高,分别为80.36%和48.95%。采用实时荧光定量PCR(RTqPCR)解析CcLysi1和CcLysi2基因的时空表达谱,结果表明它们在九香虫不同发育阶段都有表达,CcLysi1在成虫中表达水平最高,而CcLysi2在5龄若虫中表达水平最高;它们在所检测的成虫不同组织中都有表达,都在脂肪体中表达水平最高。九香虫被注射细菌后24 h,CcLysi1和CcLysi2的表达显著上调;九香虫被饲喂细菌后,这两种基因的表达水平没有显著变化。九香虫的这两种i型溶菌酶基因的表达受到自身免疫机制的调控,可以被诱导而参与免疫应答,但不具有参与消化的功能。该研究为进一步明确九香虫i型溶菌酶基因的功能奠定基础。
关键词
九香虫;i型溶菌酶;时空表达;先天免疫;细菌诱导
中图分类号:Q967
文献标识码:A
DOI:10.16688/j.zwbh.2020669
Cloning and induced expression analysis of the itype lysozyme genes in Coridius chinensis
HUANG Hai,DU Juan,LI Shangwei*,GONG Tao,QI Xiaolang
(Guizhou Provincial Key Laboratory for Agricultural Pest Management in Mountainous Regions,
Institute of Entomology, Guizhou University, Guiyang, Guizhou550025, China)
Abstract
Lysozymes are a group of evolutionarily conserved enzymes and can be divided into ctype and itype in insects. In order to clarify the expression pattern and function of the itype lysozyme in Coridius chinensis, we cloned two itype lysozyme genes CcLysi1 and CcLysi2. The coding regions of these two genes were 504 bp and 432 bp, encoding 167 and 143 amino acids, respectively. Sequence analysis showed that CcLysi1 and CcLysi2 lacked glutamic acid (E) and serine (S) related to catalytic activity. Homology and cluster analyses showed that CcLysi1 and CcLysi2
shared the similarity of 80.36% and 48.95%, respectively, with the itype lysozyme from Plautia stali. The spatiotemporal expression profiles of CcLysi1 and CcLysi2 were analyzed by using realtime quantitative PCR (RTqPCR). The results indicated that these two genes were expressed at various developmental stages of C. chinensis, with the highest expression levels for CcLysi1 in the adults and for CcLysi2 in the fifthinstar nymphs; they were expressed in different tissues of adults and had the highest expression level in the fat bodies. The expression levels of CcLysi1 and CcLysi2 were significantly upregulated within 24 h post bacterial injection, but there were no significant changes in the expression levels of these two genes post bacterial feeding. The expression of these two itype lysozyme genes in C.chinensis was regulated by its own immune mechanism and could be induced to participate in immune response, but they were not involved in digestion. This study laid a foundation for further elucidating the functions of the itype lysozyme genes in C.chinensis.
Key words
Coridius chinensis;itype lysozyme;spatiotemporal expression;innate immunity;bacterial induction
九香虫Coridius chinensis隶属于半翅目Hemiptera兜蝽科Dinidoridae,广泛分布于我国南方地区,包括云南、四川、贵州、广西等地,主要以葫芦科植物的汁液为食,春夏季节常栖息在南瓜等农作物的茎叶上吸食浆液,造成植株生长缓慢,为害严重时,可造成植株枯死。 同时,九香虫也是一种极具开发潜力的昆虫资源,其虫体内富含蛋白质、多肽、脂肪酸、维生素以及微量元素等[1- 2],具有很高的食用和药用价值[3]。研究表明,九香虫提取物具有抗菌和抗癌活性[4],研究发现这些活性主要源于提取物中的一些活性多肽,例如防御素和溶菌酶等[5-8]。此外,九香虫野生资源数量有限,在自然条件下,九香虫一年仅发生一代,加之人们对其进行的破坏性采集及环境污染,野生虫源逐年减少,人工繁殖九香虫是解决其供不应求的重要途径[9]。相较于自然环境中的九香虫,目前完全人工饲养的九香虫子代常出现畸形、免疫力低下以及细菌感染等严重问题,给九香虫的饲养和繁殖带来巨大挑战。因此,提高其子代自身的免疫防御功能和抗病能力也是目前养殖的关键,加强对九香虫免疫系统和免疫防御反应机理的研究势在必行。
昆虫在长期的生物进化过程中形成了独特的免疫系统,仅靠先天免疫就能迅速有效地完成对细菌、病毒或药物的免疫[10-11]。昆虫先天免疫主要由体液免疫和细胞免疫组成。体液免疫包括产生抗菌肽、活性氧或氮的中间产物,以及调节血淋巴凝固或黑色素化的复杂酶级联反应[12 -15]。细胞免疫是指由血细胞介导的免疫反应,包括吞噬、结瘤和包埋[16 -17]。作为体液免疫机制的重要组成部分,抗菌肽(antimicrobial peptides, AMPs)是宿主防御的第一个屏障,能杀死细菌、真菌、病毒和原生动物等微生物或减缓它们的生长[18- 19]。在各种抗菌活性物质中,溶菌酶是最常见的,存在于许多生物中,如细菌、噬菌体、真菌、植物和动物。
溶菌酶在结构、催化和免疫学特性上存在差异。传统上溶菌酶分为3大类型:鸡型溶菌酶(c型)、鹅型溶菌酶(g型)和无脊椎动物型溶菌酶(i型)[20- 21]。溶菌酶通常具有水解酶活性,能水解细菌细胞壁肽聚糖聚合物中N乙酰胞壁酸和N乙酰氨基葡萄糖之间的β1,4糖苷键[22- 23]。因此,溶菌酶对于不断接触环境中微生物的无脊椎动物尤为重要,可以帮助它们抵御细菌病原体的入侵[24- 26]。i型溶菌酶最初是在海星和海洋双壳类动物中发现的,在昆虫中普遍存在[27]。家蝇Musca domestica和海洋双壳类动物消化器官中溶菌酶的发现还表明了溶菌酶具有参与消化的功能,这类溶菌酶在肠道中高表达[28-30]。此外,据报道i型溶菌酶还具有异肽酶和几丁质酶活性[31-32]。从医用水蛭Hirudo medicinalis唾液中分离出的一种i型溶菌酶最初被描述为一种失稳酶(destabilase),因为它能够溶解交联纤维蛋白[33],该酶后来被证明既具有溶菌酶活性又具有异肽酶活性[34]。 作为一组进化上保守的酶,许多在昆虫中编码c型和i型溶菌酶的基因在基因组和转录组分析中被鉴定出来。目前,研究者已研究了昆虫c型溶菌酶在蛋白质水平上的功能特征,而对于昆虫i型溶菌酶只在DNA或mRNA水平上研究了其特征[35]。昆虫i型溶菌酶可能在进化过程中失去了溶菌酶原有的一些特性,而获得了新的、尚未确定的功能。
本课题组在前期九香虫转录组测序中共发现了12种抗菌活性多肽, 包括4种昆虫防御素,1种富含甘氨酸的抗菌肽,1种富含脯氨酸的抗菌肽以及6种溶菌酶。本研究在防御素和c型溶菌酶的研究基础上选择2个i型溶菌酶基因CcLysi1和CcLysi2,研究它們与其他物种的i型溶菌酶之间的进化关系,并进行了细菌感染诱导下靶基因表达的分析,初步探索两种i型溶菌酶在九香虫生长发育以及先天免疫中的功能。这项研究旨在完善九香虫溶菌酶在免疫防御机制中的作用,为昆虫中广泛存在的i型溶菌酶的研究提供了一定的理论依据与数据支撑。
1材料与方法
1.1昆虫与供试菌
九香虫 Coridius chinensis采自贵阳市花溪区,在人工气候箱中用南瓜叶饲养。饲养温度(28±1)℃,相对湿度80%,光照周期L∥D=14 h∥10 h。 克隆载体pMD18T和大肠杆菌Escherichia coli感受态细胞TOP10购自生工生物工程(上海)股份有限公司,保存于 80℃冰箱,大肠杆菌 E.coli(ATCC 25922)和藤黄微球菌Micrococcus luteus(CMCC 28001)均保存于贵州大学昆虫研究所分子生物学实验室。
1.2RNA提取与基因克隆
采用HP Total RNA Kit(Omega BioTek, GA, USA)提取九香虫不同发育时期(卵,1~5龄若虫,雌虫和雄虫)以及成虫各个组织(头、脂肪体、血淋巴、中肠、肌肉、体壁、精巢和卵巢)的RNA,其中九香虫血淋巴提取使用双管离心法[36]。 用NanoDrop 2000超微量分光光度计(Thermo Fisher Scientific, MA, USA)测定RNA浓度,并用1%琼脂糖凝胶电泳检测RNA的质量。采用RevertAid First Strand cDNA Synthesis Kit(Thermo Fisher Scientific, MA, USA)将提取的RNA反转录为cDNA,将合成的cDNA浓度稀释到300~500 ng/μL, 20℃保存。根据转录组序列信息用Primer Premier 6.0设计PCR引物(表1),并由生工生物工程(上海)股份有限公司合成。用2× PCR Master Mix进行PCR,反应条件:95℃预变性3 min;95℃变性30 s,55℃退火30 s,72℃延伸40 s, 35个循环;72℃延伸10 min。对PCR产物进行琼脂糖凝胶电泳检测,并用胶回收试剂盒回收产物连接到pMD18T载体上,转化大肠杆菌感受态细胞TOP10,送至生工生物工程(上海)股份有限公司测序。
1.3生物信息学分析
用NCBI的开放阅读框(Open reading frame, ORF)搜寻数据库(https:∥www.ncbi.nlm.nih.gov/orffinder/)预测CcLysi1和CcLysi2(GenBank登录号见表2)的ORF。在ExPASy ProtParam tool(https:∥web.expasy.org/protparam/)平台预测两种溶菌酶的分子量和等电点,并用SignalP 5.0 Server (https:∥services.healthtech.dtu.dk/service.php?SignalP5.0)分析信号肽及前肽。亚细胞定位使用TargetP 2.0(https:∥services.healthtech.dtu.dk/service.php?TargetP2.0)。用NCBI的BLAST进行同源性比较(https:∥blast.ncbi.nlm.nih.gov/Blast.cgi),并用MEGAX软件中的邻接法构建系统进化树,重复运行1 000次。用于序列比对和构建进化树的溶菌酶来源物种和GenBank登录号见表2。
1.4时空表达谱
采用实时荧光定量PCR(RTqPCR)在CFX96 Touch RealTime PCR仪(BioRad, CA, USA)上检测CcLysi1和CcLysi2基因在九香虫不同发育阶段和成虫 不同组织中的表达水平。利用
Primer Premier 6.0 設计溶菌酶基因CcLysi1和CcLysi2 的特异性引物(表1),引物由生工生物工程(上海)股份有限公司合成。
RTqPCR反应按照2× SYBR Select Master Mix(Thermo Fisher Scientific, MA, USA)说明书进行,反应体系为20 μL:1 μL cDNA,10 μmol/L上、 下游引物各1 μL,10 μL 2× SYBR Select Master Mix, 7 μL无RNA酶的无菌去离子水。反应程序:50℃ 2 min;95℃预变性2 min; 95℃变性15 s,61℃退火15 s,72℃延伸1 min,40个循环,每个样本重复3次,以九香虫βactin基因(GenBank登录号:MK370101)作内参对照。
1.5细菌注射
大肠杆菌和藤黄微球菌在自然环境中广泛分布,是动物经常接触到的细菌,通常在动物出现损伤时会引起伤口感染。溶菌酶等抗菌物质是昆虫应对细菌感染的第一道屏障,抑制细菌感染是它们最主要的功能。因此,注射细菌通常可诱导这类抗菌物质的产生。将藤黄微球菌和大肠杆菌分别接种于20 mL LB培养基中,于37℃恒温培养箱,200 r/min振荡培养至OD600=0.5,10 000 g离心5 min,收集菌体用PBS洗涤,并将两种细菌混合后悬浮于PBS中调节OD600=0.01(5×106cfu/mL)。随机选取100头健康的九香虫成虫,每头腹腔注射1 μL菌液,为排除PBS缓冲液和机械损伤的影响, 用同样的方法注射无菌的1 μL PBS作为阴性对照。注射后的九香虫饲养在人工气候箱中,温度(28±1)℃,相对湿度80%,光照周期L∥D=14 h∥10 h,分别在无菌条件下收集10头注射细菌后6、8、12、24、36、48、60 h和72 h时的九香虫,用液氮速冻。RNA提取和cDNA合成方法同上。采用RTqPCR分析注射细菌后CcLysi1和CcLysi2的表达量,并与九香虫c型溶菌酶CcLys2进行比较分析(GenBank登录号:MN816376)。
1.6细菌饲喂
在250 mL LB培养液中接种藤黄微球菌,于37℃摇床,200 r/min振荡过夜培养至OD600=4,然后10 000 g离心5 min,收集菌体用PBS洗涤,再悬浮于PBS中调节至OD600=2。将采摘的新鲜南瓜茎叶剪碎与藤黄微球菌悬液(OD600=2)混合,放入15 mm×25 mm的透明塑料盒子中。将随机选取的40头饥饿12 h的健康九香虫成虫转入该塑料盒子,用尼龙网封口以保证空气流通并将其放入人工气候箱中继续培养,以未混菌的南瓜茎叶饲养的九香虫为对照。分别收集喂养6、12 h和24 h的九香虫成虫中肠,用液氮速冻。总RNA提取、cDNA合成和RTqPCR步骤同上。
1.7数据统计与分析
用2 ΔΔCt法计算不同发育阶段、不同组织及细 菌诱导后CcLysi1和CcLysi2的表达水平。RTqPCR表达量相关数据用SPSS 22.0统计软件进行分析,采用单因素方差分析(ANOVA)和邓肯氏新复极差法进行多重检验,P<0.05为差异显著。
2结果与分析
2.1序列验证与特征分析
CcLysi1和CcLysi2基因经PCR扩增后,电泳显示在约570 bp和460 bp位置各出现明亮的扩增带,与预期扩增片段大小一致(图1),测序结果与来自转录组的序列相同。两种溶菌酶基因在NCBI数据库中的BLAST结果表明,它们属于无脊椎动物型(i型)溶菌酶基因。CcLysi1基因的开放阅读框为504 bp,编码167个氨基酸,预测分子量为18.04 kDa,理论等电点为5.28(图2a)。CcLysi2基因的开放阅读框长度为432 bp,编码143个氨基酸,预测分子量为15.74 kDa,理论等电点为5.12(图2b)。亚细胞定位预测显示,这两种九香虫i型溶菌酶均为分泌蛋白,都有一个N端信号肽,信号肽长度分别为21个氨基酸(G21↓Q22,CcLysi1)和24个氨基酸(G24↓L25,CcLysi2)。 结构域分析显示两种溶菌酶均具有典型的i型溶菌酶结构域LYZ_i, 且CcLysi1和CcLysi2在糖结合位点上的氨基酸高度一致(图2)。
2.2序列比对与系统发育分析
将来自九香虫的4种溶菌酶的成熟蛋白氨基酸序列与其他12个物种的i型溶菌酶氨基酸序列进行比对,这12个物种包括4种软体动物(美洲牡蛎Crassostrea virginica,菲律宾帘蛤Ruditapes philippinarum和文蛤Meretrix lusoria),2种环节动物(安德爱胜蚓Eisenia andrei和医用水蛭H.medicinalis),6种节肢动物(果蝇Drosophila serrata,异色瓢虫Harmonia axyridis,冈比亚按蚊Anopheles gambiae,斑节对虾Penaeus monodon和克氏原鳌虾Procambarus clarkii)。多序列比对显示了i型溶菌酶催化必需的谷氨酸残基E和天冬氨酸残基D,以及完全保守的8个半胱氨酸残基C基序。与c型溶菌酶一样,谷氨酸残基E和天冬氨酸残基D也被认为对i型溶菌酶的催化活性至关重要[37 38]。有趣的是,来自九香虫的4种溶菌酶以及其他节肢动物的i型溶菌酶至少缺乏这两种氨基酸残基中的一个,而环节动物和软体动物的i型溶菌酶都具有这两种保守的催化残基(图3)。此外,一般认为i型溶菌酶还具有异肽酶活性,并且这种异肽酶活性被认为涉及丝氨酸蛋白酶机制,需要丝氨酸残基S62和组氨酸残基H92[39 40]。然而,在节肢动物中丝氨酸残基S并不保守,除异色瓢虫外,九香虫的4种溶菌酶以及其他节肢动物的i型溶菌酶对应位点均没有发现有丝氨酸残基S的存在(图3)。
以九香蟲c型溶菌酶CcLys2和家蚕B.mori的c型溶菌酶BmLZ为外群,用邻接法构建基于成熟蛋白的系统发育树,结果显示来自节肢动物的溶菌酶聚为一支,在另一支中,除了斑节对虾溶菌酶PmLyzi1外,还包括环节动物、软体动物以及棘皮动物的i型溶菌酶(图4)。与其他无脊椎动物i型溶菌酶相比,用于系统发育分析的所有节肢动物i型溶菌酶几乎都缺失了与胞壁质酶活性相关的特 征催化残基;在NCBI蛋白数据中对i型溶菌酶的检索表明,i型溶菌酶中这种推测的催化残基的缺失在昆虫中普遍存在。来自九香虫的4种溶菌酶与斯氏珀蝽Plautia stali和茶翅蝽Halyomorpha halys的溶菌酶聚为一个亚群,这表明它们具有较近的亲缘关系;而九香虫的这4种i型溶菌酶在系统发育树上的差异,则表明九香虫i型溶菌酶至少有3种不同的亚型。
2.3时空表达谱
九香虫溶菌酶基因CcLysi1和CcLysi2的时空表达模式见图5和图6,CcLysi1和CcLysi2在九香虫不同发育时期的表达水平有显著差异。CcLysi1在成虫期的表达量最高且雌、雄虫之间无显著差异,在5龄若虫中的表达量次之。CcLysi1在成虫中的表达量约为在卵中的5倍,5龄若虫中的3倍(图5a)。CcLysi2在5龄若虫中的表达量最高,在4龄若虫中的表达量次之,在成虫中的表达量较低。CcLysi2在5龄若虫中的表达量约为卵中的3倍以及成虫中的4倍(图5b)。在检测的成虫不同组织中,CcLysi1和CcLysi2具有相似的组织分布模式,两种i型溶菌酶均在脂肪体有最高的表达量;在其余组织中,CcLysi1主要在血淋巴、精巢和卵巢中表达(图6a),而CcLysi2在血淋巴和中肠中有较高的表达量(图6b)。
2.4细菌注射后溶菌酶基因的表达模式
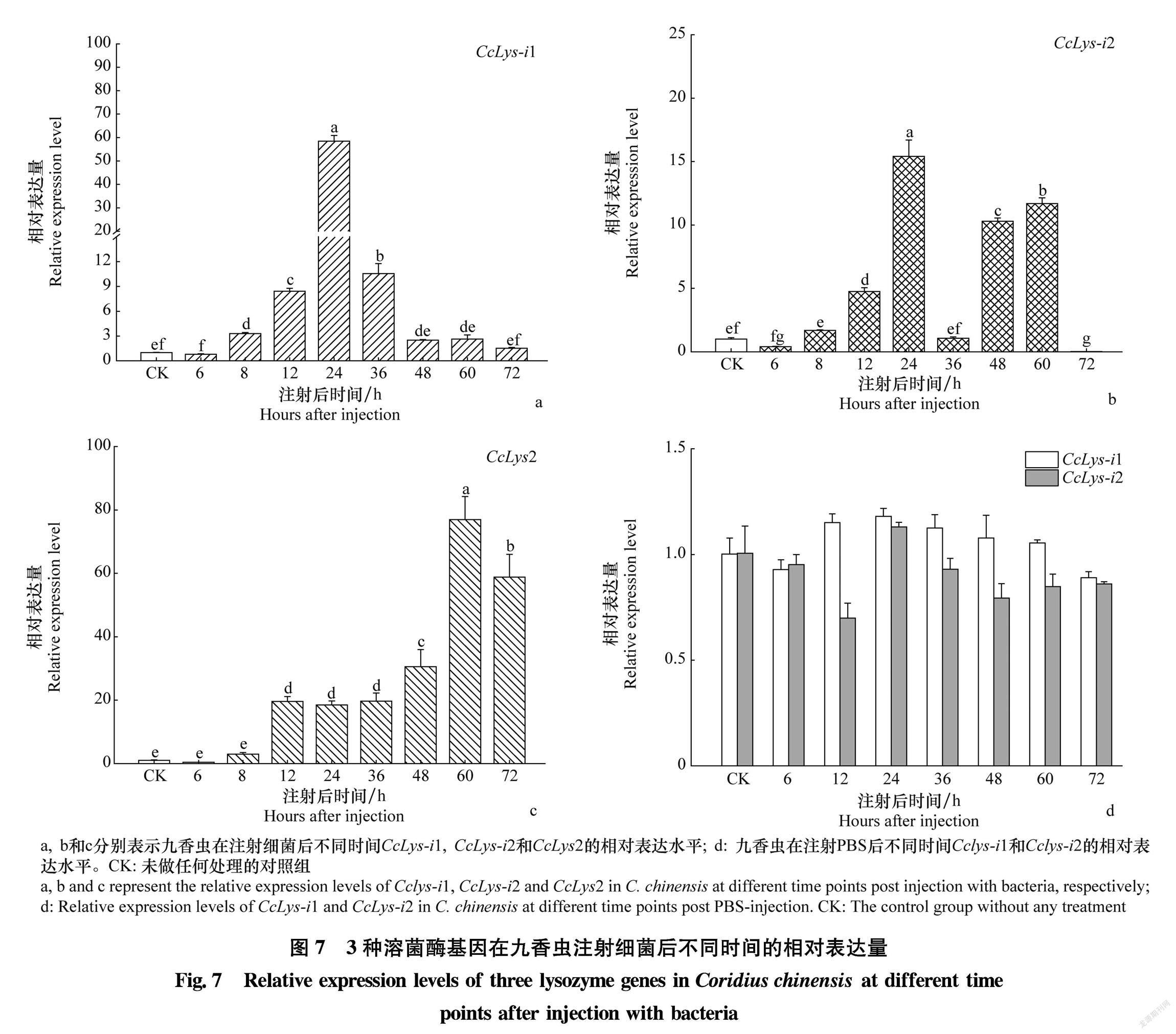
九香虫被注射细菌后3种溶菌酶基因的表达模式见图7,与未注射细菌的对照组(CK)相比,虽然CcLysi2 在36 h出现波动,但总体上CcLysi1和CcLysi2以及c型溶菌酶CcLys2的表达水平均显著上调,表达模式基本一致。CcLysi1和CcLysi2的表达量在24 h内升高并达到最大值,CcLys2则是在60 h内持续保持高丰度并达到最大值;而在注射PBS的样本中CcLysi1和CcLysi2的表达水平基本保持不变或变化很小(图7d),说明注射PBS不能诱导这两种溶菌酶的表达。这些结果表明CcLysi1和CcLysi2与九香虫的免疫密切相关。
2.5细菌饲喂后溶菌酶基因的表达模式
与注射细菌后的表达模式不同,被饲喂细菌的九香虫与用南瓜茎叶正常饲喂的九香虫(CK)相比,仅发现c型溶菌酶CcLys2表达水平在饲喂6 h后有显著上调,而两种i型溶菌酶基因的表达丰度在24 h内与对照组相比变化幅度较小,并未上调(图8),这说明CcLysi1和CcLysi2在中肠中不能被饲喂细菌的方式所诱导,并不参与九香虫肠道的消化作用。
3结论与讨论
溶菌酶作为一种重要的天然免疫因子,广泛分布于脊椎动物和无脊椎动物[41]。本文报道了来自九香虫的两种无脊椎动物型(i型)溶菌酶CcLysi1和CcLysi2,该研究可为其他昆虫i型溶菌酶同源物的功能注释提供参考。
先前的研究通过定点诱变方法证实E18和D30在i型溶菌酶TJL催化活性中的重要性,它们被认为是c型溶菌酶HEWL中催化残基E35和D52的等价物[37- 38, 42]。然而,在节肢动物中i型溶菌酶缺乏这两种催化残基的情况并不罕见,尤其是在昆虫的i型溶菌酶中。有研究提出昆虫中c型溶菌酶的功能冗余导致i型溶菌酶失去活性,从而获得新的功能[43],在苹掌舟蛾Phalera flavescens中发现的N乙酰氨基乳糖特异性凝集素被认为是从昆虫i型溶菌酶进化而来[44]。后续的研究也证明i型溶菌酶具有多种功能,如异肽酶活性、几丁质酶活性和非酶抗菌活性等[45-46]。在本研究中,序列分析显示来自九香虫的2种i型溶菌酶均没有与胞壁质酶活性相关的谷氨酸残基E以及异肽酶活性所需的丝氨酸残基S,仅CcLysi2在对应活性位点上有天冬氨酸残基D,因此我们推测CcLysi1和CcLysi2可能既没有胞壁质酶活性也没有异肽酶活性。在异色瓢虫中发现的5种i型溶菌酶也存在类似的情况,它们均缺乏与胞壁质酶或异肽酶活性相关的催化残基,而在后续的研究中被证实没有相关的酶活性[35]。
无脊椎动物型(i型)溶菌酶在生物体内具有多种功能。在克氏原螯虾和斑节对虾中,i型溶菌酶没有胞壁质酶活性,但仍具有非酶抗菌活性和异肽酶活性[46-47],其抗菌活性似乎与胞壁质酶之间并没有必然联系。在蚊子中,i型溶菌酶被认为在吸血或免疫中起作用[43]。在软体动物中,i型溶菌酶还被认为具有帮助消化的作用,类似于反刍动物胃中的c型溶菌酶[20, 48-49]。在医用水蛭中,i型溶菌酶具有异肽酶活性,有分解血凝块中纤维蛋白的功能[40]。但在目前的研究中,一般认为昆虫i型溶菌酶缺乏胞壁质酶活性相关的结构域,而其是否具有异肽酶活性尚不清楚[50],仅研究了它们在DNA或mRNA水平上的特征。为了更好地了解i型溶菌酶在九香虫中的作用,我们对CcLysi1和CcLysi2的表达水平进行了检测。CcLysi1和CcLysi2具有相似的组织分布模式,可以在脂肪体、血淋巴以及精巢和卵巢中检测到。脂肪体和血淋巴在昆虫的天然免疫系统中非常重要,通常昆虫抗菌肽在脂肪体中表达后分泌到血淋巴[51-52]。因此,CcLysi1和CcLysi2可能作为抗菌蛋白参与免疫过程,至于检测到CcLysi1在精巢和卵巢有一定表达水平,则暗示了其可能与九香虫生长发育有某种联系。在人类精子顶体中发现的溶菌酶样蛋白SLLP1就被认为在精卵结合中发挥作用[53]。
有研究表明,异色瓢虫的一种i型溶菌酶以及冈比亚按蚊的两种i型溶菌酶并不能被免疫激发所诱导[35]。然而,在我们的研究中,九香虫的两种i型溶菌酶不仅可以被诱导,而且与来自九香虫的c型溶菌酶CcLys2有着相似的表达模式。九香虫被注射细菌后,CcLysi1和CcLysi2在数小时内持续上调,一般昆虫在感染细菌后约6~12 h抗菌肽就会出现在被感染昆虫的血淋巴中[54],而在注射PBS的样本中并未检测到CcLysi1和CcLysi2的表达水平的显著变化,这表明它们与九香虫的免疫密切相关。九香虫喂食混有细菌的南瓜茎叶后两种基因的表达并未出现上调,则说明CcLysi1和CcLysi2并不在肠腔分泌,虽然有研究表明i 型溶菌酶可能有助消化的作用,但在本研究中没有证据表明两种九香虫i型溶菌酶有这样的功能,仅c型溶菌酶CcLys2可能存在这种功能。现有的研究表明,i型溶菌酶在不同物种之间具有不同的活性和功能,即使在同一个物种中,不同的i型溶菌酶功能也可能有所不同。在九香虫的不同发育阶段,CcLysi1与CcLysi2表达模式不同,受到九香虫自身发育的调控。CcLysi1在雌雄成虫中高表达,且在精巢和卵巢中表达水平较高,这表明该基因可能與九香虫的生长发育相关,而CcLysi2在若虫期的表达水平高于成虫,推测i型溶菌酶可能具有与昆虫蜕皮相关的几丁质酶活性。
本研究从九香虫的转录组中筛选并克隆了两个无脊椎动物型溶菌酶基因CcLysi1和CcLysi2,对这两种基因的mRNA表达模式进行了解析。研究结果表明,两种溶菌酶在进化上属于典型的昆虫i型溶菌酶,受到九香虫自身发育的调控,与九香虫被细菌感染后的免疫应答密切相关。该研究有助于进一步研究i型溶菌酶在九香虫生长发育和免疫防御中的作用,从而为九香虫资源的开发提供理论支撑。鉴于i型溶菌酶功能的多样性及昆虫i型溶菌酶在蛋白水平功能上的不确定性,下一步我们考虑用RNA干扰或基因编辑(CRISPRCas9)技术对其功能做进一步研究。
参考文献
[1]李俐, 李晓飞. 贵州九香虫营养成分分析[J].昆虫知识, 2010, 47(4): 748- 751.
[2]刘伦沛, 郁建平. 九香虫的营养成分分析与评价 [J]. 食品科学, 2008, 29(2): 406-410.
[3]刘庆芳. 九香虫现代临床研究与应用 [J].河南大学学报(医学科学版), 2002, 22(4): 66 -67.
[4]侯晓晖, 孙廷, 李晓飞. 九香虫粗提物对SGC7901和HepG2细胞增殖及细胞周期的影响 [J]. 时珍国医国药, 2013, 24(1): 108-109.
[5]郭志来. 基于转录组测序和真核重组表达的九香虫(Aspongopus chinensis Dallas)来源防御素和溶菌酶研究 [D]. 贵州: 贵州师范大学, 2018.
[6]李尚伟, 赵柏松, 杜娟. 九香虫抗菌肽CcAMP1的分离纯化和抗菌活性检测 [J]. 昆虫学报, 2015, 58(6): 610-616.
[7]吴玛莉, 金道超. 九香虫血淋巴及其纯化蛋白抑菌活性的研究 [J]. 昆虫知识, 2005, 42(3): 315- 318.
[8]喻廷君, 杜娟, 李尚伟. 九香虫防卫素基因CcDef1的克隆及特征分析 [J]. 山地农业生物学报, 2019, 38(3): 6-11.
[9]吴有芳. 九香虫滞育生理原因初步研究 [D]. 贵州: 贵州大学, 2019.
[10] CYTRYSKA M, WOJDA I, JAKUBOWICZ T. How insects combat infections [M]∥BALLARIN L, CAMMARATA M. Lessons in immunity. Amsterdam: Academic Press, 2016: 117-128.
[11] HOFFMANN J A. Innate immunity of insects [J]. Current Opinion in Immunology, 1995, 7(1): 4 -10.
[12] NAKHLEH J, MOUSSAWI L E, OSTA M A. The melanization response in insect immunity [M]∥LIGOXYGAKIS P. Advances in insect physiology. Amsterdam: Academic Press, 2017: 83-109.
[13] NAPPI A J, CHRISTENSEN B M. Melanogenesis and associated cytotoxic reactions: applications to insect innate immunity [J]. Insect Biochemistry & Molecular Biology, 2005, 35(5): 443-459.
[14] ZUG R, HAMMERSTEIN P. Wolbachia and the insect immune system: what reactive oxygen species can tell us about the mechanisms of Wolbachiahost interactions [J/OL]. Frontiers in Microbiology, 2015, 6: 1201. DOI: 10.3389/fmicb.2015.01201.
[15] YI Huiyu, CHOWDHURY M, HUANG Yadong, et al. Insect antimicrobial peptides and their applications [J]. Applied Microbiology & Biotechnology, 2014, 98(13): 5807-5822.
[16] LAVINE M D, STRAND M R. LAVINE M D, et al. Insect hemocytes and their role in immunity [J]. Insect Biochemistry and Molecular Biology, 2002, 32(10): 1295-1309.
[17] STRAND M R. The insect cellular immune response [J]. Insect Science, 2008, 15(1): 1-14.
[18] BACHRE E. Antiinfectious immune effectors in marine invertebrates: potential tools for disease control in larviculture [J]. Aquaculture, 2003, 227: 427 -438.
[19] BULET P, STCKLIN R, MENIN L. Antimicrobial peptides: from invertebrates to vertebrates [J]. Immunological Reviews, 2010, 198(1): 169- 184.
[20] BACHALI S, JAGER M, HASSANIN A, et al. Phylogenetic analysis of invertebrate lysozymes and the evolution of lysozyme function [J]. Journal of Molecular Evolution, 2002, 54(5): 652-664.
[21] SIMPSON R J, BEGG G S, DOROW D S, et al. Complete amino acid sequence of the goosetype lysozyme from the egg white of the black swan [J]. Biochemistry, 1980, 19(9): 1814-1819.
[22] IMOTO T, JOHNSON L N, NORTH A C T, et al. 21 vertebrate lysozymes [J]. The Enzymes, 1972, 7: 665-868.
[23] QASBA P K, KUMAR S, BREW K. Molecular divergence of lysozymes and αlactalbumin [J]. Critical Reviews in Biochemistry, 1997, 32(4): 255-306.
[24] HIKIMA S, HIKIMA J I, ROJTINNAKORN J, et al. Characterization and function of kuruma shrimp lysozyme possessing lytic activity against Vibrio species [J]. Gene, 2003, 316(1): 187-195.
[25] MAI Weijun, HU Chaoqun. Molecular cloning, characterization, expression and antibacterial analysis of a lysozyme homologue from Fenneropenaeus merguiensis [J]. Molecular Biology Reports, 2009, 36(6): 1587-1595.
[26] MINAGAWA S, HIKIMA J I, HIRONO I, et al. Expression of Japanese flounder ctype lysozyme cDNA in insect cells [J]. Developmental & Comparative Immunology, 2001, 25(5/6): 439-445.
[27] JOLLS J, JOLLS P. The lysozyme from Asterias rubens [J]. FEBS Journal, 1975, 54(1): 19-23.
[28] CANADO F C, VALRIO A A, MARANA S R, et al. The crystal structure of a lysozyme c from housefly Musca domestica, the first structure of a digestive lysozyme [J]. Journal of Structural Biology, 2007, 160(1): 83-92.
[29] MARANA S R, CANADO F C, VALRIO A A, et al. Crystallization, data collection and phasing of two digestive lysozymes from Musca domestica [J]. Acta Crystallographica Section F Structural Biology and Crystallization Communications, 2006, 62(Pt 8): 750-752.
[30] MCHENERY J G, BIRKBECK T H, ALLEN J A. The occurrence of lysozyme in marine bivalves [J]. Comparative Biochemistry & Physiology Part B Comparative Biochemistry, 1979, 63(1): 25-28.
[31] ITO Y, YOSHIKAWA A, HOTANI T, et al. Amino acid sequences of lysozymes newly purified from invertebrates imply wide distribution of a novel class in the lysozyme family [J]. European Journal of Biochemistry, 1999, 259(1/2): 456- 461.
[32] JOSKOV R, ILEROV M, PROCHZKOV P, et al. Identification and cloning of an invertebratetype lysozyme from Eisenia andrei [J]. Developmental & Comparative Immunology, 2009, 33(8): 932-938.
[33] BASKOVA L P, NIKONOV G I. Destabilase, the novel ε(γGlu)Lys isopeptidase with thrombolytic activity [J]. Blood Coagulation and Fibrinolysis, 1991, 2(1): 167-172.
[34] ZAVALOVA L L, LAZAREV V N, LEVITSKY S A, et al. Destabilaselysozyme of medicinal leech. Multifunctionality of recombinant protein [J]. Biochemistry, 2010, 75(9): 1173-1181.
[35] BECKERT A, WIESNER J, SCHMIDTBERG H, et al. Expression and characterization of a recombinant itype lysozyme from the harlequin ladybird beetle Harmonia axyridis [J]. Insect Molecular Biology, 2016, 25(3): 202-215.
[36] SU T, MULLA M S. Quantitative determination of free amino acids in the hemolymph of autogenous and anautogenous strains of Culex tarsalis (Diptera: Culicidae) [J]. Journal of Medical Entomology, 1997, 34(6): 729-734.
[37] CALLEWAERT L, MICHIELS C W. Lysozymes in the animal kingdom [J]. Journal of Biosciences, 2010, 35: 127 -160.
[38] GOTO T, ABE Y, KAKUTA Y, et al. Crystal structure of Tapes japonica lysozyme with substrate analogue: structural basis of the catalytic mechanism and manifestation of its chitinase activity accompanied by quaternary structural change [J]. Journal of Biological Chemistry, 2007, 282(37): 27459-27467.
[39] FRADKOV A, BEREZHNOY S, BARSOVA E, et al. Enzyme from the medicinal leech (Hirudo medicinalis) that specifically splits endo(γGlu)Lys isopeptide bonds: cDNA cloning and protein primary structure [J]. FEBS Letters, 1996, 390(2): 145-148.
[40] ZAVALOVA L, LUKYANOV S, BASKOVA I, et al. Genes from the medicinal leech (Hirudo medicinalis) coding for unusual enzymes that specifically cleave endoepsilon (gammaGlu)Lys isopeptide bonds and help to dissolve blood clots [J]. Molecular & General Genetics, 1996, 253(1/2): 20-25.
[41] PRAGER E M, JOLLèS P J. Animal lysozymes c and g: an overview [J]. EXS, 1996, 75: 9-31.
[42] MALCOLM B A, ROSENBERG S, COREY M J, et al. Sitedirected mutagenesis of the catalytic residues Asp52 and Glu35 of chicken egg white lysozyme [J]. Proceedings of the National Academy of Sciences of the United States of America, 1989, 86(1): 133-137.
[43] PASKEWITZ S M, LI B, KAJLA M K. Cloning and molecular characterization of two invertebratetype lysozymes from Anopheles gambiae [J]. Insect Molecular Biology, 2010, 17(3): 217-225.
[44] YOKOYAMA K, SATO M, HANEDA T, et al. An Nacetyllactosaminespecific lectin, PFA, isolated from a moth (Phalera flavescens), structurally resembles an invertebratetype lysozyme [J]. Insect Biochemistry & Molecular Biology, 2014, 54:106 -111.
[45] BASKOVA I P, ZAVALOVA L L. Polyfunctionality of destabilase, a lysozyme from a medicinal leech [J]. Bioorganicheskaia khimiia, 2008, 34(3): 337 -343.
[46] ZHANG Hongwei, SUN Chen, SUN Shanshan, et al. Functional analysis of two invertebratetype lysozymes from red swamp crayfish, Procambarus clarkii [J]. Fish & Shellfish Immunology, 2010, 29(6): 1066- 1072.
[47] SUPUNGUL P, RIMPHANITCHAYAKIT V, AOKI T, et al. Molecular characterization and expression analysis of a ctype and two novel muramidasedeficient itype lysozymes from Penaeus monodon [J]. Fish & Shellfish Immunology, 2010, 28(3): 490-498.
[48] DOBSON D E, PRAGER E M, WILSON A C. Stomach lysozomes of ruminants. I. Distribution and catalytic properties [J]. Journal of Biological Chemistry, 1984, 259(18): 11607-11616.
[49] XUE Q G, ITOH N, SCHEY K L, et al. A new lysozyme from the eastern oyster (Crassostrea virginica) indicates adaptive evolution of itype lysozymes [J]. Cellular & Molecular Life Sciences, 2007, 64(1): 82-95.
[50] HERREWEGHE J M, MICHIELS C W. Invertebrate lysozymes: Diversity and distribution, molecular mechanism and in vivo function [J]. Journal of Biosciences, 2012, 37(2): 327-348.
[51] BOMAN. Geneencoded peptide antibiotics and the concept of innate immunity: an update review [J]. Scandinavian Journal of Immunology, 1998, 48(1): 15-25.
[52] SEUFI A E M, HAFEZ E E, GALAL F H. Identification, phylogenetic analysis and expression profile of an anionic insect defensin gene, with antibacterial activity, from bacterialchallenged cotton leafworm, Spodoptera littoralis [J/OL]. BMC Molecular Biology, 2011, 12(1): 47. DOI:10.1186/1471-2199-12-47.
[53] MANDAL A, KLOTZ K L, SHETTY J, et al. SLLP1, a unique, intraacrosomal, nonbacteriolytic, c lysozymelike protein of human spermatozoa [J]. Biology of Reproduction, 2003, 68(5): 1525-1537.
[54] KANOST M R, JIANG Haobo, YU Xiaoqiang. Innate immune responses of a lepidopteran insect, Manduca sexta [J]. Immunological Reviews, 2004, 198(1): 97 -105.
收稿日期:2020-12-15修訂日期:2021-02-24
基金项目:
国家自然科学基金(31560610)
* 通信作者
E-mail:swlii@163.com

