Sb2O3/Sb 锂离子电池负极材料的制备及电化学性能
张豪杰, 胡业旻
(上海大学材料科学与工程学院, 上海 200444)
近年来, 持续增长的能源需求使得开发高能量密度、清洁的储能装置成为研究的热门, 锂离子电池体系由于具有高能量密度而备受研究者的关注[1-2].传统的锂离子电池负极是石墨,这是因为石墨负极的能量密度为372 mAh·g−1, 且具有良好的循环稳定性和倍率性能.由于消费电子产品的迅速更迭, 新能源汽车以及其他智能设备的发展对储能装置提出了更高的要求,传统的石墨负极很难满足日益高涨的需求.因此, 开发高能量密度负极材料成为了亟待解决的问题[3-4].
金属负极通常具有高的理论容量, 例如硅[5]、锡、锑[6]等.锑的理论容量为660 mAh·g−1,储量丰富且具有较低的放电电压, 成为一种潜在的锂离子电池负极材料[7].但是, 锑负极在充放电过程中会发生合金化-脱合金化反应, 在获得高容量的同时面临着巨大体积膨胀(290%)的问题.巨大的体积膨胀导致电极材料的破碎粉化, 使电池的循环性能迅速衰减[7-8].解决体积膨胀问题的一种有效途径是设计复合结构, 如设计合适妥当, 复合物中物相可以优势互补达到良好的综合性能[6,9-11].Sb2O3理论容量是1 102 mAh·g−1, 首次放电过程中发生转化反应生成Li2O, Li2O 充当缓冲相阻止金属颗粒团聚[10].由于氧化物通常导电性能较差, 在大电流充放电时, 氧化物电极电子传输速度差, 从而得到较差的倍率性能.因此, 我们设计了Sb2O3/Sb 复合材料, 其中锑能改善复合物的电子传输能力, 而锑的体积膨胀问题能借助转化反应生成的Li2O 得到改善.
1 实 验
1.1 三氧化二锑/锑复合物的制备
本工作中使用的原料为实验室制备的多孔锑.由锑的热重图谱可知, Sb 发生明显氧化的温度在400◦C 附近.因此, 选择温度区间300∼450◦C, 以50◦C 的温度梯度分别对多孔锑进行空气退火1 h 处理, 加热速率为5◦C/min, 所得样品分别记为Sb-300、Sb-350、Sb-400、Sb-450, 并分别对其进行扫描电镜表征.根据不同温度对形貌的破坏程度, 选定样品保持最好的350◦C 为微氧化温度.在350◦C 下对样品分别进行空气退火4、8、12、24 h 处理, 样品分别记为Sb-350-4、Sb-350-8、Sb-350-12、Sb-350-24, 然后分别对其进行表征与电化学性能测试.
1.2 电池装配及电化学测试
首先将制备的样品、导电剂(乙炔黑)、粘接剂(黄原胶)按照8∶1∶1 制备浆料, 再加入适量去离子水混合搅拌均匀后, 用涂膜机在铜箔上进行涂膜, 最后将膜放在真空干燥箱(80◦C)中干燥12 h.干燥后的电极片用裁片机裁成直径为12 cm 的电极片, 再放于手套箱(水蒸气和氧气的质量分数均小于10−7)中, 使用锂金属片作为对电极, 六氟磷酸锂作为电解液封装电池.封装好的电池放置12 h 后进行恒电流充放电测试, 电化学窗口为0∼3 V, 循环伏安(cyclic voltammetry, CV)测试的电压窗口为0∼3.0V, 扫速为0.1 mV·s−1.
1.3 材料的表征
使用X 射线衍射(X-ray diffraction, XRD)对材料的物相进行表征.材料的微观形貌使用扫描电镜(scanning electron microscope, SEM)和透射电子显微镜(transmission electron microscope, TEM)进行表征.采用差热-热重分析法(thermogravimetric analysis-differential thermal analysis, TG-DTA)对Sb2O3/Sb 复合材料中Sb2O3的含量进行定量分析.
2 结果与讨论
2.1 结构与形貌
图1 和2 分别为实验室制备的多孔锑和Sb2O3/Sb 复合材料的XRD 图谱和SME 图.由图1 可知: 样品多孔锑的峰位与标准PDF 卡85-1322 吻合, 确定此物相为Sb;其他样品中除了含有Sb 外, 还含有另外一种相, 对照标准PDF71-0365 证明其为Sb2O3.随着氧化时间的延长,发现在2θ=27.8◦、32.2◦、46.2◦处峰信号的强度逐渐增强, 可知Sb2O3取向生长在进一步增加.

图1 多孔锑和Sb2O3/Sb 复合材料的XRD 图谱Fig.1 XRD pattern of porous Sb and Sb2O3/Sb composites
由图2(a)可知, 多孔锑颗粒大小均匀, 为10µm 左右的金属块, 孔径连通, 分布均匀.由图2(b)可知, Sb-300 形貌基本与多孔锑一致, 未发生变化, 这可能是因为温度太低, 锑的氧化速率极慢.图2(e)中样品部分泛白, 这是因为此部分不导电, 表明此位置发生了烧结, 温度太高, 氧化反应剧烈.因此, 考虑样品制备的效率, 本工作中微氧化温度选择350◦C.图2(f)中样品仍具有多孔结构.图3(g)中样品表面有明显的颗粒状起伏出现, 这可能是存在新生的Sb2O3.图2(h)与图2(g)类似, 均有球形颗粒生成.图2(i)中样品整个颗粒更加密实, 孔径只存在样品表面, 这可能是微氧化时间过长所致.

图2 多孔锑和Sb2O3/Sb 复合材料的扫描电镜图Fig.2 SEM images of porous Sb and Sb2O3/Sb composite
图3 为Sb-350-8 样品的氮气吸脱附曲线和孔径分布.由图3 可以看出, Sb-350-8 样品的氮气吸脱附曲线属于Ⅳ型吸脱附等温线.通过BET(Brunauor-Emmett-Teller)方法计算, 可知Sb-350-8 样品的比表面积为3.55 m2/g.另外, 由图3(c)可知, Sb-350-8 样品的孔径集中分布在2∼15 nm, 保持了较好的孔径结构.

图3 样品Sb-350-8 的N2 吸脱附曲线和孔径分布Fig.3 N2 adsorption-desorption isotherms and pore distribution of Sb-350-8 sample
图4 为Sb-350-8 样品的透射电镜图.由图4(a)可以看出: 经过微氧化处理后的样品仍然维持坚固的锑骨架(深色部分), 新生的Sb2O3相邻生长, 形成了一种独特的孔径结构;区域1(见图4(b))的晶格条纹间距为3.10 nm, 与Sb(012)的晶面间距相吻合, 该区域的傅里叶变换图为周期性排列的点, 说明了Sb 为单晶形态;区域2(见图4(b))的晶格条纹间距为2.79 nm,与Sb2O3(400)的晶面间距相吻合, 该区域的傅里叶变换图为衍射环, 说明了Sb2O3是多晶形态.图5 为Sb-350-8 样品的面扫描能谱图.可以看出, 锑与氧元素均匀地分布在样品表面, 说明在样品的表面很可能形成了Sb2O3的包裹层.
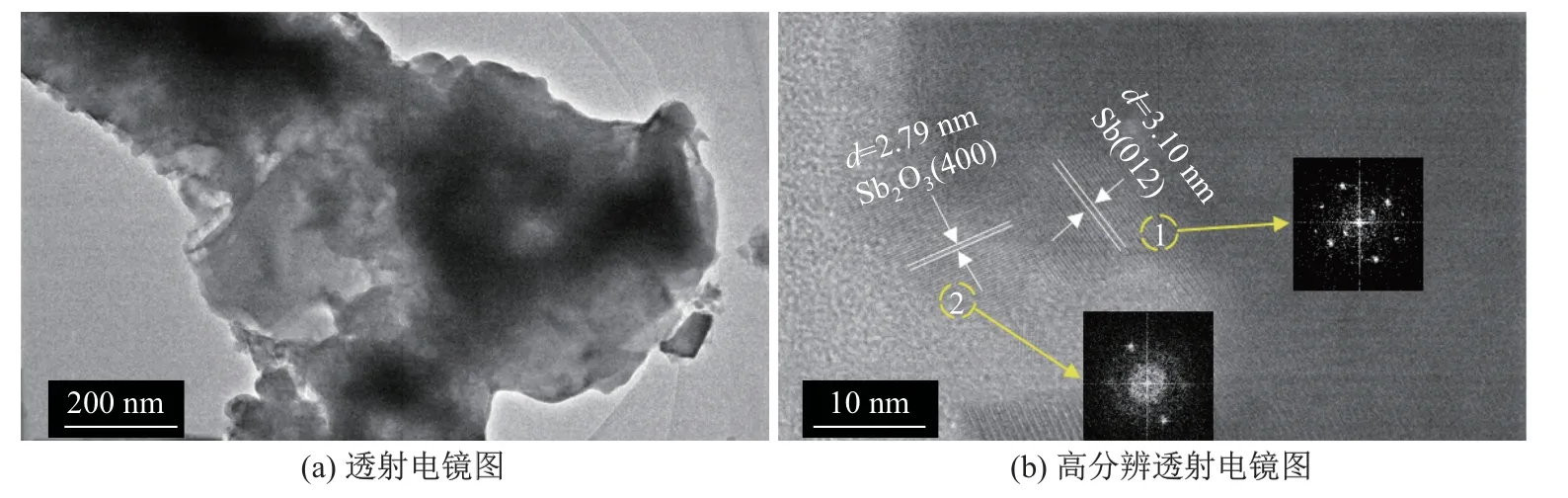
图4 Sb-350-8 样品的透射电镜图Fig.4 TEM and HR-TEM of Sb-350-8 sample

图5 Sb-350-8 样品的面扫描能谱图Fig.5 Elemental pattern of Sb, O of the Sb-350-8 sample
为了定量表征不同样品中Sb2O3的含量, 分别对样品Sb-350-4、Sb-350-8、Sb-350-12、Sb-350-24 进行TG-DTA 分析, 并由样品Sb-350-4 来说明样品中Sb2O3的含量.图6 为多孔锑和Sb2O3/Sb 复合材料样品的TG-DTA 曲线, 从图中6(a)可以看出: 在0∼200◦C 时样品的质量一直在减小, 这可能是样品中水分的挥发造成的[12];样品的增重阶段为370∼560◦C, 对应Sb 的氧化反应, 该阶段出现两个放热峰, 分别是457 和553◦C, 这是Sb 的多步氧化(Sb→Sb2O3→Sb2O4)所致[8];560◦C 之后质量保持恒定, 说明此时氧化过程已经完成.Sb-350-4 的组成为Sb 和Sb2O3, 由于370∼560◦C 对应着样品的氧化过程, 560◦C 后的产物为Sb2O4.由图6(b)可知, 样品质量的增加∆m= 19.7%, 由反应前产物可知, 样品的变化为Sb-350-4 中Sb 得两个O, Sb2O3得一个O 所致, 因此可以计算出Sb-350-4 中Sb2O3的质量分数为30.3%.图6(c)、(d)、(e)中, ∆m分别为11.3%、10.7%、10%, 对应样品中Sb2O3的质量分数分别为70.5%、74.9%、78.3%.由4 个样品中Sb2O3的含量可知, 350◦C 时, 随着反应时间的延长, Sb2O3含量增加速率越来越缓慢, 这可能是因为新生的Sb2O3覆盖在Sb 上, 使内部的Sb 更难接触到空气中O2, 从而减缓了反应的速度.

图6 多孔锑和Sb2O3/Sb 复合材料的TG-DTA 图Fig.6 TG-DTA diagrams of porous Sb and Sb2O3/Sb composites
2.2 电化学性能
图7(a)为Sb-350-8 的循环伏安曲线.可以看出: 在首次扫描中1.03 V 处出现了一个较宽的还原峰, 0.61 V 处出现了第二个尖锐的还原峰, 分别对应着Sb2O3+Li→Sb+Li2O,Sb+Li→Li3Sb 反应;在随后的反扫过程中, 1.03 V 附近的还原峰消失, 说明了转化反应的不可逆性;在1.20 V 的扫描中, 氧化还原峰位稳定, 说明了电极具有良好的可逆性.图7(b)为电流密度为200 mA·g−1时Sb-350-8 的充放电曲线.可以看出: 在1.2 V 处出现了放电平台,对应着Sb2O3与Li 发生转化反应生成Li2O, 在0.82 V 处出现了放电平台, 这是Sb 与Li 生成Li3Sb 所致[10];在随后的充放电曲线中, 1.2 V 的平台消失, 说明了转化反应的不可逆性, 而这与CV 的结果相对应.Sb-350-8 电极的首次放电比容量为1 272.1 mAh·g−1, 首次充电比容量为994.7 mAh·g−1, 首次库伦效率为78.2%.图8(a)为电流密度为200 mA·g−1时Sb2O3/Sb 样品的循环性能图.经过100 圈循环后Sb-350-4、Sb-350-8、Sb-350-12、Sb-350-24 的容量剩余分别为481.2、729.6、552.0、563.67 mAh·g−1.Sb-350-4 虽然具有较好的循环能力, 但是由于Sb2O3的含量较低(30.3%), 故容量较低.Sb-350-12、Sb-350-24 虽然初始容量较高, 但是稳定性较差, 这可能由于Sb2O3的含量过高使得复合物电子传输能力急剧下降, 颗粒破碎严重最终导致样品的循环性能急剧下降.Sb-350-8 容量剩余729.6 mAh·g−1, 容量保持为73.34%,远高于多孔锑(426 mAh·g−1), 这得益于该复合物中Sb2O3含量适中, 新生的Sb2O3形成了不同于多孔锑的独特孔结构, 以及Sb2O3与Sb 的协同效应[10].图8(b)为样品Sb-350 的倍率性能测试图, 电流密度为50、100、200、500、1 000、2 000、3 000、5 000、10 000 mA·g−1时,Sb-350-8 的容量分别为954、890、850、787、726、653、570、420、203 mAh·g−1.在电流密度重置为100 mA·g−1时, 容量回复至820 mAh·g−1, 表现了良好的可逆性, 并且在各个电流密度下, 其容量均是样品中最高的.Sb-350-8 号样品表现了优秀的电化学性能, 这是由于其独特的Sb2O3/Sb 结构设计.在Sb2O3/Sb 复合材料中, Sb2O3在提供高容量的同时, 在首次放电Sb2O3发生转化反应, 生成的一部分不可逆Li2O 可以阻止因巨大的体积膨胀而造成Sb 破碎引起的团聚现象, 缓解内部应力, 而Sb 可以加速电子传导, 增加复合材料的导电性, 从而加速电化学反应, 有利于循环性能的提升.Sb2O3与Sb 之间的这种协同效应使Sb-350-8 表现了优异的电化学性能[8,10,13].为了进一步评价Sb-350-8 的储锂性能, 采用商业磷酸铁锂[14]作为全电池的正极, Sb-350-8 复合物作为负极, 全电池的电压窗口为2.5∼4.0 V, Sb-350-8 复合物电极在全电池封装前进行预锂化处理.图9 为全电池的充放电曲线和循环性能.由图9 可见,放电平台在2.2 V 左右、电流密度为200 mA·g−1时, 循环30 圈后, 电池容量为90 mAh·g−1, 库伦效率为97.1%, 展现了较好的循环性能.
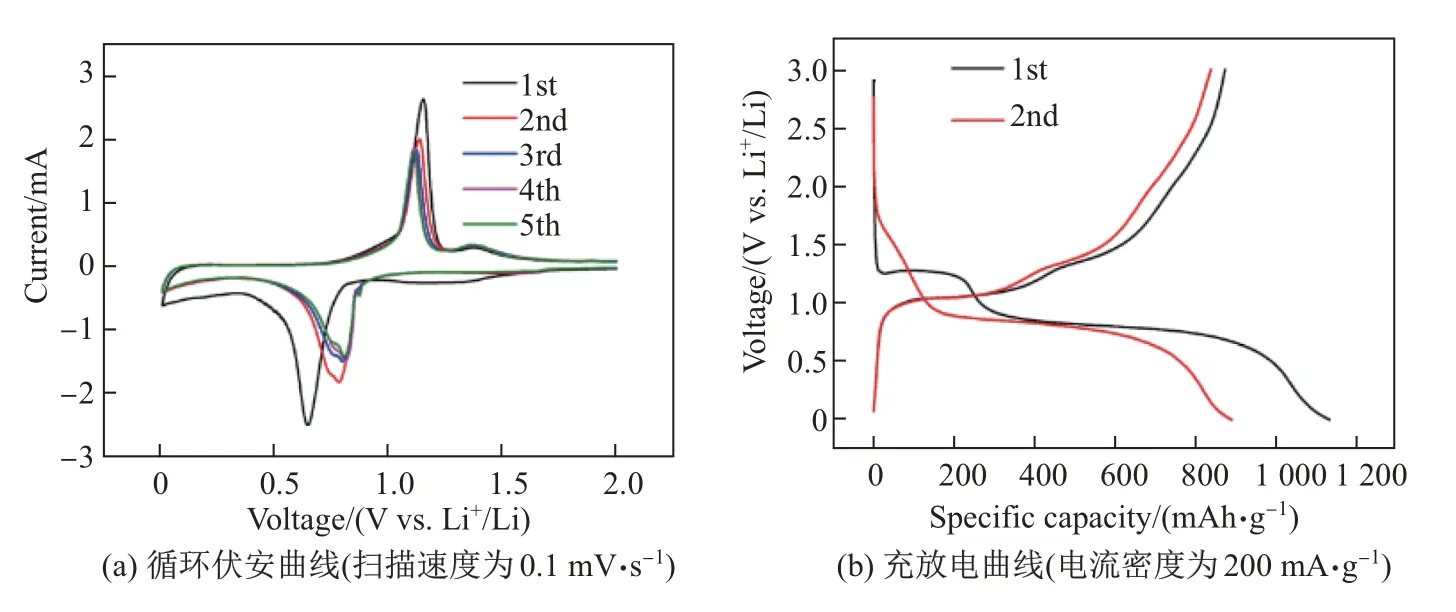
图7 样品Sb-350-8 的循环伏安曲线和充放电曲线Fig.7 CV curve and charge-discharge curve of Sb-350-8 sample

图8 多孔锑和Sb-350 复合材料的循环性能和倍率性能Fig.8 Cycle performance and rate performance of porous Sb and Sb-350 samples
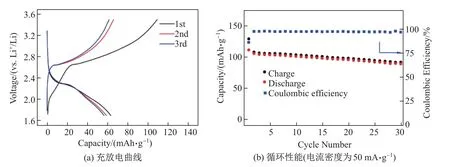
图9 LiFePO4-Sb2O3/Sb 全电池的充放电曲线和循环性能Fig.9 Charge-discharge diagram and cycle performance of LiFePO4-Sb2O3/Sb full cell
3 结束语
本工作通过梯度试验确定微氧化温度, 通过控制氧化时长来控制Sb2O3的含量, 制备了Sb2O3/Sb 复合物材料, 并对样品进行了SEM、XRD、TEM, TG-DTA 表征和电化学性能测试.经过350◦C 微氧化8 h 的样品中Sb2O3的含量为70.5%, 其中新生的相邻的Sb2O3之间接触形成了多孔结构, 整体具有密实的结构.Sb2O3/Sb 复合材料表现出了优秀的电化学性能,电流密度为200 mA·g−1时首次库伦效率为78.2%, 循环100 圈后容量高达729.6 mAh·g−1, 电流密度为10 000 mA·g−1时,容量仍有203 mAh·g−1.Sb2O3/Sb 复合材料表现出优异的电化学性能, 归因于Sb2O3与Sb 形成的协同效应: Sb2O3提供高容量;基于转化反应生成的Li2O 组织Sb 团聚, 缓解应力;Sb 提高材料的电子传输能力, 提高电化学反应动力, 有利于电化学反应的进行.Sb2O3/Sb 复合材料的制备为制备其他高性能金属-氧化物型复合材料提供了一个良好的思路.

