壳聚糖酶解产物抑制真菌活性研究
王军华 赵双枝 陈相艳 张彦昊 辛 雪 张 翔 陈蕾蕾
(山东省农业科学院农产品研究所/山东省农产品精深加工技术重点实验室/农业农村部新食品资源加工重点实验室,山东 济南 250100)
随着社会的进步和生活水平的提高,人们对食品安全提出了更高的要求,然而,目前食品工业中常用的防腐剂主要为化学防腐剂,因其滥用引发的食物中毒事件频发,也使得寻找安全、高效、绿色、低毒的生物防腐保鲜剂已成为近几年的研究热点[1]。壳聚糖是一种天然高分子聚合物,除具有广谱抑菌性,还具有良好的生物相容性、低毒性、低抗敏性及可降解性等[2-3]。研究表明,采用壳聚糖处理采后果蔬,能在抑制病原菌侵染果实的同时,诱导果蔬产生抗性[4],有效提高樱桃番茄[5-6]、砂糖橘[7]、草莓[8]、脐橙[9]、苹果梨[10]、冬枣[11]等果实的贮藏品质;壳聚糖处理番茄幼苗可以提高番茄幼苗的光合利用率以及保护酶活性,从而提高番茄幼苗对灰霉病的抗性[12]。此外,壳聚糖涂膜处理可抑制鱼类等水产品的菌落增长[13]。表明壳聚糖具有发展成为高效生物防腐保鲜剂的潜力。
本试验前期研究过程中发现,市售壳聚糖经酶解后,酶解产物对真菌的抑制活性显著提高。而且有研究显示,壳聚糖经酶解后得到低分子量壳聚糖,其抑菌活性显著提高[14]。因此,本试验拟对壳聚糖酶解产物的抑制真菌活性进行研究,旨在为推进壳聚糖在防腐保鲜方面的应用提供理论基础。
1 材料与方法
1.1 试验材料
壳聚糖,上海生工生物工程股份有限公司;壳聚糖酶,自制,由菌株ncps116 的发酵上清液,经硫酸铵沉淀、50 mmol.L-1磷酸盐缓冲溶液(pH 值7.5)复溶并透析,酶的发酵、制备、理化性质以及活力测定按文献[15]所述;氨基葡萄糖盐酸盐标准品,上海源叶生物科技有限公司;1 mg.mL-1碘化丙啶(propidium iodide,PI)溶液,大连美仑生物技术有限公司;马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA),青岛海博生物科技有限公司;其他化学试剂均为市售分析纯。
1.2 主要仪器与设备
OLYMPUS IX71 倒置荧光显微镜,日本奥林巴斯株式会社;ZEISS Sigma 300 场发射扫描电子显微镜,德国卡尔.蔡司股份公司。
1.3 试验方法
1.3.1 壳聚糖酶解产物制备 将壳聚糖溶于1%冰醋酸中,制成2%(w/v)的壳聚糖溶液,按5 U.g-1的比例加入壳聚糖酶溶液,在50℃、180 r.min-1条件下进行酶解试验,收集不同酶解时间(0、0.5、1、1.5、2、3、4、5、6、7、8、9、10、11、12 和24 h)西瓜专化型尖孢镰刀真菌的酶解产物,沸水浴15 min 灭活,10 000 r.min-1离心2 min 后,取上清液冻干得壳聚糖酶解产物的冻干粉末,备用。
1.3.2 壳聚糖酶解产物中还原糖浓度测定 参考文献[16],采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid, DNS)法测定。准确称取氨基葡萄糖盐酸盐标准品,加蒸馏水配制成浓度分别为0.065、0.130、0.260、0.520、1.040、2.080、3.320、4.150、6.640 mg.mL-1的氨基葡萄糖溶液。分别吸取4 mL 氨基葡萄糖溶液,以蒸馏水为空白,加入3 mL DNS 试剂,沸水浴加热5 min,冷却后定容至10 mL,摇匀后测定540 nm 波长处的吸光度值,绘制标准曲线。取冻干粉末,加蒸馏水配制成1%的待测溶液,取4 mL 待测溶液,按照上述方法定容后,于11 000 r.min-1离心2 min,取上清液测定540 nm 波长处的吸光度值,以蒸馏水为空白,根据标准曲线计算样品中的还原糖浓度。
1.3.3 壳聚糖酶解产物真菌抑制试验 取病原菌菌块,接种于PDA 平板,28℃培养3 d 后,从病原菌菌丝边缘制取直径5 mm 菌块,用无菌刀切碎后混悬于400 μL无菌水中,取50 μL 菌悬液涂布于PDA 平板上(平板中含有30 μg.mL-1的氯霉素)。在平板上打孔,孔直径9 mm,孔间距不小于4 cm,每个孔中加入150 μL 待测样品,28℃培养48 h,采用十字交叉法测定抑菌圈直径。
1.3.4 pH 值对壳聚糖酶解产物抑菌性能的影响 取酶解时间为6 h 的酶解液冻干粉末加蒸馏水溶解至浓度为1%,调节pH 值分别为4.0、4.7、5.4、6.0、6.5 和7.0,以西瓜专化型尖孢镰刀菌为指示菌按照上述真菌抑制试验培养48 h,测定抑菌圈直径,以相应pH 值的0.2 mol.L-1醋酸-醋酸钠缓冲溶液为空白对照。
1.3.5 壳聚糖酶解产物对孢子萌发的影响 制备新鲜的西瓜枯萎病菌孢子悬液,无菌水调整孢子个数为106个.mL-1。吸取500 μL 孢子悬液至10 mL 壳聚糖6 h 酶解液(含浓度2%葡萄糖)中,酶解液浓度分别为0.1%和1.0%,28℃、150 r.min-1条件下避光培养12 h,11 000 r.min-1离心10 min 后收集孢子,蒸馏水洗涤2 次,加入990 μL 蒸馏水重悬孢子,加入10 μL PI 溶液,混匀后在黑暗中静置15 min,在倒置荧光显微镜下观察、拍照。
1.3.6 扫描电镜观察壳聚糖酶解产物对真菌菌丝的影响 取西瓜专化型尖孢镰刀菌抑菌圈边界处的菌丝置于2%预冷戊二醛中,于4℃条件下固定,样品的脱水、干燥和镀膜由山东微亚生物技术有限公司完成,在扫描电子显微镜下观察、拍照。
1.4 数据处理
使用Excel 2010 软件进行数据统计分析;使用SPSS 22.0 软件的Duncan 法进行显著性分析,P<0.05为差异显著,P>0.05 为差异不显著,方差分析结果均以平均值±标准偏差(mean±SD)表示。
此外,每一中不同的用地类型有着不同的生境适宜性,对受生态威胁的敏感程度也不同,综合众多研究成果[26-27]的基础上,结合研究区域生态环境的具体情况,将土地利用类型分为人工地类、自然地类两大类,分别赋值0(人工)、1(自然),从人工地类到自然地类,敏感性由低到高,其取值范围为0-1,0表示不敏感,1表示高度敏感性。本文对应的地类对各威胁因子的敏感度具体如表2所示。
2 结果与分析
2.1 壳聚糖酶解产物对病原真菌的抑制活性

图1 不同酶解时间的壳聚糖酶解产物(1%)对棉花黄萎病菌的抑制活性Fig.1 The inhibitory activities of chitosan hydrolysates at a concentration of 1%at different digestion time toVerticillium dahliae
使用壳聚糖酶对市售壳聚糖进行酶解,以棉花黄萎病菌为病原指示菌,抑菌结果显示(图1),整个酶解期间,抑菌活性呈先升高后降低的趋势。酶解0.5 h时,抑菌活性显著升高,酶解0.5 ~2 h 期间,抑菌活性无显著变化,之后呈线性提高,在酶解6 h 时达到最大,之后缓慢降低;酶解12 h 内,酶解产物对棉花黄萎病菌的抑制活性均较未经酶解的壳聚糖显著增强,直至24 h 时,酶解较为完全,抑菌活性低于未经酶解的壳聚糖。壳聚糖酶能够专一催化水解壳聚糖中的糖苷键,生成低分子量壳聚糖,酶解程度不同,其抑菌活性存在差异,然而壳聚糖抑制真菌活性与分子量相关[17],分子量降低减少了壳聚糖分子间作用,有利于壳聚糖与细胞壁的脂质双层和阴离子脂质的静电和疏水缔合,增强壳聚糖与真菌细胞膜的结合[18]。
为深入验证壳聚糖酶解产物对植物病原菌的抑制活性均有改善,测定抑菌活性提高最显著的6 h 酶解产物对3 种病原真菌的最低抑菌活性,结果显示(表1),市售壳聚糖对3 种病原菌的最低抑菌浓度在0.500% ~1.000%,而6 h酶解产物为0.125% ~0.250%,最低抑菌活性提高了4~8 倍。
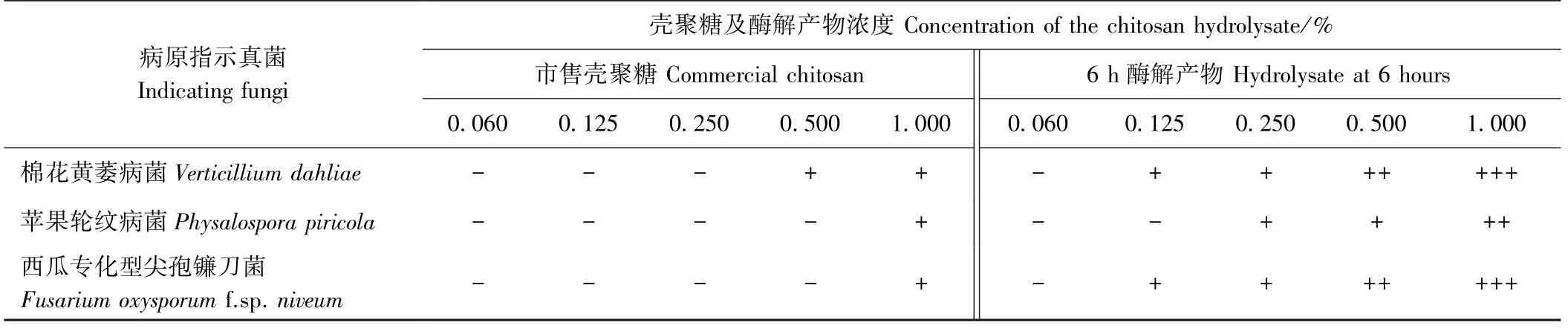
表1 壳聚糖及酶解产物的抑菌效果Table 1 The inhibitory activities of the chitosan and chitosan hydrolysate
2.2 壳聚糖酶解产物中还原糖浓度分析
壳聚糖经酶解后,暴露出还原端,分子内的自由醛基与DNS 发生氧化还原反应,生成红棕色的3-氨基-5-硝基水杨酸[19]。经测定氨基葡萄糖浓度在0.13 ~2.00 mg.mL-1范围内,OD540(y)与浓度(x)呈线性相关(y=1.264 7x- 0.093 9,r=0.997 6),还原糖浓度高低可反映壳聚糖的酶解水平。
由图2 可知,随着酶解的进行,酶解产物中的还原糖浓度总体逐渐增加,酶解0.5 h 时还原糖浓度为44.24 μg.mL-1,与未经酶解的市售壳聚糖相比,其抑菌活性显著提高(图1),表明用酶解反应提高市售壳聚糖的抑菌活性是可行的;随后还原糖浓度呈增加趋势,至酶解9 h 时达到571.79 μg.mL-1,酶解9 ~12 h期间,还原糖浓度变化平稳,酶解24 h 产物的还原糖浓度迅速增大为酶解12 h 产物的3 倍,表明酶解反应一直在进行。此外,酶解1 ~12 h 产物的抑菌活性呈现先升高后降低的趋势,其中酶解6 h 产物的抑菌活性最强,此时还原糖浓度为383.34 μg.mL-1,与酶解0~1 h 产物中的还原糖浓度存在显著差异(P<0.05),与酶解12 h 内其他产物中的还原糖浓度无显著差异(P>0.05);而酶解24 h 产物的还原糖浓度较酶解6 h产物显著提高,但其抑菌活性显著降低(P<0.05)。同时,DNS 法测定还原糖浓度的过程中发现,氧化还原过程中,酶解0~12 h 的酶解产物中均有沉淀出现,而酶解24 h 的产物无沉淀析出,表明此时已酶解充分,推测主要成分为溶解性较好的壳寡糖。而酶解24 h产物对棉花黄萎病菌的抑制活性显著降低,甚至低于未经酶解的壳聚糖,表明并非酶解越充分,抑制活性越好。因此,酶解过程中可通过控制还原糖浓度,并结合抑菌活性,实时监测酶解过程,以防酶解不足或过度水解,影响水解液的抑制真菌效果。
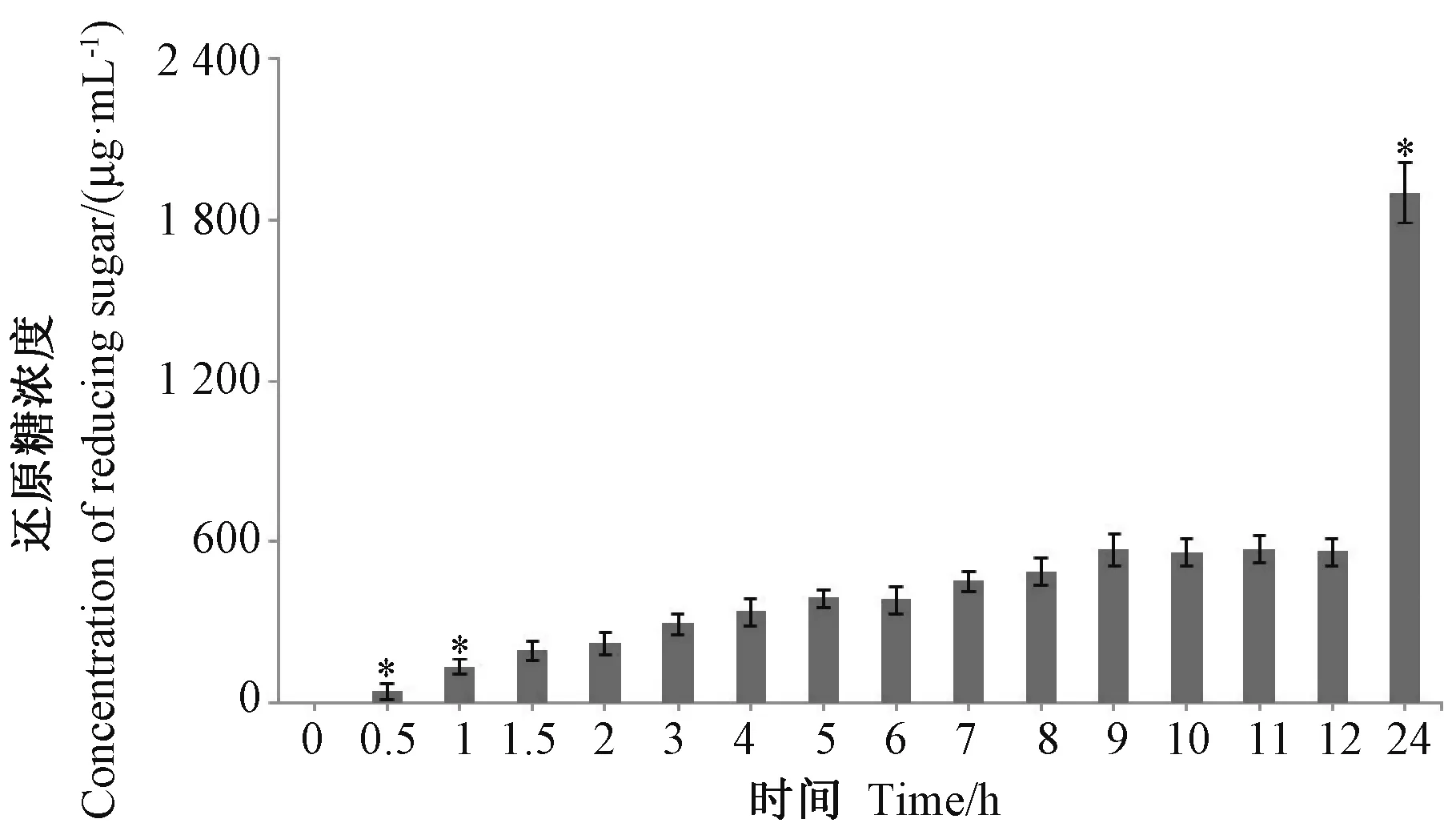
图2 不同酶解时间壳聚糖酶解产物(1.0%)中的还原糖浓度Fig.2 The reducing sugar content of chitosan hydrolysates at a concentration of 1.0%at different digestion time
2.3 pH 值对壳聚糖酶解产物抑制真菌活性的影响
以活性提高最显著的酶解6 h 产物为研究对象,考查pH 值对壳聚糖酶解产物抑制真菌活性的影响。由图3 可知,pH 值在4~7 范围内(初始pH 值4.7)对病原真菌西瓜专化型尖孢镰刀菌都有抑制作用,但不同pH 条件下,抑菌活性存在显著差异。当pH 值>5.4时,酶解6 h产物的抑菌圈直径较初pH 值显著减小,随着pH 值的持续增加,抑菌圈发生不同程度的减小,当pH 值达到7.0 时,抑菌圈直径最小。目前普遍认为,低pH 值条件下,壳聚糖氨基经质子化,所带正电荷与细胞表面的蛋白质或磷脂相互作用增强,影响细胞膜结构[8,20],质子化壳聚糖也会进入菌体胞内,吸附结合部分带负电的细胞质,扰乱菌体细胞的正常生理代谢[21-22];而当pH 值持续升高,正电荷的比例降低,细胞膜表面结合作用以及细胞质吸附作用就变差;此外,pH 值升高还导致壳聚糖酶解产物的溶解性变差[23],最终导致抑菌活性降低。因此,在壳聚糖酶解产物应用过程中,酸性条件有利于壳聚糖酶解产物质子化,更有利于发挥其对真菌的抑制活性。也确有研究证实,壳聚糖水解液在酸性环境下对耐药性大肠杆菌的抑制作用显著[22],马海宾等[24]也发现低分子量壳聚糖在pH 值5.5~6.5 时抑制病原菌效果最佳。

图3 不同pH 值下壳聚糖酶解6 h 产物(1.0%)对西瓜枯萎病菌的抑菌作用Fig.3 The inhibitory activities of chitosan hydrolysate at 6 h (1.0%)with different pH value to F. oxysporum f.sp. niveum
2.4 壳聚糖酶解产物对孢子的作用
Plascencia-Jatomea 等[25]研究发现壳聚糖溶液会延迟黑曲霉孢子休眠期,影响孢子极化和芽管形成,并产生孢子聚集现象。为研究壳聚糖酶解产物是否也对真菌孢子有抑制作用,在荧光显微镜下观察不同处理对孢子萌发的影响(图4),相较于未处理孢子,0.1%壳聚糖6 h 酶解产物处理的孢子萌发不受影响,但菌丝长度明显变短,生长缓慢;而1%壳聚糖酶解6 h 产物处理的孢子形状变长,仅有少数伸出芽管。在荧光显微镜下,3 个试验组结果均为PI 阴性。PI 不能通过活细胞膜,却能穿过破损的细胞膜,对死细胞进行染色,这表明壳聚糖酶解产物仅能抑制孢子萌发,不能破坏孢子完整性。为验证这种抑制作用是否只是暂时的,进而将1%壳聚糖酶解产物处理的孢子用蒸馏水洗涤2 次,蒸馏水重悬后,取50 μL 悬液涂布于PDA平板上。12 h 后,对照平板已布满菌丝(图5-A),而处理过的平板无肉眼可见菌落出现(图5-B),直至48 h开始出现较小的菌落,生长缓慢(图5-D),7 d 后,菌落直径增加,但菌落数没有增加(未列图)。这可能是由于酶解后低分子量的壳聚糖不可逆地结合到孢子表面,抑制了部分孢子的萌发;而对于已经萌发的孢子,没有足量的壳聚糖与之结合,菌丝的生长不能完全被抑制[25-26]。

图4 不同浓度壳聚糖6 h 酶解产物对西瓜专化型尖孢镰刀菌真菌孢子的作用Fig.4 The effect of chitosan hydrolysates at 6 hours with different concentration on spore germination with F. oxysporum as indicator
2.5 扫描电镜观察壳聚糖酶解产物对真菌菌丝的影响
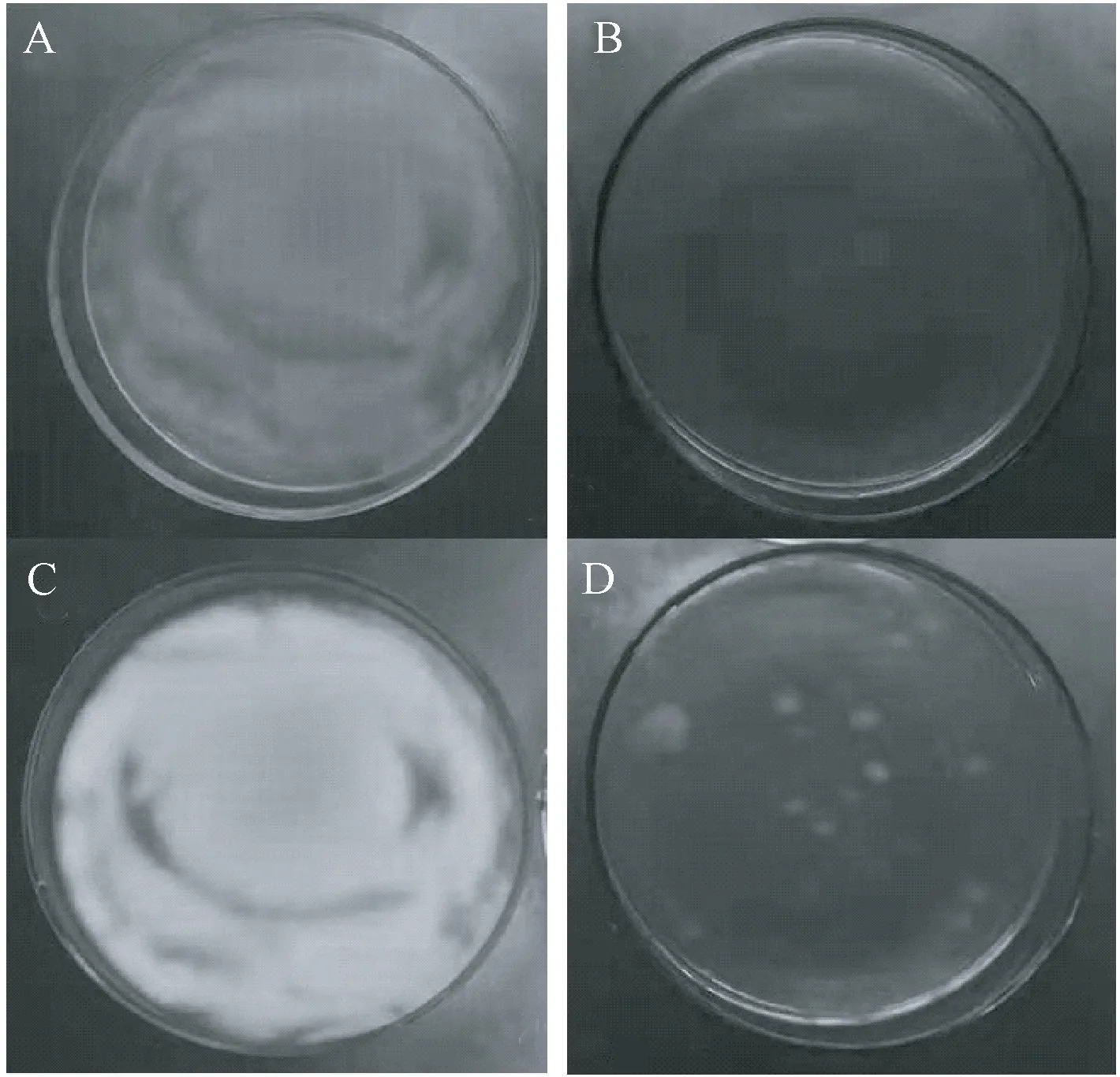
图5 壳聚糖6 h 酶解产物(1.0%)对西瓜专化型尖孢镰刀菌真菌孢子的作用Fig.5 The F. oxysporum spore germination on plate after being treated with chitosan hydrolysates at 6 hours (1.0%)
真菌抑菌试验中,0.1%~1.0%壳聚糖酶解6 h 产物均能抑制西瓜专化型尖孢镰刀菌菌丝生长(表1),图5-B 显示0.1%壳聚糖酶解产物也能抑制孢子萌发生长速度,但PI 阴性表明0.1%酶解产物并不能破坏孢子的膜通透性,也没能破坏萌发菌丝的膜通透性。上文提及,质子化壳聚糖不可逆的结合到孢子表面,抑制孢子萌发,而对于已萌发的菌丝,没有酶解产物的结合,未观察到对菌丝的破坏。为探究该酶解产物对菌丝的作用,采用扫描电镜观察1.0%壳聚糖酶解产物对菌丝的影响,结果显示壳聚糖酶解产物处理过的菌丝,菌丝边界不清,部分菌丝融合成一片(图6-A),表面褶皱、凹凸不平,菌丝断裂,末端出现囊泡等畸形(图6-B、C)。
3 讨论
壳聚糖分子量与抑菌活性显著相关[17],但是活性最强的分子量范围,仍存在争议。酶解法降解壳聚糖具有高效、无污染、低成本等优势[27],本研究采用自制壳聚糖酶进行酶解,以降低市售壳聚糖分子量,结果发现,随着酶解进行,酶解产物的抑菌活性呈现先升高后降低的趋势。理论上,随着酶解的进行,分子量逐渐降低,说明并非分子量越低,酶解产物对病原真菌的抑制活性越强,而是在酶解6 h 发生了转折,这与杨冬芝等[28]的研究相似。杨冬芝等[28]关于壳聚糖的研究发现,随着分子量的增加,抗菌活性先增强后降低,也出

图6 1.0%壳聚糖6 h 酶解产物对西瓜专化型尖孢镰刀菌真菌菌丝的影响Fig.6 The effect of chitosan hydrolysates at 6 hours (1.0%) to the F. oxysporum hypha
现了一个分子量的拐点,但是抑菌活性差异并不显著。而本试验与之不同的是酶解6 h 的壳聚糖酶解产物,对真菌的抑制活性较其他酶解时间的酶解产物差异显著(P<0.05),除分子量的差异外,这个显著差异也可能是源于壳聚糖酶解产物未经纯化,其组成为分子量不同的壳聚糖,成分复杂,对真菌的抑制作用为多种成分协同作用。
本研究进行酶解反应的pH 值为4.7,无需进一步调节,后处理简单。进一步研究发现,酶解产物能长期抑制孢子萌发和菌丝生长,壳聚糖酶解产物处理过的菌丝发生断裂,产生末端囊泡等畸变,初步证实壳聚糖酶解产物能明显抑制病原真菌。此外,本研究还对壳聚糖酶解产物抑制真菌性质进行了初步探讨,相较于纯品壳聚糖,酶解0.5~12 h 产物对试验病原菌的抑制活性均显著提高,后续研究会深入探讨该酶解产物与市售各种分子量的壳聚糖在抑菌活性上是否存在差异,以促进该酶解产物作为生物防腐保鲜剂的发展。
4 结论
本试验使用自制的壳聚糖酶来酶解壳聚糖,其中酶解6 h 的产物对3 种病原真菌(棉花黄萎病菌、苹果轮纹病菌、西瓜专化型尖孢镰刀菌)的最低抑菌活性较未酶解壳聚糖提高了4~8 倍,在pH 值4.0 ~4.7 时西瓜专化型尖孢镰刀菌抑菌活性最显著;同时,酶解6 h 的壳聚糖产物能导致西瓜专化型尖孢镰刀菌真菌菌丝发生形态变化,造成菌丝断裂、褶皱、菌丝末端囊泡等畸形生长,并长期抑制孢子生长和菌丝伸长,从而有效抑制真菌生长。

