中药千金黄连丸的抗动脉粥样硬化作用
李静,陈泫锦,佘成烨,邓远雄*(1. 湖南师范大学“小分子靶向药物研究与创制”湖南省重点实验室,长沙 410013:2. 湖南师范大学“化学生物学及中药分析”教育部重点实验室,长沙 410081:3. 湖南师范大学医学院药学系,长沙 410013)
动脉粥样硬化是冠心病、脑梗死等心脑血管疾病的主要病因之一,其发病机制复杂,主要危险因素有高血脂、糖尿病、高血压和肥胖等。动脉粥样硬化的药物治疗包括降脂药物、抗凝溶栓药物、抗血小板药物等,这些西药如他汀类药物具有一定的不良反应,如转氨酶、肌酸激酶升高和肌无力等[1-2]。因此,有必要寻找替代治疗方法来避免其不良反应。在替代治疗中,中药治疗是一种很好的方法。中药特别是复方中药具有多成分、多靶点、多效应的特点,且毒性低、不良反应少[3]。
千金黄连丸(QHW,又名黄连丸)是古代中医名著《千金要方》中首次记载的中药方剂,由黄连(Coptis chinensisFranch)和生地黄(Rehmannia glutinosa(Gaertn)Libosch)组成,含有梓醇、地黄苷A、地黄苷D 等环烯醚萜类成分以及小檗碱、黄连碱、药根碱、巴马汀等生物碱类成分。临床研究表明,QHW 能通过降低血糖治疗糖尿病[4]。实验研究表明QHW 显著降低2 型糖尿病小鼠的血糖水平,改善胰岛素抵抗[5-7],显著改善2 型糖尿病大鼠的脂质代谢[8]。糖尿病和高血脂是动脉粥样硬化的主要危险因素之一,QHW 可能通过调节血糖水平和脂质代谢而有利于发挥抗动脉粥样硬化作用。笔者采用给大鼠喂食高胆固醇饮食及给与过量的维生素D2(VD2)的方法诱导动脉粥样硬化大鼠模型来研究QHW 的抗动脉粥样硬化作用,然后从QHW 对泡沫细胞形成的影响来探讨其抗动脉粥样硬化作用的初步机制。
1 材料
1.1 实验动物
50 只雄性SD 大鼠(180±20)g[湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)2019-0004]。C57BL/6J 小鼠,雄性,体质量(20±4)g [上海西普尔-必凯实验动物中心,动物许可证号:SCXK(沪)2020-0002]。将大鼠饲养在恒温(25±1)℃和恒湿(55±5)%、12 h 明暗交替、可以自由饮水的SPF 级动物房中。所有动物于实验开始前12 h 禁食,期间可以自由饮水。
1.2 仪器
Agilent 1260 高效液相色谱仪,包括四元梯度泵、进样器、柱温箱和检测器以及Agilent Lab Advisor 色谱工作站。离心机(Thermo Scientific Sorvall Sratos,德国)。超纯水机(Milli-Q Gradient A 10,Milli-pore Inc.,美国)。
1.3 试药
黄连和生地(长沙老百姓大药房),经湖南师范大学药学系牟玲丽教授鉴定为正品。辛伐他汀(10 mg,上海信谊万象药业有限公司)。小檗碱(纯度>98.0%,HPLC)和梓醇(纯度>98.0%,HPLC)(对照品,中国食品药品检定研究院)。胆固醇(纯度>98.0%,上海源叶生物技术有限公司)。磷酸二氢钠、磷酸和 1-庚烷磺酸钠(分析纯,长沙天恒化学试剂仪器有限公司)。乙腈(色谱级,美国Tedia Co)。人血浆低密度脂蛋白(LDL,美国Sigma-Aldrich 公司)。三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)试剂盒(南京建成生物工程研究所)。高胆固醇饲料(HCD)由标准饲料(92.6%),胆固醇(2%),猪油(5%),胆酸(0.2%)和丙基硫氧嘧啶(0.2%)组成。
1.4 QHW 提取物的制备
将黄连50 g、生地50 g 组成的药材切碎混合,用沸水(1∶10 然后1∶5,w/v)回流1 h,并收集滤液。合并滤液并真空干燥获得29.6 g QHW 提取物,HPLC 法[7]测得QHW 提取物中小檗碱和梓醇的含量分别为 3.6%和 1.29%。当QHW 提取物用于动物实验或细胞实验时,剂量用小檗碱进行定量,使用前将提取物悬浮于0.25%的羧甲基纤维素溶液中。
2 方法
2.1 动物实验
SD 雄性大鼠50 只,参考文献方法使用大剂量维生素D 加高胆固醇饲料法诱导动脉粥样硬化大鼠模型[9]。将50 只大鼠随机分为5 组[正常对照组(NCG)、动脉粥样硬化模型组(AMG)、低剂量QHW 提取物治疗组(AML)、高剂量QHW 提取物治疗组(AMH)和辛伐他汀治疗组(AMS)],每组10 只。低、高剂量QHW 提取物的剂量分别为0.92 和1.94 g/(kg·d)[相当于小檗碱33 和70 mg/(kg·d)]。除正常对照组大鼠外,其余所有大鼠连续3 d 口服维生素D230 000 IU/(kg·d),期间给予标准饲料。同时,给予相应组的大鼠灌胃QHW 提取物或辛伐他汀[Sim,4 mg/(kg·d)]。从第4日起,除正常对照组外,其他组大鼠饲喂高胆固醇饲料6 周,相应组大鼠连续给予QHW 或Sim。正常对照组大鼠一直饲喂常规饲料。
2.2 生化指标
2.2.1 血清中脂质的测定 在实验结束时,通过眶后神经丛从隔夜禁食的大鼠中收集血样,测定TC、LDL-C、HDL-C、TG 水平。抗动脉粥样硬化指数(AAI)通过以下公式计算:AAI =HDL-C/(TC-HDL-C)。
2.2.2 肝脏中脂质的测定 取肝组织,冰生理盐水冲洗、滤纸吸湿后称取湿重0.3 g 左右,加入预冷的生理盐水制成10%肝匀浆,4 ℃、4000 r·min-1离心10 min,提取上清液,采用酶法测定TC、TG 含量。
2.3 形态学实验
动物实验结束时,处死所有大鼠,收集血清备用;收集主动脉弓,固定于Bouin 氏液中,脱水,石蜡包埋,切成5 mm 的薄片,用苏木精-伊红(HE)染色,进行动脉粥样硬化评分[9]。评分时,重点关注层间空间中泡沫细胞的积累、内侧弹性层的直裂、胶原纤维的丰富、脂质钙核周围的增殖和定向障碍平滑肌细胞。此外,根据脂滴和坏死变化将肝损伤的严重程度定义为重、中、轻度三个等级。
2.4 LDL 的氧化
LDL(0.5 g·L-1)用磷酸盐缓冲液(PBS,pH 7.4,0.01 mol·L-1)透析以去除 EDTA。将 CuSO4以20 μmol·L-1的终浓度添加到上述LDL 中,37℃放置 20 h。LDL 的氧化通过特征颜色从金色变为黄色到半透明无色来指示。通过在4℃下对含有 0.5 μmol·L-1EDTA 的PBS 透析24 h 来停止氧化。最后,采用超滤去除溶液中的细菌。通过测量硫代巴比妥酸反应性物质(TBARS)来测定其氧化程度。
2.5 泡沫细胞的诱导[10-11]
从C57BL/6J 小鼠中收集小鼠巨噬细胞,细胞以15×109/瓶(50 mL)的密度培养,在10%胎牛血清的RPMI 1640 中,5%CO2条件下培养12 h。然后将巨噬细胞与氧化性低密度脂蛋白(ox-LDL)一起培养以诱导泡沫细胞。
采用高效液相色谱法测定细胞TC 含量和游离胆固醇(FC)水平,并采用Lowry 法测定蛋白质[12]。并且胆固醇酯(CE)水平根据以下公式计算:CE =TC-FC。当细胞 CE/TC 大于 50% 时,细胞被认为变成泡沫细胞[13]。ox-LDL 的浓度和将巨噬细胞转化为泡沫细胞的培养时间根据文献报道确定[14]。ox-LDL 的浓度确定为 20 mg·L-1,培养时间确定为 72 h。
2.6 高效液相色谱法测定细胞脂质
用PBS 漂洗细胞3 次, 加入0.9% NaOH溶液超声裂解,得到细胞裂解液。将0.1 mL 5 mol·L-1NaOH 溶液加入到0.1 mL 细胞裂解液中,并在50℃下孵育1 h,使胆固醇酯转化为游离胆固醇,得到用于测定TC 的样品A。将0.1 mL 5 mol·L-1NaOH 溶液加入到0.1 mL 细胞裂解液中并在室温下保持2 min,得到用于测定TC 的样品B。将 6% 三氯乙酸(TCA)溶液加入样品 A 或B 中以去除蛋白质,加入正己烷和异丙醇(4∶1,V/V)混合物,以 1500 r·min-1离心5 min 后涡旋 5 min。收集上清液,真空干燥处理,残留物用甲醇溶解。取20 μL 溶液根据课题组前期建立的HPLC 法[14]测定细胞TC 含量和FC 含量。
2.7 QHW 提取物对泡沫细胞形成的影响
巨噬细胞分为正常对照组(NMG)、模型组(FMG)、低(FGL,1.0×10-7mol·L-1)、中(FGM,1.0×10-6mol·L-1)、高(FGH,1.0×10-5mol·L-1)剂量QHW 提取物处理组,阳性药物组(辛伐他汀1.0×10-6mol·L-1,FGS),一共6 组。除正常对照组外,所有细胞均用ox-LDL(20 mg·L-1)处理72 h。所有细胞用 PBS 冲洗3 次,给予对应药物共培养24 h 后,收集各组细胞,超声裂解,测定胆固醇含量(TC 和FC)。
2.8 含药血清对泡沫细胞形成的影响
将巨噬细胞分为正常对照组、模型组、QHW高剂量含药血清处理组,辛伐他汀血清处理组。除正常对照组外,所有细胞均用ox-LDL(20 mg·L-1)处理72 h。所有细胞用 PBS 冲洗 3 次。换新鲜培养液,其中含药血清处理组以“2.3”项下QHW 含药血清代替胎牛血清加入RPMI 1640培养基(含血清10%)。泡沫细胞辛伐他汀血清处理组(FMS)以“2.3”项下辛伐他汀血清代替胎牛血清加入RPMI 1640 培养基。正常对照组和模型组加入等体积PBS。共培养结束后,收集各组细胞,超声裂解,测定胆固醇含量(TC 和FC)。
2.9 统计分析
所有数据均表示为平均值和标准偏差。数据统计分析采用单因素方差分析(one-way ANOVA),P<0.05 为差异具有统计学意义。
3 结果
3.1 QHW 提取物对动脉粥样硬化大鼠血脂及肝脏脂质的影响
QHW 提取物对实验大鼠血脂的影响见表1。与正常对照组相比,模型组血清TC、LDL-C 水平升高,HDL-C 水平下降(P<0.01),表明动脉粥样硬化模型诱导成功。QHW 提取物处理后,血脂情况明显得到了改善。与模型组比较,低、中、高剂量QHW 提取物治疗组(AMH)的TC、TG、LDL-C水平显著下降(P<0.01)。高剂量QHW 提取物治疗组的HDL-C 水平显著升高(P<0.01)。抗动脉粥样硬化指数(AAI)结果显示低剂量和高剂量的QHW 提取物对AAI 都有显著影响(P<0.01)。

表1 QHW 提取物对动脉粥样硬化大鼠血脂及AAI 的影响Tab 1 Effect of QHW extract on the serum lipids and AAI of atherosclerotic rats
QHW 提取物对动脉粥样硬化大鼠肝脏脂质的影响见表2。与正常组相比,模型组肝脏TC、TG水平显著升高。QHW 提取物处理后,肝脏脂质明显得到了改善。与模型组比较,高剂量QHW 提取物治疗组、阳性对照组的肝脏脂质TC 和TG 水平均显著改善(P<0.01)。

表2 QHW 提取物对动脉粥样硬化大鼠肝脏脂质的影响Tab 2 Effect of QHW extract on the liver lipids of atherosclerotic rats
3.2 QHW 提取物对动脉粥样硬化大鼠的形态学影响
3.2.1 主动脉病变的改变 光镜下,正常对照组大鼠未见明显主动脉病变(见图1A),而在动脉粥样硬化模型大鼠中,发现了显著的动脉粥样硬化特征,例如内膜增厚、层间间隙中泡沫细胞增多、内侧弹性层的破裂、胶原纤维丰富、脂质钙核周围的平滑肌增生以及平滑肌细胞方向杂乱(见图1B)。QHW 提取物处理后,发现内膜完整,无脂质沉积、泡沫细胞,无平滑肌增生,细胞外基质无增加,中膜无钙化(见图1C),可以看出,经大剂量QHW 提取物治疗后血管壁中钙核和泡沫细胞消失。并且还发现阳性对照辛伐他汀对动脉粥样硬化大鼠产生相似的作用(见图1D)。动脉粥样硬化评分见图2,与模型组相比,中、高剂量QHW 提取物治疗组的动脉粥样硬化评分均明显降低,表明高剂量QHW 提取物和辛伐他汀均能有效改善大鼠实验性动脉粥样硬化。

图1 动脉粥样硬化大鼠主动脉形态结构(HE 染色,400×)Fig 1 Morphological structure of aorta in atherosclerotic rats(HE staining,400×)

图2 QHW 提取物对动脉粥样硬化大鼠病理评分的影响。Fig 2 Effect of QHW extract on the pathological scores of atherosclerotic rats.
3.2.2 肝脏病变及肝脏指数 HE 染色病理切片显示正常对照组(NCG)肝脏未见异常(见图3A),模型组大鼠肝脏有严重的脂滴和细胞凋亡变化(见图3B),高剂量QHW 提取物治疗后,这些病变略有减轻(见图3C)。阳性对照药辛伐他汀对动脉粥样硬化大鼠产生相似的作用(见图3D)。通过分析肝脏指数,进一步发现 QHW 提取物对动脉粥样硬化大鼠肝脏的影响。与正常对照组相比,模型组的肝脏指数显著升高,而高、低剂量QHW 提取物治疗组的肝脏指数明显降低,说明高低剂量组的QHW 提取物治疗显著改善了动脉粥样硬化大鼠的肝损害。与模型组相比,阳性药物组的肝脏指数也明显降低,表明辛伐他汀对动脉粥样硬化大鼠表现出相似的作用(见图4)。
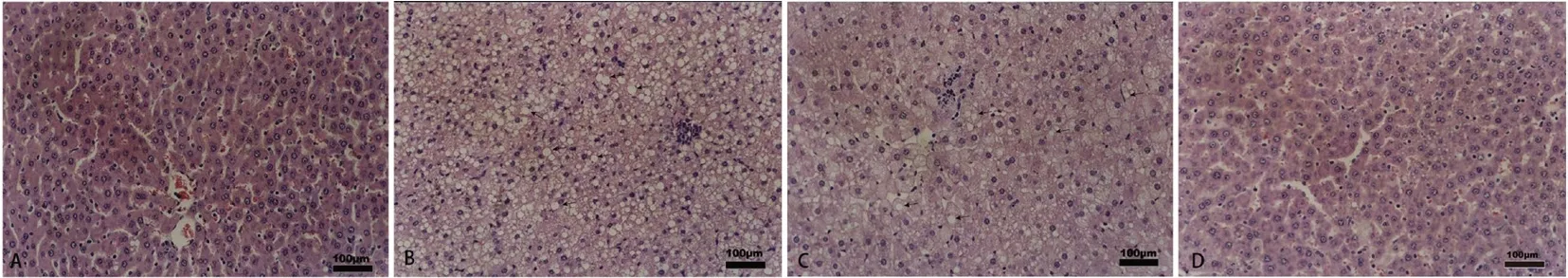
图3 动脉粥样硬化大鼠肝脏形态结构(HE 染色,200×)Fig 3 Morphological structure of liver in atherosclerotic rats(HE staining,200×)

图4 QHP 提取物对动脉粥样硬化大鼠肝脏指数的影响。Fig 4 Effect of QHP extract on the liver index of atherosclerotic rats.
3.3 QHW 提取物对泡沫细胞形成的影响
如表3 所示,当巨噬细胞与ox-LDL(20 mg·L-1)一起孵育72 h 时,细胞转化为泡沫细胞,模型组的CE/TC 为67.3%。当细胞与 QHW提取物共培养时,巨噬细胞中的胆固醇酯含量明显降低(P<0.01),脂质沉积减少。QHW 提取物对泡沫细胞中胆固醇酯含量的影响呈剂量依赖性。尤其是高剂量组的CE/TC 下降至51.4%,几乎接近巨噬细胞转变为泡沫细胞的临界点。表明QHW 提取物和辛伐他汀均能改善泡沫细胞中的胆固醇酯含量,抑制泡沫细胞的形成。
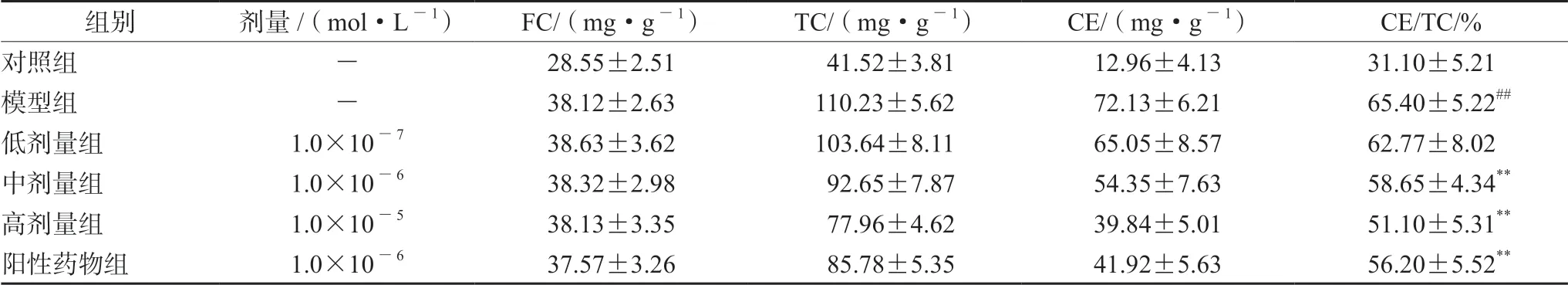
表3 QHP 提取物对巨噬细胞源性泡沫细胞的影响Tab 3 Effect of QHP extract on the foam cell derived from macrophage
3.4 含药血清对泡沫细胞形成的影响
如表4 所示,当巨噬细胞与ox-LDL(20 mg·L-1)一起孵育72 h 时,细胞转化为泡沫细胞,CE/TC 为67.3%(FMG 组)。当泡沫细胞与QHW 含药血清共培养时,细胞中的胆固醇酯含量明显降低(P<0.01),CE/TC 为48.7%,已经非泡沫细胞(泡沫细胞的判断标准是CE/TC 超过50%)。同时,阳性药物组的CE/TC 降低到52.2%。表明QHW 含药血清和辛伐他汀含药血清均能显著降低泡沫细胞中的胆固醇酯含量,抑制泡沫细胞的形成。

表4 QHP 含药血清对巨噬细胞源性泡沫细胞的影响Tab 4 Effect of rats serum treated with QHP extract on the foam cell derived from macrophage
4 讨论
千金黄连丸(QHW)由黄连与生地组成,黄连为君药,生地为臣药,两者相须为用,发挥滋阴清热的功效,主治消渴(糖尿病)。目前其主要用于治疗2 型糖尿病及其并发症。2 型糖尿病与动脉粥样硬化及其并发症(如心肌梗塞和外周血管疾病)的发生风险增加密切相关[15-16]。研究QHW 的抗动脉粥样硬化作用可以为扩大QHW的临床适应症范围提供实验依据。
本文采用大鼠动脉粥样硬化模型研究了QHW提取物的抗动脉粥样硬化作用。与模型组大鼠相比,在用低剂量或高剂量 QHW 提取物处理组的大鼠主动脉中很少发现典型的动脉粥样硬化的形态学改变,如内膜增厚、泡沫细胞形成、内膜脂质沉积和中膜钙化。尤其是作为动脉粥样硬化大鼠主动脉壁的特征之一,泡沫细胞在QHW 治疗后全部消失。因此推测QHW 提取物可能通过抑制泡沫细胞的形成而发挥抗动脉粥样硬化作用,抑制泡沫细胞的形成可能是QHW 抗动脉粥样硬化的机制和靶点之一。
在动脉粥样硬化病变中,来源于巨噬细胞的泡沫细胞是早期损伤的特征细胞和最早的病理细胞,其形成与ox-LDL 及其他修饰的低密度脂蛋白有关[12]。巨噬细胞清道夫受体(SR)如 SR-A和 CD36 发挥ox-LDL 的内化作用,并促进巨噬细胞中胆固醇的积聚以形成泡沫细胞[17-18]。巨噬细胞来源的泡沫细胞在内皮下的积累在动脉粥样硬化的发生和发展中起着非常重要的作用。
为此,本研究采用ox-LDL 诱导的泡沫细胞模型研究QHW 抗动脉粥样硬化的初步机制。泡沫细胞经低剂量或高剂量QHW 提取物处理后,其胆固醇酯含量都显著降低,泡沫细胞特征改善。含药血清对泡沫细胞作用和QHW 提取物对泡沫细胞的作用相似,而且含药血清对泡沫细胞的效果更好,甚至能将泡沫细胞逆转。QHW 由黄连和生地组成,黄连中含有黄连素(小檗碱)。研究表明,小檗碱可以通过激活 AMPK-SIRT1-PPAR-γ通路和减少 ox-LDL 的摄取来抑制泡沫细胞的形成[19]。Lee 等[20]报道小檗碱通过增强 LXRa-ABCA1 依赖性胆固醇流出显著抑制ox-LDL 介导的脂质积累和泡沫细胞的形成。然而,Guan 等[12]报道小檗碱可以通过抑制LOX-1 的表达和促进巨噬细胞来源的泡沫细胞中SR-BI 的表达来抑制泡沫细胞的形成,而对 SR-A 或ABCA1 表达没有影响。此外,Yang 等[17]证明小檗碱通过抑制AP-1 活性和激活 Nrf2/HO-1 通路来降低巨噬细胞泡沫细胞中的胆固醇积累。总之,小檗碱可以通过多种分子机制来抑制泡沫细胞的形成,作为QHW 提取物的主要成分之一,小檗碱可能通过抑制泡沫细胞的形成从而发挥抗动脉粥样硬化的作用。
据报道动脉粥样硬化与高脂血症和高胆固醇血症密切相关[21]。本研究中,动脉粥样硬化模型大鼠的TC、LDL-C 和TG 水平显著升高,而HDL-C 水平显著降低,表明动脉粥样硬化的形成与高水平的LDL-C 和TG 有关,高水平的 LDL-C 和低水平的HDL-C 都意味着较差的 AAI,高 LDL-C 和低 HDL-C水平更可能导致动脉粥样硬化。动脉粥样硬化通常是由负载有脂质的巨噬细胞(即泡沫细胞)的积聚引起的[22]。巨噬细胞吞噬过量的脂质,如 ox-LDL(来自 LDL-C),以形成泡沫细胞。因此,可以推测调节血脂有利于防止动脉粥样硬化。在本研究中,低剂量或高剂量的QHW 提取物治疗动脉粥样硬化大鼠后,其TC,LDL-C 和TG 水平明显降低,而HDL-C 水平明显升高。生地黄中所含有的梓醇是一种环烯醚萜类成分,可以通过降低TC、TG 和LDL-C 的水平并提高HDL-C 的水平来减轻动脉粥样硬化病变[23]。此外,黄连中含有的小檗碱也具有调脂作用[24]。因此,QHW 发挥抗动脉粥样硬化作用的另一个机制可能是QHW 中所含的小檗碱和梓醇的调脂作用。
此外,QHW 的调脂作用也有益于对动脉粥样硬化大鼠的肝脏的保护。动脉粥样硬化模型大鼠肝脏出现严重的脂滴和形态结构上的凋亡改变,外观上出现肝肿大。低剂量或高剂量QHW提取物治疗后,肝脏损伤得到改善,形态结构损伤较少,肝脏轻度受损,并表现为大鼠肝指数降低。QHW 处理后动脉粥样硬化大鼠肝脏脂滴和细胞凋亡的改善可能由于QHW 提取物的血脂调节作用。肝脏是机体脂质代谢的主要器官之一,QHW 对动脉粥样硬化大鼠肝脏的保护反过来改善其体内脂质代谢,降低LDL,从而降低泡沫细胞的形成,进一步发挥抗动脉粥样硬化作用。
综上所述,中药QHW 对高胆固醇饮食诱导的动脉粥样硬化大鼠具有显著的抗动脉粥样硬化作用。QHW 具有抑制泡沫细胞形成和调节血脂(降低TC、TG 和LDL-C 水平,升高HDL-C 水平)的作用,可能是通过抑制泡沫细胞的形成和调节血脂发挥抗动脉粥样硬化的作用,但确切的分子机制和靶点有待进一步探索。

