骨内压干预对DH豚鼠退变胫股关节软骨保护作用及软骨内2型胶原与MMP13表达的影响*
王 硕,马剑雄,杜育任,黄洪超,焦尚起,史建国,马信龙△
(1.中国人民解放军天津康复疗养中心/原解放军464医院骨科,天津 300381;2.天津医院骨科研究所 300050)
退行性膝骨关节炎是常见关节退变性疾病,约80%的65岁以上人群患有退行性膝骨关节炎,因关节软骨退变,最终可导致关节功能丧失[1-2]。退行性膝骨关节炎的主要危险因素是年龄,随着人口的老龄化,其发病率迅速升高,带来严重的社会经济问题。生理情况下,软骨细胞及软骨基质维持着关节软骨的稳态;在退行性膝骨关节炎中,关节软骨中的蛋白聚糖被切割,2型胶原也被降解[3-4]。胶原蛋白是一种三螺旋蛋白,对大多数蛋白酶具有抗性,但可被基质金属蛋白酶13(MMP13)有效识别和降解。MMP13在一个独特的位点催化2型胶原的水解,从而产生3/4和1/4长度的多肽产物[5-6]。MMP13属于基质金属蛋白酶(MMPs)家族,是参与细胞外基质(ECM)重塑的锌依赖性内肽酶。骨内高压被认为与退行性膝骨关节炎疼痛相关,主要指骨内血流动力学异常[7]。研究发现,髌骨软骨软化存在膝前痛的患者,其髌骨内压升高。通过穿刺减压或截骨可迅速降低骨内压,缓解疼痛[8]。本研究拟探讨骨内压干预对Dunkin Hartley(DH)豚鼠退变胫股关节软骨的保护作用,以及对关节软骨内2型胶原、MMP13表达的影响,为退变性关节炎的治疗提供理论依据。
1 材料与方法
1.1 材料
1.1.1动物喂养及分组
雄性DH豚鼠6、9、12、18月龄各10只(n=40),由重庆医科大学动物实验中心提供,动物合格证号:SYXK(渝)2019-0011,豚鼠生产许可证号:SYXK(渝)2016-0018。其中,非减压组各月龄5只,减压组各月龄5只。动物饲养环境:温度(22±2)℃,湿度(55±3)%,12 h光照-黑暗循环(光照时间6:00-18:00)。
1.1.2实验仪器与试剂
PT-30陶瓷厚膜压力传感器(美国DJ公司),TRIzol®试剂(美国ThermoFisher Scientific公司),mi Script Ⅱ RT试剂盒(德国Qiagen GmbH公司),SYBR Green PCR Master Mix试剂盒(美国Clontech Laboratories公司),ABI 7500型RT-qPCR仪(美国ThermoFisher Scientific公司),2型胶原、MMP13兔多克隆一抗(美国Sigma公司),MaxVision TM HRP-聚合物抗鼠/兔IHC试剂盒(美国MaxVision公司),3,3′-二氨基联苯胺四盐酸盐(DAB,上海碧云天生物技术有限公司)。
1.2 方法
1.2.1各组DH豚鼠膝关节骨内压测定
非减压组适应性饲养结束后测定骨内压,减压组减压术后测定骨内压。操作方法:膝关节内侧纵形切口,近端起自股骨内髁,远端至胫骨内髁,逐层切开皮肤、皮下组织,保护膝内侧血管及神经,显露膝内侧副韧带,选择膝关节内侧副韧带股骨远端、胫骨近端附着点为测压穿刺点,逐级穿刺针由内侧向外侧穿刺至抵住对侧骨皮质,测压孔直径为Ø0.7 mm[9],连接PT-30陶瓷厚膜压力传感器,股骨远端、胫骨近端测压完毕后,拔除穿刺针,逐层严密缝合伤口。
1.2.2减压术实施
选择膝关节内侧副韧带股骨远端、胫骨近端附着点为穿刺减压点,使用直径Ø1.5 mm、Ø2.0 mm麻花钻头,由内侧向外侧穿刺扩孔减压,至抵住对侧骨皮质,减压孔直径为Ø2.0 mm,减压后分别于术后4周测压。
1.2.3胫股关节软骨2型胶原、MMP13 mRNA表达的测定
实验期间无DH豚鼠死亡,实验结束后(实验周期为4周),立刻处死DH豚鼠,获取胫股关节软骨;应用TRIzol®分离总RNA,mi Script Ⅱ RT试剂盒逆转录为cDNA,应用SYBR Green PCR Master Mix试剂盒检测mRNA表达水平。反应系统以20 μL的体积进行,热循环条件如下:95 ℃持续10 min,然后40个循环(95 ℃持续10 s,60 ℃持续2 min,72 ℃持续2 min,在72 ℃下延长10 min)。通过实时荧光定量PCR(RT-qPCR)分析目标基因和对照。2型胶原引物正向:5′-ATG ACA GCG GCA CCT ACC T-3′,反向:5′-CCT ATT GTC CCT CGT GCG-3′;MMP13引物正向:5′-ACA CTC CAG CTG GGA TAT AAT ACA ACC TGC TA-3′,反向:5′-CTC AAC TGG TGT CGT GGA GTC GGC AAT TCA GTT GAG CAC TTA GC-3′;GAPDH引物正向:5′-TGT TCG TCA TGG GTG TGA GA-3′,反向:5′-ATG GCA TGG ACT GTG GTC AT-3′;U6引物正向:5′-CTC GCT TCG GCA GCA CA-3′,反向:5′-AAC GCT TCA CGA ATT TGC GT-3′。使用Livak法分析数据,将目的mRNA表达水平相对于GAPDH/U6标准化。所有数据表示为3个独立实验的均值。
1.2.4胫股关节软骨2型胶原、MMP13表达的测定
将脱钙后石蜡包埋的5 μm胫股关节组织切片置于75 ℃烤箱中6 h,逐级脱蜡至水,3%过氧化氢(H2O2)去离子水室温孵育10 min以灭活内源性过氧化物酶活性,之后于0.01 mol/L柠檬酸盐缓冲液(pH=6.0)行抗原热修复。将组织切片分别与抗2型胶原、MMP13的一抗以1∶400的稀释度孵育过夜,之后用MaxVision TM HRP-聚合物抗鼠/兔IHC试剂盒和DAB处理,用0.5%苏木素行轻度核复染。
1.3 统计学处理

2 结 果
2.1 减压与非减压组DH豚鼠胫股关节骨内压比较
6、9、12、18月龄减压组DH豚鼠胫股关节骨内压均明显低于非减压组(P<0.05);且随月龄增长,两组骨内压均先增加后降低,至12月龄时骨内压达到峰值,两组组内不同月龄组胫股关节骨内压存在明显差异(股骨侧:F=12.548、9.875,P<0.001;胫骨侧:F=11.687、9.667,P<0.001),见表1。

表1 两组DH豚鼠胫股关节骨内压比较
2.2 减压与非减压组DH豚鼠胫股关节形态学改变
随时间推移,6、9、12、18月龄豚鼠胫股关节均表现出软骨退变(胫骨近端内外侧缘可见明显流水样软骨样或骨样增生、明显软骨缺损等),但与非减压组相比,减压组退变程度更轻。骨内减压对于退变程度不同的关节软骨均展现了明显的保护作用,见图1。

A、C、E、G:6、9、12、18月龄非减压组DH豚鼠胫股关节;B、D、F、H:6、9、12、18月龄减压组DH豚鼠胫股关节。
2.3 减压与非减压组DH豚鼠胫股关节2型胶原mRNA水平比较
减压组6、9、12、18月龄DH豚鼠胫股关节2型胶原mRNA水平均明显高于非减压组(P<0.05);随月龄增长,两组2型胶原mRNA水平逐渐降低,至18月龄时,2型胶原mRNA水平达到最低值,两组组内不同月龄DH豚鼠2型胶原mRNA水平存在明显差异(股骨侧:F=10.657、8.997,P<0.001;胫骨侧:F=8.635、6.694,P<0.001),见表2。

表2 两组DH豚鼠胫股关节2型胶原mRNA水平比较
2.4 减压与非减压组DH豚鼠胫股关节MMP13 mRNA水平比较
减压组6、9、12、18月龄DH豚鼠胫股关节MMP13 mRNA水平均明显低于非减压组(P<0.05);随月龄增长,两组MMP13 mRNA水平逐渐升高,至18月龄时MMP13 mRNA水平达到峰值,两组组内不同月龄DH豚鼠MMP13 mRNA水平存在明显差异(股骨侧:F=9.658、12.698,P<0.001;胫骨侧:F=13.547、10.258,P<0.001),见表3。

表3 两组DH豚鼠胫股关节MMP13 mRNA水平比较
2.5 减压与非减压组DH豚鼠胫股关节2型胶原表达水平比较
减压组6、9、12、18月龄DH豚鼠胫股关节2型胶原表达水平均明显高于非减压组(P<0.05);随月龄增长,两组2型胶原表达水平逐渐降低,至18月龄时,2型胶原表达水平达到最低值,两组组内不同月龄DH豚鼠2型胶原表达水平存在明显差异(股骨侧:F=6.998、12.547,P<0.001;胫骨侧:F=8.992、10.548,P<0.001),见表4、图2~3。

A、C、E、G:6、9、12、18月龄非减压组DH豚鼠胫股关节股骨侧;B、D、F、H:6、9、12、18月龄减压组DH豚鼠胫股关节股骨侧。

表4 两组DH豚鼠胫股关节2型胶原表达水平比较
2.6 减压与非减压组DH豚鼠胫股关节MMP13表达水平比较
减压组6、9、12、18月龄DH豚鼠胫股关节MMP13表达水平均明显低于非减压组(P<0.05);随月龄增长,两组MMP13表达水平逐渐升高,至18月龄时,MMP13表达水平达到峰值,两组组内不同月龄DH豚鼠MMP13表达水平存在明显差异(股骨侧:F=6.878、10.369,P<0.001;胫骨侧:F=10.636、9.635,P<0.001),见表5、图4~5。
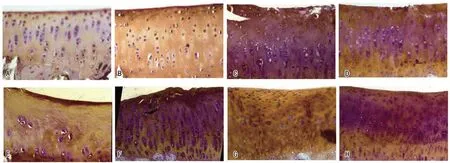
A、C、E、G:6、9、12、18月龄非减压组DH豚鼠胫股关节胫骨侧;B、D、F、H:6、9、12、18月龄减压组DH豚鼠胫股关节胫骨侧。

A、C、E、G:6、9、12、18月龄非减压组DH豚鼠胫股关节股骨侧;B、D、F、H:6、9、12、18月龄减压组DH豚鼠胫股关节股骨侧。

表5 两组DH豚鼠胫股关节MMP13表达水平比较

A、C、E、G:6、9、12、18月龄非减压组DH豚鼠胫股关节胫骨侧;B、D、F、H:6、9、12、18月龄减压组DH豚鼠胫股关节胫骨侧。
3 讨 论
退行性膝骨关节炎的主要特征是软骨损伤、软骨下骨重塑、关节间隙变窄、滑膜炎及关节边缘骨赘形成。无论最初的触发因素如何,关节软骨损伤都是退行性膝骨关节炎的主要病理改变。目前的临床治疗主要包括非甾体类抗炎药(NSAIDs)、关节内注射透明质酸结合物,以及最终的关节置换术等。关节软骨营养补充剂如葡萄糖胺和硫酸软骨素的功效尚存争议,且目前尚无可延迟或逆转与疾病相关的软骨逐渐破坏的治疗方法。由于这些方法不能保护关节软骨或延缓疾病的发展,从而使该病发展为不可逆的ECM丧失和慢性残疾,因此,开发新型治疗手段对保护退行性膝骨关节炎中的关节软骨具有重要意义[10]。
骨内减压的理论基础为病变局部的骨内压增高及血液循环瘀滞,因其可有效缓解退行性膝骨关节炎的静息痛,临床上已应用于股骨头坏死、顽固性跟痛症、冻结肩等疾病的除痛治疗[11]。DH豚鼠膝关节软骨病变最早可见于3月龄,表现为内侧胫骨平台软骨细胞局灶性死亡;6月龄表现为中层甚至深层软骨细胞出现克隆性增殖;9月龄表现为胫骨骨赘、软骨下骨硬化;12月龄表现为整个内侧间室软骨退变。随月龄增长,软骨下骨板及松质骨小梁的厚度及密度逐渐增加,弹性逐渐降低,其髓内空间存在逐渐降低的趋势。在灌注量和流出量不变的情况下,骨内压会逐渐升高,当空间减小超过其对灌注量的缓冲范围时,升高的幅度会显著增加;若软骨下骨增生或塌陷,使髓腔容积进一步减少到某一程度时,骨内血流灌注亦可发生障碍,致使骨内压降低。本研究结果显示,减压组6、9、12、18月龄DH豚鼠胫股关节骨内压均明显低于非减压组;随月龄增长,非减压组、减压组均呈现出先增加后降低的趋势,在12月龄时,骨内压达到峰值。结合DH豚鼠胫股关节形态学改变的大体结果,6、9、12、18月龄DH豚鼠胫股关节均表现了软骨退变,如胫骨近端内外侧边缘可见明显流水样软骨样或骨样增生、明显软骨缺损等,但与非减压组相比,减压组退变程度更轻。骨内减压对于退变程度不同的胫股关节软骨均展现了明显的保护作用。这与上述讨论一致,同时说明,骨内减压能够通过明显降低DH豚鼠胫股关节骨内压,发挥对DH豚鼠退变胫股关节软骨的保护作用。
MMPs是生长发育、伤口愈合和疾病病理生理过程中参与ECM重塑的酶。MMP13在生理pH值环境下调节原纤维胶原蛋白(Ⅰ、Ⅱ和Ⅲ型)和聚集蛋白聚糖7水平。MMP13对胶原蛋白的切割发生在内部螺旋位点,产生1/4和3/4片段,并且在氨基端肽位点发生原纤维解聚[12]。MMP13未在健康成人组织中发现,但在骨关节炎患者的关节液及关节软骨中显著表达。此外,有研究表明,优先抑制MMP13的MMPs抑制剂可阻止骨关节炎中软骨的降解[13]。人类膝退变关节软骨细胞结合MMP13的能力增加,因此其损伤程度增加。膝退变关节软骨中的软骨细胞过表达MMP13,2型胶原是其底物[14]。基于这些发现,MMP13可能是治疗退行性膝骨关节炎的靶点[15-17]。本次研究结果显示,减压组6、9、12、18月龄DH豚鼠胫股关节2型胶原mRNA和蛋白表达水平均明显高于非减压组;随月龄增长,非减压组、减压组呈现出降低趋势,至18月龄时,2型胶原mRNA和蛋白表达水平达到最低值。减压组6、9、12、18月龄DH豚鼠胫股关节MMP13 mRNA和蛋白表达水平均明显低于非减压组;随月龄增长,非减压组、减压组呈现出上升趋势,至18月龄时,MMP13 mRNA和蛋白表达水平达到峰值。以上说明,骨内减压能促进DH豚鼠退变胫股关节软骨2型胶原mRNA和蛋白表达,抑制MMP13 mRNA和蛋白表达。
综上所述,骨内压干预能够明显降低DH豚鼠退行性胫股关节骨内压,对退变关节软骨具有明显的保护作用;其机制与骨内减压后在促进DH豚鼠退变胫股关节软骨2型胶原mRNA和蛋白表达的同时,抑制MMP13 mRNA和蛋白表达相关。

