超声辅助冻融法提取燕麦麸β-葡聚糖
黄玉炎,柴小岩,何桀,张冰琳,项雷文
(福建师范大学福清分校,福建 福清 350300)
燕麦β-葡聚糖是水溶性膳食纤维,具有降血糖、降血脂、降胆固醇、增强免疫力和预防心脑血管疾病等功效[1-4],且其抑菌性能良好[5],还能够有效调节血脂及改善肠道菌群[6]。当前,燕麦β-葡聚糖已作为天然多糖加入到食品中,在一定程度上可改善食品的风味[7-9]。与其他来源的β-葡聚糖相比,燕麦β-葡聚糖具有更好的水溶性、皮肤渗透性以及较强的吸附小分子的能力[10]。
目前关于燕麦β-葡聚糖的提取方法主要有水提法[11]、发酵法[12]、酶解法[13]、冻融法[14]、双向发酵法[15]等,但是水提法提取率比较低;碱提法虽然提取率大大提高,但产品纯度较低;酶解法因醇沉会消耗大量的乙醇而成本高;冻融法所得产品纯度高,但得率低。鉴于燕麦β-葡聚糖在食品中的广泛应用,急需一种高得率、高纯度的燕麦麸提取方法。
本文将超声辅助提取技术应用于燕麦麸β-葡聚糖提取过程,有望提高燕麦麸β-葡聚糖的得率和纯度,并在一定程度上改善燕麦麸β-葡聚糖的持水性和黏度。
1 材料与方法
1.1 材料与仪器
燕麦麸:厦门格林贝尔生物科技有限公司;燕麦β-葡聚糖标准品、刚果红:Aladdin公司;海藻酸钠、阿拉伯胶、卡拉胶、黄原胶、瓜尔胶(食品级):山东省滕州市香凝生物工程有限公司。
KQ500DB型数控超声波清洗器:昆山市超声仪器有限公司;PHS-3E数字酸度计:上海仪电科学仪器股份有限公司;L-550低速大容量离心机:山东济南来宝医疗器械有限公司;RE-100旋转蒸发仪:WIGGENS labortechnik GmbH;TFDXO.25真空冷冻干燥机:山东烟台中孚冷链设备有限公司;UV754紫外分光光度计:上海佑科仪器仪表有限公司;NDJ-8S黏度计:福建化玻科教仪器有限公司;Nicolet 380傅里叶变换红外光谱仪:Thermo Fisher Scientific公司。
1.2 试验方法
1.2.1 超声辅助冻融法提取燕麦麸中的β-葡聚糖
取一定量的105℃烘干至恒重的燕麦麸粉,将燕麦麸粉与水分别按 1 ∶10、1 ∶15、1 ∶20、1 ∶25、1 ∶30(g/mL)的比例混合,将混合溶液分别在超声功率为500 W,温度 45、50、55、60、65 ℃下超声辅助提取 30、40、50、60、70 min(为避免温度波动,超声5 min后需暂停5 min再继续超声,超声辅助提取30 min的超声总时间为15 min,依次类推),提取两次合并上清液,静置12 h后,经3 500 r/min离心20 min后取上清液,将上清液在100 r/min、45℃蒸发浓缩至体积的4%,先将浓缩液在-18℃冷冻24 h,而后将浓缩液置于4℃解冻12 h,再将解冻液通过G2砂芯漏斗过滤,收集絮状凝胶加水复溶,重复冻融操作,最后将絮状凝胶冷冻干燥,得到燕麦麸β-葡聚糖。
参照文献采用苯酚-硫酸法[16]测定多糖含量,绘制燕麦麸β-葡聚糖标准曲线为y=0.011 0x+0.006 4,相关系数 R2=0.996 2,线性范围在 0~25 μg/mL,并计算燕麦麸β-葡聚糖的得率和纯度。

1.2.2 燕麦麸β-葡聚糖的结构表征
紫外光谱分析:称取0.1 g的燕麦麸β-葡聚糖样品,加入20 mL蒸馏水使其彻底溶解后,用紫外分光光度计在190 nm~400 nm范围内进行扫描。
红外光谱分析:将燕麦麸β-葡聚糖于105℃烘5 h。冷却至25℃后与研细的KBr混合均匀,压片,并于红外光谱仪上采集红外光谱,波数范围为4 000 cm-1~400 cm-1。
1.2.3 燕麦麸β-葡聚糖持水性的测定
参考段中华等[17]的方法。称取0.1 g燕麦麸β-葡聚糖样品,转移至离心管中,加入10 mL蒸馏水,振荡10 min,25℃下静置24 h后,在3000r/min离心30min,分离得到沉淀,在25℃下静置1 h后称重(W1),再将沉淀冻干称重(W2),按下述公式计算持水率。

式中:X为燕麦麸β-葡聚糖持水的持水率,%;W1为吸水后质量,g;W2为冻干后质量,g。
1.2.4 燕麦麸中β-葡聚糖和几种常见食品胶体复配后表观黏度的变化
参考董兴叶[18]的方法。分别配制0.1%燕麦麸β-葡聚糖样品、海藻酸钠、阿拉伯胶、卡拉胶、黄原胶及瓜尔胶,采用NDJ-8S黏度计先测定这些溶液的表观黏度,再测定燕麦麸β-葡聚糖样品与这几种常见食品胶体以不同比例复配后的表观黏度,并进行对比分析。测定过程选用1号转子,转速为60 r/min。
1.3 数据处理
采用excel和Design Expert 8.05处理软件对试验数据进行统计分析。
2 结果与分析
2.1 燕麦麸中β-葡聚糖提取纯度及得率
2.1.1 料液比对燕麦麸中β-葡聚糖提取得率的影响
料液比对燕麦麸中β-葡聚糖提取得率的影响如图1所示。
从图 1 可以看出,在料液比 1∶10(g/mL)~1∶20(g/mL)时,燕麦麸中β-葡聚糖提取得率随着料液比的减少而增加;在料液比 1∶20(g/mL)~1∶30(g/mL)时,燕麦麸中β-葡聚糖提取得率变化不大。这可能是因为提取液较少时,燕麦麸中β-葡聚糖未能充分溶解;当提取液达到一定比例时,燕麦麸中β-葡聚糖会充分溶出;考虑到后续提取液的浓缩操作,料液比范围确定在1∶15(g/mL)~1∶25(g/mL)之间。

图1 料液比对燕麦麸中β-葡聚糖提取得率的影响Fig.1 Effect of solid-liquid ratio on extraction yield of β-glucan from oat bran
2.1.2 超声提取温度对燕麦麸中β-葡聚糖提取得率的影响
超声提取温度对燕麦麸中β-葡聚糖提取得率的影响如图2所示。

图2 提取温度对燕麦麸中β-葡聚糖提取得率的影响Fig.2 Effect of extract temperature on extraction yield of βglucan from oat bran
从图2可以看出,超声提取温度在45℃~65℃时,燕麦麸中β-葡聚糖提取得率随着超声提取温度升高而增加。但随着超声提取温度的升高,提取液的颜色也随之加深,这可能是因为温度越高,提取液中的物质会发生反应,尤其是美拉德反应,这会给后续分离操作带来困难。因此考虑到后续操作,超声提取温度范围确定在45℃~55℃之间。
2.1.3 超声时间对燕麦麸中β-葡聚糖提取得率的影响
超声提取时间对燕麦麸中β-葡聚糖提取得率的影响如图3所示。
从图3可以看出,超声提取时间在30 min~70 min时,燕麦麸中β-葡聚糖提取得率随着超声提取时间延长而增加。但随着超声提取时间的延长,长时间的超声会使提取温度上升,提取液的颜色也会加深。因此考虑到后续操作,超声提取时间范围确定在50 min~70 min之间。

图3 提取时间对燕麦麸中β-葡聚糖提取得率的影响Fig.3 Effect of extract time on extraction yield of β-glucan from oat bran
2.1.4 正交试验优化
根据单因素试验结果可得各因素的最佳水平,然后按L9(34)正交试验因素水平表,进行正交试验,通过对正交试验结果分析可以得到提取工艺的最优组合。因素水平表见表1,正交试验结果见表2。

表1 正交试验因素和水平Table 1The factors and levels of L9(34)orthogonal experimental

表2 L9(34)正交试验结果Table 2The results of L9(34)orthogonal experimental
从表2可以看出,因素影响主次顺序为A>B>C,即料液比对β-葡聚糖提取得率影响最大,提取时间几乎没有影响;正交试验优化后最佳组合为A2B3C1或A2B3C3,且A2B3C1正好在表2中出现,提取时间较短,因此,最优组合取 A2B3C1,即料液比为 1 ∶20(g/mL)、提取温度为55℃、提取时间为50 min,在最优条件下,得率为6.0%。
对提取的β-葡聚糖样品进行纯度分析,采用超声辅助冻融法提取燕麦麸中β-葡聚糖,其提取纯度为82.3%,得率为6.0%;吴佳等[14]从燕麦粉中提取β-葡聚糖的纯度为92.0%,但得率仅为1.5%。可以看出,冻融法提取所得的β-葡聚糖样品纯度均较高,但得率较低,而采用超声辅助提取β-葡聚糖样品时,得率可增加3倍。因此,超声辅助提取结合冻融法精制,燕麦中β-葡聚糖提取样品纯度较高,得率也高。
2.2 β-葡聚糖样品紫外光谱分析
一定浓度的标准燕麦β-葡聚糖和燕麦麸提取的β-葡聚糖样品溶液在190 nm~400 nm范围扫描的紫外光谱如图4所示。

图4 标准燕麦β-葡聚糖和燕麦麸β-葡聚糖紫外光谱图Fig.4 Ultraviolet spectrum of standard oat β-glucan and oat bran β-glucan
由图4可知,β-葡聚糖提取样品和标准品紫外光谱基本一致。该β-葡聚糖组分的最大吸收峰出现在200 nm,该波长处的吸收峰为糖类物质的特征吸收峰。紫外扫描图谱可知,280 nm和260 nm均没有出现吸收峰,这说明从燕麦麸中提取的β-葡聚糖样品中不含蛋白质和核酸。
2.3 β-葡聚糖样品红外光谱分析
标准燕麦β-葡聚糖和从燕麦麸中提取的β-葡聚糖样品的红外光谱图谱如图5所示。
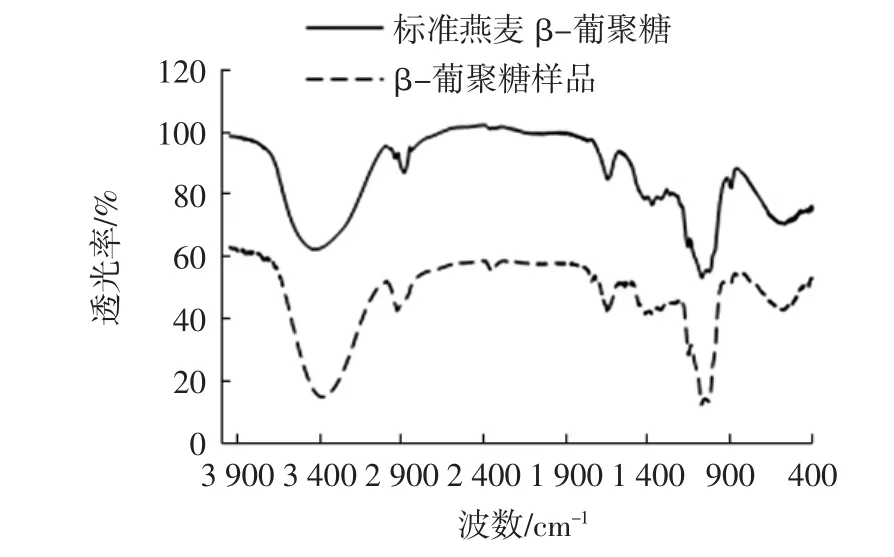
图5 标准燕麦β-葡聚糖和燕麦麸β-葡聚糖红外光谱图Fig.5 The infrared spectrum of standard oat β-glucan and oat bran β-glucan
由图5可知,燕麦麸提取的β-葡聚糖的红外光谱图与标准燕麦β-葡聚糖的红外光谱图没有显著差异。两种β-葡聚糖均在3 400 cm-1附近出现吸收峰,该峰是糖类分子或分子间的O-H键伸缩振动产生的,该峰表明在分子内及分子间有氢键的存在,而1 050 cm-1附近出现的吸收峰则是由O-H键变角振动产生的;而在2 900 cm-1和1 380 cm-1附近出现的两个吸收峰分别是次甲基中C-H键的伸缩振动和变角振动产生的;1 650 cm-1附近出现的吸收峰则可能是-CHO中的C=O键产生的;1 400 cm-1附近的吸收峰则C-H键变角振动产生的;1 070 cm-1和1 160 cm-1附近出现的两个吸收峰则可能是由于β-葡聚糖中具有不同数目的1,3-糖苷键和1,4-糖苷键而形成不同的C-O-C键振动产生的;而900 cm-1附近出现的吸收峰则表明两种β-葡聚糖是由β-D-吡喃型葡萄糖组成的,且该峰是由该糖中C-H键振动产生的。
2.4 燕麦麸中提取的β-葡聚糖的持水率
超声辅助冻融法提取的燕麦麸β-葡聚糖的持水率307.6%,其持水率较高,这可能是由于超声辅助提取过程能够影响β-葡聚糖的网状结构,使其形成较大的空隙,有利于其吸收水分子,从而增大持水率,关于其空间结构,可以对其进行电镜扫描以进一步鉴定。蓝高爽[19]在对玉米多糖进行分析时,得到了类似的结论,其结果表明,超声提取的玉米多糖形成了较大的空隙,这种结构有利于吸收及贮存水分子。另外,涂宗财等[20]在超声辅助提取荷叶多糖的研究中表明,超声提取过程所需时间较短,且在中性条件下提取,这有利于在提取过程中保护多糖分子免受损伤,分子量较大,从而比较容易与水分子结合,增大持水率。
2.5 燕麦麸中β-葡聚糖提取样品表观黏度
燕麦麸中β-葡聚糖提取样品与几种常见食用胶体表观黏度见表3。
由表3可知,0.1%浓度的β-葡聚糖的表观黏度与瓜尔胶较相似,在较低的浓度下具有较高的表观黏度。说明燕麦麸β-葡聚糖具有很好的增稠和稳定效果。将0.1%β-葡聚糖与相同浓度的阿拉伯胶、卡拉胶、黄原胶、海藻酸钠、瓜尔胶以不同的体积比混合均匀,在25℃的条件下测定表观黏度,结果见表4。

表3 燕麦麸β-葡聚糖样品与不同食品胶体的表观黏度性质比较Table 3 Comparative apparent viscosity property of different food gum and oat bran β-glucan

表4 β-葡聚糖样品与不同食品胶体复配表观黏度性质比较Table 4 Comparative apparent viscosity property of different food gum mixed with oat bran β-glucan
复配胶体溶液黏度的测量可以反映出β-葡聚糖样品与食品胶的协同增稠率,胶体与β-葡聚糖的比例影响着其增效作用。由表4可知,0.1%燕麦β-葡聚糖与阿拉伯胶复配后没有增稠作用,与其他4种胶体复配后增稠作用也不明显,但是互相也没有拮抗影响。因此燕麦β-葡聚糖与其他食品胶有很好的兼容性,可应用于食品和医疗方面作为增稠剂和稳定剂。
3 结论
采用超声辅助冻融法从燕麦麸中提取β-葡聚糖时,料液比为 1 ∶20(g/mL)、超声功率为 450 W、提取温度为55℃、提取时间为50 min,将提取液蒸发浓缩至体积的4%,反复冻融2次。在此条件下,燕麦麸β-葡聚糖纯度为82.3%,得率为6.0%,其持水率为307.6%,0.1%浓度下其表观黏度可达74.8 g/(cm·s),与同浓度的瓜尔胶相似。

