量子点荧光免疫检测牛奶中己烯雌酚、雌二醇
云瀚漩,盖雪姣,韩振宇,刘明珠,范龙兴,张樱樱,白家磊,宁保安,刘颖*
(1.内蒙古医科大学公共卫生学院,内蒙古 呼和浩特 010110;2.军事科学院军事医学研究院环境医学与作业医学研究所,天津 300050;3.福州大学化学学院食品安全与生物分析教育部重点实验室,福建 福州 350116)
己烯雌酚(diethylstilbestrol,DES)是一种人工合成的非甾体雌激素,常在畜牧养殖业中被作为促生长剂使用,易在动物肝脏、脂肪、肌肉、乳汁中沉积[1-2]。DES已被世界卫生组织国际癌症研究机构列为一类致癌物,接触后甚至可对后代产生致癌影响[3]。与DES不同,17β-雌二醇(17β-estradiol,E2)为天然类固醇雌激素[4],具有较高活性[5],已有研究证明牛羊体内的雌激素可释放至乳汁中[6],摄入过量会影响代谢和发育,增大肿瘤的发生风险[7-9],引起一系列健康问题。
目前,常用于检测食品中雌激素的方法包括色谱法[10-11]、电化学分析法[12-13]、免疫分析法[14-15]等。色谱法具有较高灵敏度,但仪器体积较大,对操作要求高,针对复杂样品的前处理工作繁杂,不适合现场快速检测。电化学分析法在保证灵敏度的前提下操作简单,但对目标物的电活性有一定要求[16],稳定性和特异性均欠佳。传统免疫分析法检测时间较长,需接触危险试剂,对操作人员健康存在隐患。因此,研究一种快速便携、灵敏度高、特异性好、健康安全的方法用于牛奶中雌激素现场检测具有重要意义。
量子点(quantum dots,QDs)具有光学性质稳定、激发光谱宽、发射光谱窄、粒径和发射光谱可调节等优点。通过在QDs核壳表面修饰不同基团,可实现其与生物大分子的偶联[17],进而用于定量检测不同目标物[18-19]。
本文以传统酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)的原理为依托,用QDs代替辣根过氧化物酶标记羊抗小鼠二抗,建立了牛奶中DES的荧光免疫检测法,同时用该原理建立了牛奶中E2的检测方法,优化检测条件后,均得出较低检测限。与传统ELISA相比,该方法所需时间更短,操作更加安全,可作为传统方法的补充用于实际样品现场快速检测。
1 材料与方法
1.1 材料与试剂
96孔黑色底透酶标板:ThermoFisher公司;牛血清白蛋白(bovine serum albumin,BSA):Sigma公司;CdSe/ZnS杂化QDs标记的羊抗小鼠二抗(QDs-antibody2,QDs-Ab2,1mg/mL,激发波长307nm,发射波长 625nm):上海昆道生物技术有限公司;DES完全抗原(4.0mg/mL)、抗DES单克隆抗体(7.7mg/mL)、E2完全抗原(9.7mg/mL)、抗E2单克隆抗体(6 mg/mL):山东绿都生物科技有限公司;DES标准品及其类似物(100 μg/mL)、E2标准品及其类似物(100 μg/mL):北京百灵威科技有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
SpectraMax M5多功能酶标仪:Molecular Devices公司;F97Pro荧光分光光度计:上海棱光技术有限公司;DRP-9162电热恒温培养箱:中国森信公司;6410B液相色谱质谱联用仪:安捷伦科技有限公司。
1.3 方法
1.3.1 抗原抗体浓度优化
将抗原抗体按照梯度稀释后做方阵滴定试验,稀释体积比例依次为1∶1000、1∶2000、1∶4000、1∶8 000、1 ∶16 000、1 ∶32 000、1 ∶64 000、1 ∶128 000。从结果中选取荧光响应值较高且梯度良好的抗原抗体浓度做间接竞争荧光免疫检测,将灵敏度较高、荧光响应较好的浓度作为抗原包被浓度和一抗浓度用于标准曲线建立。灵敏度参考竞争抑制率,竞争抑制率/%=F/F0×100,F为添加目标物的阳性组荧光值,F0为未添加目标物的阴性组荧光值[20]。
1.3.2 二抗浓度优化
将量子点标记二抗分别稀释50倍、100倍、150倍、200倍用于试验,参考结合信噪比优化浓度[21]。
1.3.3 缓冲液浓度优化
分别配制5%、10%、15%、20%甲醇磷酸缓冲盐溶液(phosphate buffer saline,PBS),用于小分子标准品的配制,分别做间接竞争试验,结合荧光响应和灵敏度选择最适浓度。
1.3.4 缓冲液pH值优化
分别配制 pH 值为 6.4、6.8、7.2、7.6、8.0 的甲醇PBS缓冲液,溶解小分子后做竞争试验,优化检测最适酸碱度。
1.3.5 封闭液优化
配制1%、2%、3%的BSA溶液作为封闭液,分别用于竞争试验进行浓度优化。
1.3.6 标准曲线建立
将优化后的抗原浓度作为包被浓度,用碳酸盐缓冲溶液(carbonate buffer solution,CBS)稀释后加入96孔板,100 μL/孔,4℃过夜。用磷酸盐缓冲液+0.1%吐温 20清洗 3次后加入封闭液(1%BSA),160 μL/孔,37℃封闭1 h后再次洗涤。将小分子标准品和抗雌激素抗体(抗体稀释液稀释)依次加入96孔板中,各50 μL/孔,37 ℃孵育 1 h。洗液洗涤后加入 QDs-Ab2,100 μL/孔,37℃孵育1 h,洗液清洗后用多功能酶标仪检测。
1.3.7 特异性试验
配制雌激素类似物雌三醇(striol,E3)、双酚 A(bsphenol A,BPA)、己烷雌酚(hexoestrolum)小分子标准液,用于竞争试验,评价检测方法对目标物的特异性。
1.3.8 加标回收试验与方法学比较
于牛奶样品中加入不同浓度小分子标准液,浓度依次为 DES 1、10、100 ng/mL,E2 0.5、5、50 ng/mL,涡旋混匀后4 000 r/min离心10 min,重复两次,取上清液作为样品进行检测,评价回收率。
为了验证研究所建立方法结果的可靠性与性能优势,将结果与液相色谱质谱串联法(liquid chromatography-tandem mass spectrometry,LC-MS/MS)检测结果进行比较,评价方法性能。
物流传输一体化:通过区内与各个化学反应装置连成一体的专用输送管网以及仓库、码头、铁路和道路等一体化的物流运输系统,将区域内的原料、能源和中间体安全、快捷地送达目的地。
1.4 数据处理
采用OriginPro 2018处理数据,对数据进行拟合并作图。
2 结果与分析
2.1 抗原抗体浓度优化
包被抗原和抗体浓度是影响检测方法灵敏度和检测限的关键,参考竞争抑制率与荧光强度对二者进行优化。DES包被抗原及抗体浓度优化结果见图1,E2包被抗原及抗体浓度优化结果见图2。
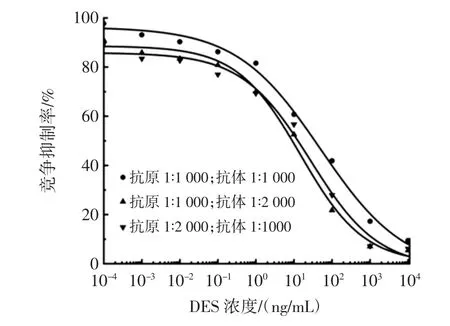
图1 DES的荧光免疫检测包被抗原与抗体浓度优化结果Fig.1 Optimal concentration of antigen and monoclonal antibody for DES fluorescent immunoassay
如图1所示,以1∶1 000的比例稀释DES抗原包被96孔板,1∶2 000的比例稀释DES抗体捕获抗原时,两者浓度配比最佳,方法较为灵敏。
如图2所示,当包被所用E2抗原浓度为1∶4 000倍稀释,捕获抗原的E2抗体为1∶8 000倍稀释时检测灵敏度最高。
2.2 二抗浓度优化
将粒径为100 nm的CdSe/ZnS杂化QDs修饰羊抗小鼠二抗用于检测方法建立,其光谱图见图3。
如图3所示,修饰二抗的量子点在307 nm处被稳定激发,625 nm处可接收信号。在将要建立的荧光免疫检测方法中,QDs-Ab2起到至关重要的作用,其浓度直接决定输出的荧光值大小,需对QDs-Ab2的浓度进行优化。QDs-Ab2浓度优化结果见表1。
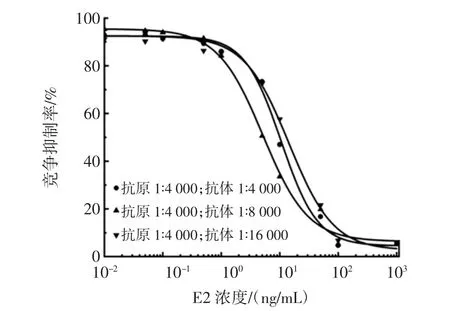
图2 E2的荧光免疫检测包被抗原与抗体浓度优化结果Fig.2 Optimal concentration of antigen and monoclonal antibody for E2 fluorescent immunoassay

图3 QDs二抗的荧光光谱图Fig.3 The fluorescence spectra of QDs-Ab2
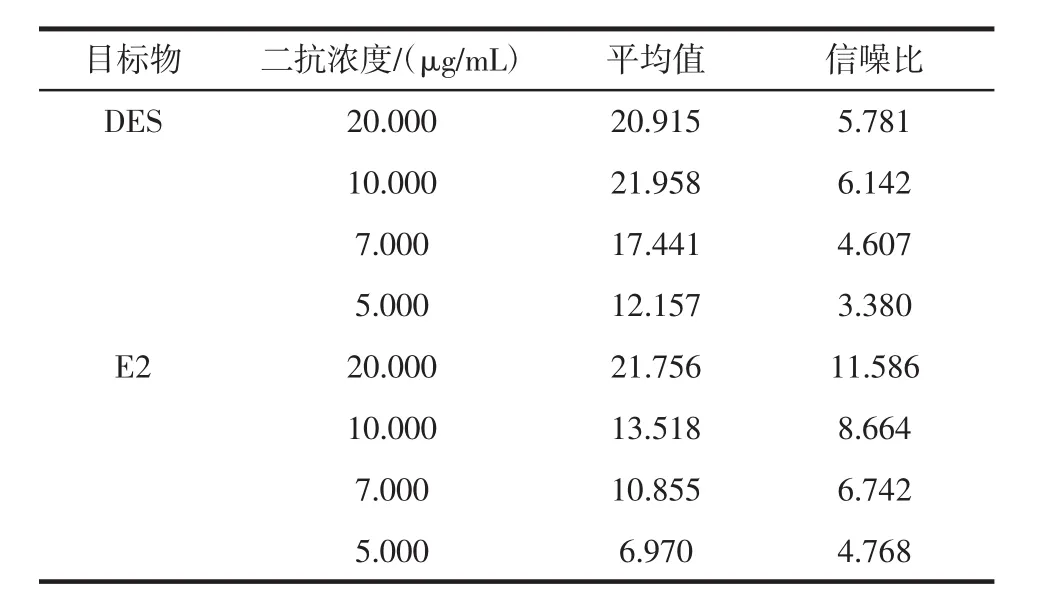
表1 不同浓度二抗的雌激素荧光检测结果Table 1 The fluorescence detection of estrogen with different concentrations of QDs-Ab2
结果表明,在对DES的荧光免疫检测中,二抗浓度为10 μg/mL时所得信噪比最高,荧光响应值也较高。同时对E2检测的二抗浓度进行优化,发现20μg/mL时的检测信噪比最高,结合经济角度考虑,最终选择10 μg/mL作为E2检测的二抗最适浓度。
2.3 缓冲液浓度优化
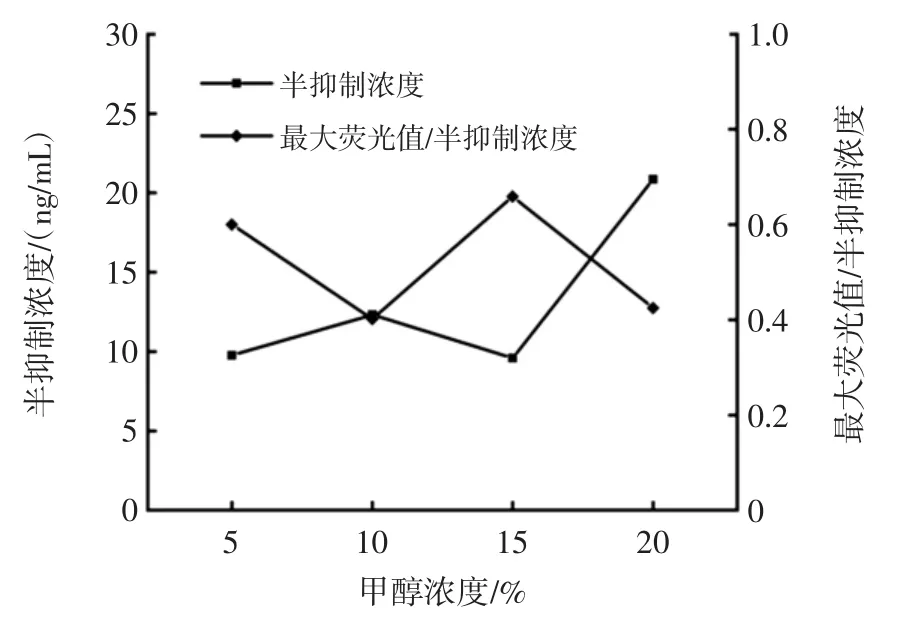
图4 DES的荧光免疫检测缓冲液优化结果Fig.4 Optimal concentration of buffer for DES fluorescent immunoassay

图5 E2的荧光免疫检测缓冲液优化结果Fig.5 Optimal concentration of buffer for E2 fluorescent immunoassay
如图4所示,当缓冲液中甲醇比例为15%时,DES检测的半抑制浓度(half maximal inhibitory concentration,IC50)最低,而最大荧光值与IC50的比值最大,表明在该缓冲液浓度下,检测得到了更高的灵敏度和相对荧光值。
如图5所示,在对E2做相同优化后,得出的最适比例为20%。
2.4 缓冲液pH值优化
在对缓冲液中甲醇浓度进行探究后,进一步优化缓冲液pH值。在DES检测中,一定范围内,酸碱度对灵敏度的影响较小,优化的最适pH 7.2,优化结果见图6,E2检测中,缓冲液pH 6.8时得到了较高灵敏度,优化结果见图7。

图6 DES的荧光免疫检测pH值优化结果Fig.6 Optimal pH for DES fluorescence immunoassay

图7 E2的荧光免疫检测pH值优化结果Fig.7 Optimal pH for E2 fluorescence immunoassay
2.5 封闭液优化
为了验证封闭液浓度是否会对检测灵敏度产生影响,分别采用1%、2%、3%的BSA对试验进行优化,DES与E2检测封闭液优化结果分别如图8、图9所示,两种目标物检测方法最适封闭液浓度均为1%。
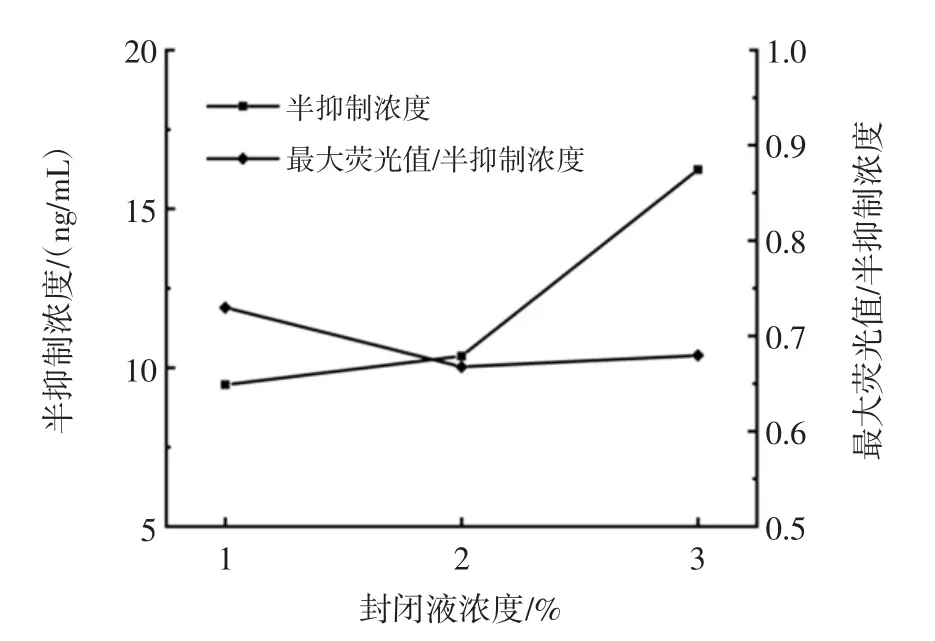
图8 DES的荧光免疫检测封闭液优化结果Fig.8 Optimal sealing fluid concentration for DES fluorescence immunoassay
2.6 标准曲线建立
结合优化结果中的最适检测条件,建立DES荧光免疫检测标准曲线。结果见图10。
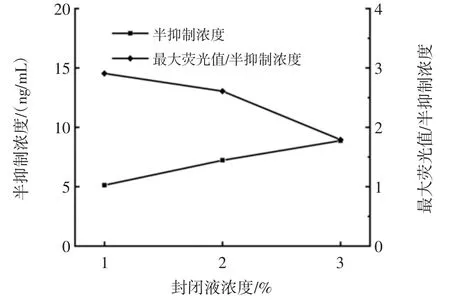
图9 E2的荧光免疫检测封闭液优化结果Fig.9 Optimal sealing fluid concentration for E2 fluorescence immunoassay
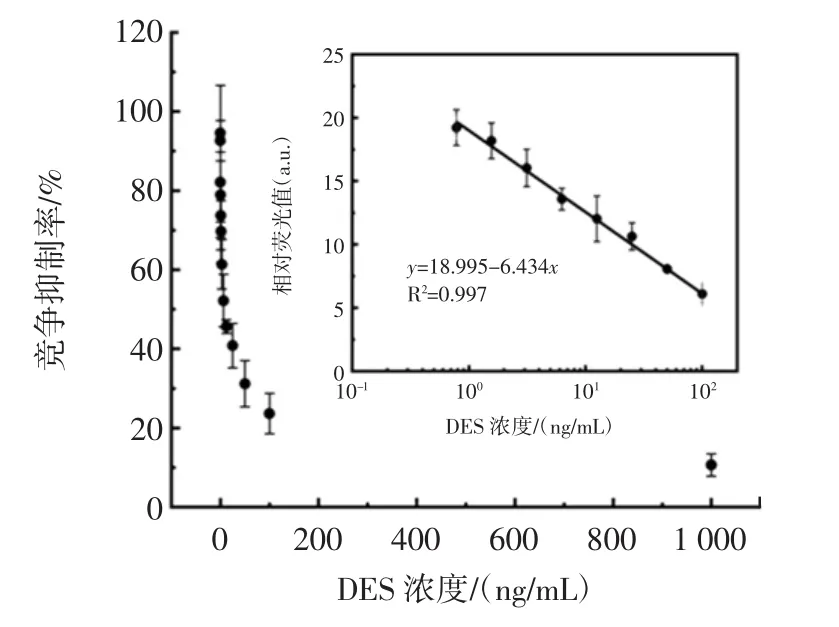
图10 DES的荧光免疫检测标准曲线Fig.10 Standard curve of DES fluorescence immunoassay
如图10所示,目标物浓度在0.418 ng/mL~195.065 ng/mL范围内呈线性关系,线性方程为y=18.995-6.434x,线性拟合优度R2=0.997,最低检测限为0.109 ng/mL,IC50为 8.515 ng/mL。
建立E2荧光免疫检测标准曲线。结果见图11。
如图11所示,目标物浓度在0.472 ng/mL~66.597ng/mL内呈线性关系,线性方程为y=7.858-3.197x,线性拟合优度R2=0.987,最低检测限为0.236 ng/mL,IC50为 2.865 ng/mL。
2.7 特异性试验
两种雌激素荧光免疫检测特异性试验结果见表2。
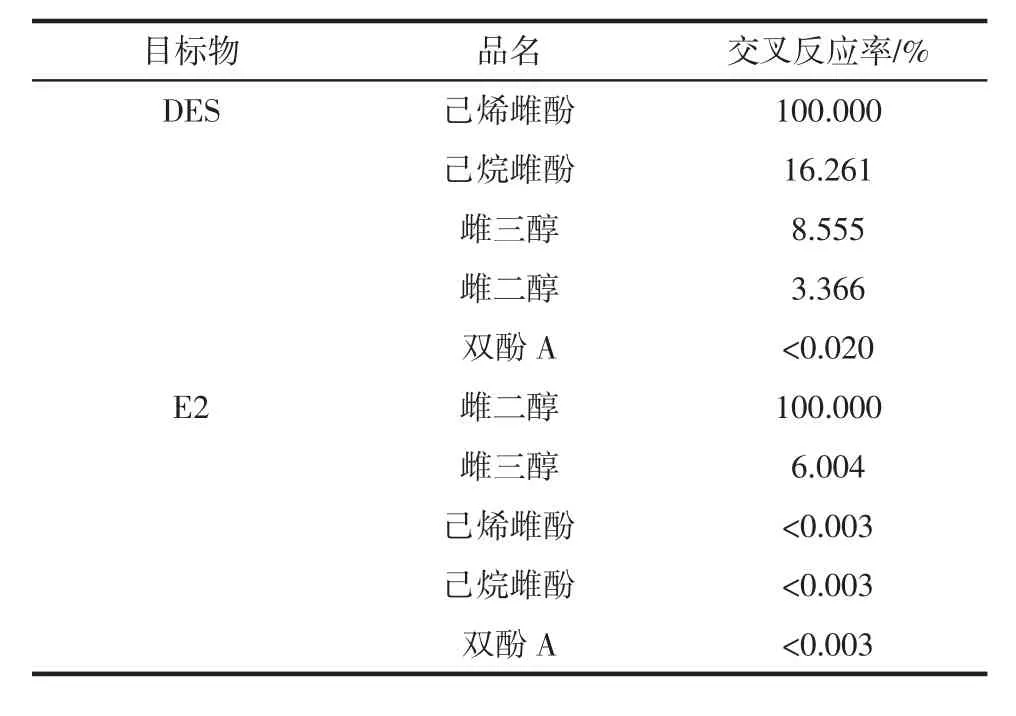
表2 两种雌激素荧光免疫检测特异性试验结果Table 2 The specificity of fluorescence immunoassay for two kinds of estrogen
在特异性试验中,分别证明了检测方法对两种雌激素具有良好选择性,对类似物交叉反应率较低,可用于复杂样品的检测。
2.8 加标回收试验与方法学比较
两种雌激素荧光免疫检测回收率试验结果见表3。
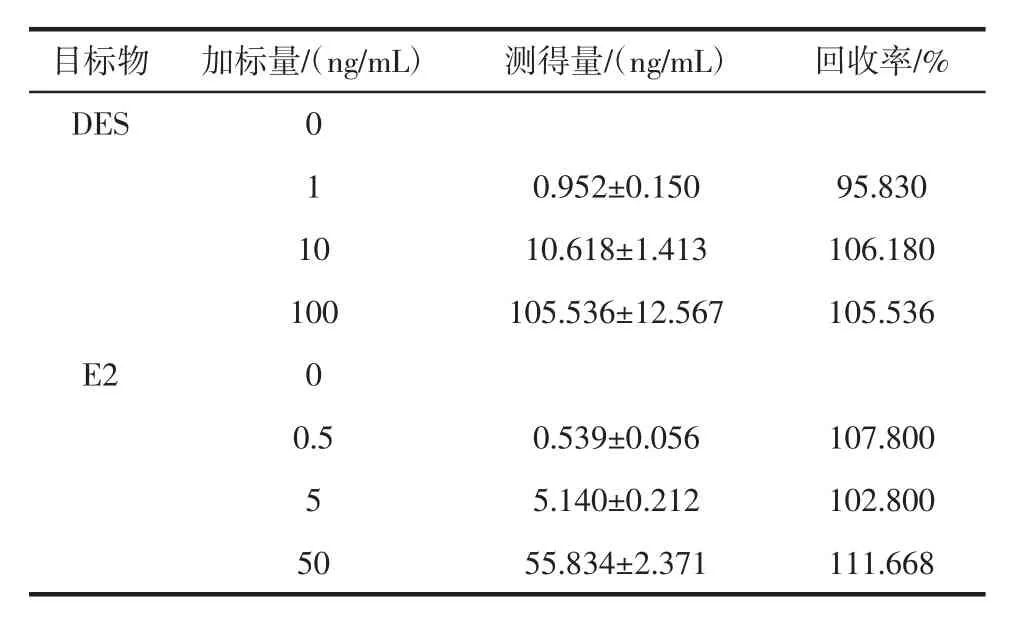
表3 两种雌激素荧光免疫检测回收率试验结果(n=3)Table 3 Recovery of two kinds of estrogens with fluorescence immunoassay
根据加标回收试验结果分析,所建立方法回收率良好,结果稳定,表明该方法可用于牛奶实际样品中DES、E2的检测。
为评价研究所建立方法与其它方法相比结果是否一致、性能是否存在优势,选择液相色谱质谱串联法与本研究所建立方法就检测限和加标检测结果进行比较。结果如表4所示。
本研究所建立方法与液相色谱质谱串联法结果一致,加标样品均显示阳性,可用于实际样品检测。相比之下,荧光免疫检测法对于样品前处理方法要求灵活,无需繁杂程序,在节省时间的基础上可降低处理过程对样品中目标物的损耗。更值得关注的是,免疫荧光检测不依赖大型仪器,不仅节约检测成本,还为实现现场检测提供了可能。而与传统ELISA相比,荧光免疫检测法无需显色即可直接检测,不仅缩短了检测时间,还可免去在过程中使用强酸作为终止液,方法更加绿色安全,具有较高推广价值。
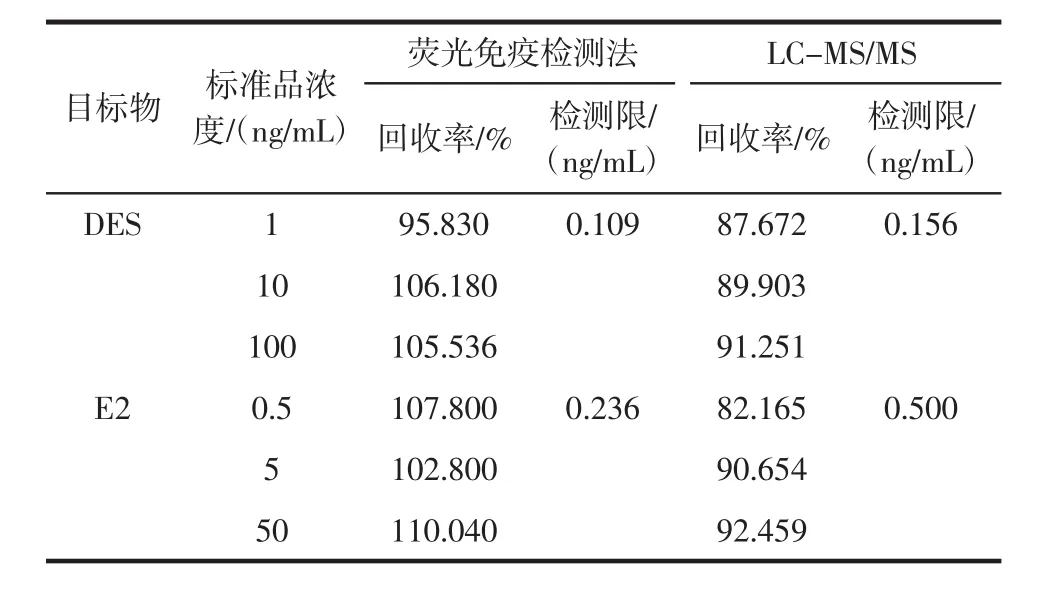
表4 荧光免疫检测法与LC-MS/MS方法学比较结果(n=3)Table 4 Fluorescence immunoassay was compared with LC-MS/MS methodology(n=3)
3 结论
分别建立了检测牛奶中DES、E2残留的荧光免疫检测法,得到了较好的回收率和较低交叉反应率,可对实际样品进行检测。所建立方法不依靠大型仪器设备和专业操作,与传统免疫方法相比检测时间更短,操作过程绿色安全。具有前处理简单、安全、快速、灵敏、特异等优点,可补充传统方法,用于牛奶中雌激素兽药残留的快速检测。同时,方法可用于其它小分子污染物在食品中的快速检测,发展前景良好。

