人源pEGFP-C1-p38γ真核表达质粒的构建及其功能研究
胡 爽,杨 莉,陈 晨,潘林鑫,李良云,杨俊发,周 焕,徐 涛
细胞外信号调节激酶P38γ是P38 MAPKs的一个亚型,P38γ与人类约一半的癌症、感染、自身免疫性疾病等引起的炎症有关,其主要是通过对炎症信号通路调节,从而促进肿瘤的发生。相关实验表明p38γ可能是肝癌治疗的一个新靶点,p38γ可能在肝脏疾病的发生发展中起到关键性的作用。相关研究表明p38γ在非酒精性肝病中高表达,且沉默p38γ后能够减轻小鼠脂肪变性的程度。然而,p38γ在酒精性肝病中的表达情况及其对炎症因子的调节作用尚不清楚。L0-2细胞是正常人源肝细胞,常用于研究酒精性肝病中炎症分泌及脂质代谢的相关调节机制。故选取 L0-2细胞,用100 mmol/L乙醇刺激细胞24 h,研究p38γ对相应炎症因子的调节作用。该实验将通过构建p38γ的过表达质粒,研究p38γ对乙醇刺激后的L0-2细胞的增殖和凋亡及其炎症因子白细胞介素-6(interleukin-6,IL-6)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)表达情况的影响。
1 材料与方法
1.1 试剂与材料
L0-2细胞株(安徽医科大学药学院保存);Annexin V-FITC/PI双染细胞凋亡检测试剂盒(上海BestBio公司);p38γ抗体(美国Cell Signaling Technology公司);Western blot试剂盒、超敏ECL化学发光试剂及TRIzol Reagent RNA提取试剂(上海Beyotime公司);细胞培养瓶及培养板(无锡NEST公司);PVDF膜(上海安谱实验科技股份有限公司);DMEM培养基、胎牛血清(北京沃卡威生物技术有限公司公司)。1.2 方法
1.2.1 重建质粒的构建 pEGFP-C1-p38γ人源质粒由安徽通用生物系统有限公司构建,并送至上海生工生物有限公司测序鉴定。
1.2.2 pEGFP-C1-p38γ质粒的转染及实验分组L0-2细胞置于6孔板中培养至60%。将A液(200 μl的Opti-MEM及1μg pEGFP-C1-p38γ质粒)与B液(200μl的Opti-MEM及4μl Lipofectamine2000脂质体)分别置于1.5 ml EP管中静置5 min后,将A、B液混匀静置20 min,置于6孔板中再补齐Opti-MEM至2 ml,6 h后,更换为含 100 mmol/L乙醇的培养基,继续培养24 h后待用。L0-2细胞,未加处理的为正常组,经100 mmol/L乙醇刺激24 h的为模型组,在此基础上再转染空载体质粒的为对照组或转染pEGFP-C1-p38γ质粒的为过表达组。
1.2.3 Western blot实验 弃去6孔板中培养基,PBS清洗3遍,每孔200μl加入蛋白裂解液(RIPA裂解液 ∶苯甲基磺酰氟=100∶1)于冰上裂解细胞30 min,提取蛋白。进行SDS-PAGE电泳,在200mA恒流的条件下湿转60 min后,取出PVDF膜置于5%牛奶中封闭2 h,用Tris-HCl缓冲盐溶液(TBST)清洗3遍,孵育一抗(β-actin、p38γ)过夜。TBST清洗3遍,室温孵育二抗1 h,TBST清洗后显影。
1.2.4 MTT实验 在96孔培养板中接种5 000数量的L0-2细胞至70%后,再向每孔转染约70 ng pEGFP-C1-p38γ质粒,6 h后更换含100 mmol/L乙醇的培养基,再培养48 h后每孔加入20μl MTT,4 h后,用5 ml注射器弃去培养基,每孔加入150μl二甲基亚砜,充分裂解10 min后,测定吸光度,计算细胞存活率。
1.2.5 流式细胞术 将L0-2细胞接种至6孔板中,转染 pEGFP-C1-p38γ质粒,转染成功后,使用PBS清洗3次,加入1 ml的胰酶进行消化,收集细胞放置于15 ml离心管中,每组用400μl Binding Buffer重悬细胞,再加入5μl Annexin V染液,避光孵育15 min,再加入10μl PI,避光孵育5 min后,使用流式细胞仪检测细胞凋亡率,观察并记录。
2 结果
2.1 pEGFP-C1-p38γ真核表达质粒的构建
在人源L0-2细胞中提取RNA,逆转录后PCR扩增p38γ的CDS序列,利用XhoI和EcoRI双酶切扩增产物和pEGFP-C1载体,并用T4 DNA连接酶连接两产物,将其转化到TG 1感受态细胞,用抽提试剂盒提取质粒,酶切鉴定(XhoI和EcoRI双酶切)阳性重组质粒的插入,送至上海生工生物有限公司鉴定测序。pEGFP-C1-p38γ质粒成功构建,见图1。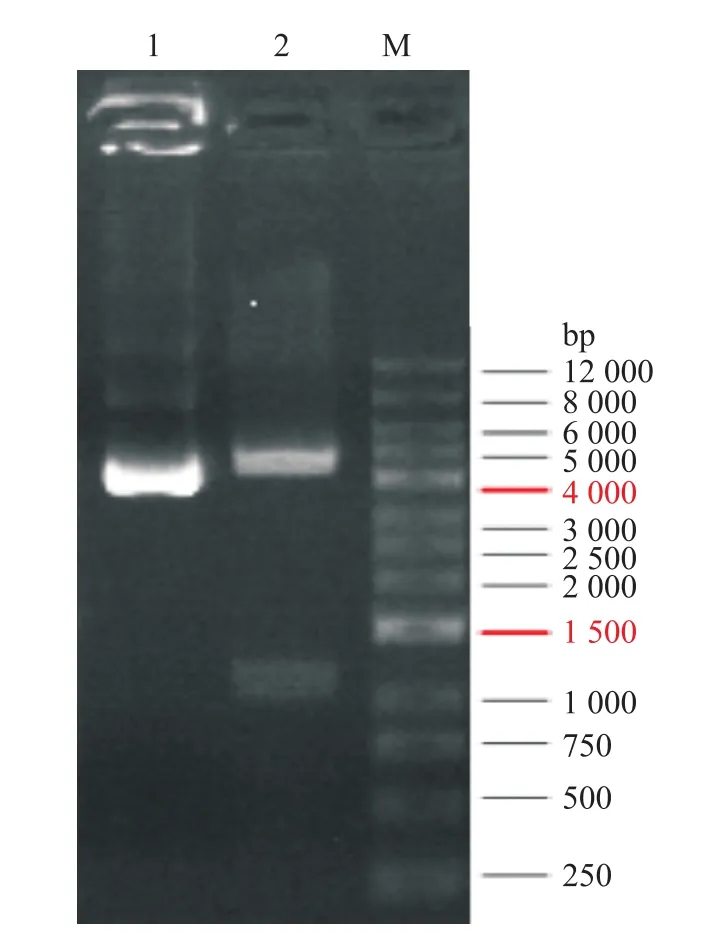
图1 重组质粒pEGFP-C1-p38γ的酶切鉴定
2.2 pEGFP-C1-p38γ真核表达质粒的表达
将pEGFP-C1-p38γ表达质粒转染至L0-2细胞中,利用Western blot检测其蛋白表达情况。结果显示过表达组的p38γ的蛋白表达量高于转染空载体的对照组(t=8.786,P<0.01),见图2。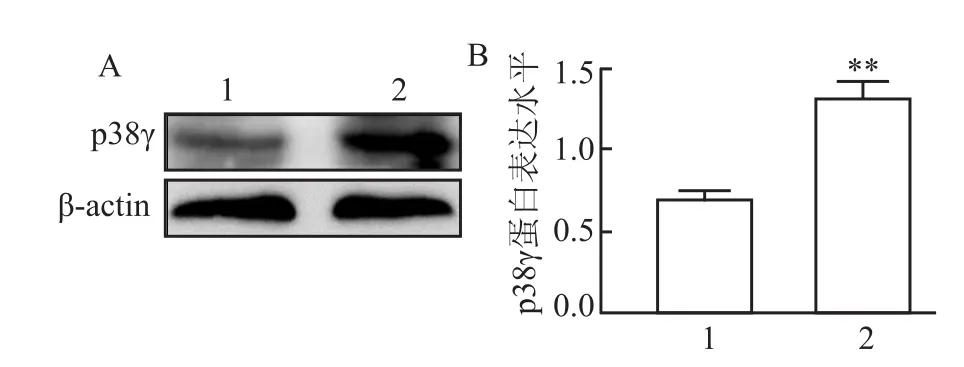
图2 重组质粒pEGFP-C1-p38γ的蛋白表达
2.3 p38γ对L0-2细胞增殖的影响
MTT检测将pEGFP-C1-p38γ表达质粒转染至L0-2细胞后的细胞增殖情况,结果显示24 h后正常组增殖率为(0.96±0.06)%,模型组及对照组增殖率为(0.65±0.05)%和(0.60±0.03)%,过表达组的细胞增殖率为(0.42±0.08)%,低于模型组和转染空载体的对照组(F=42.91,P<0.05),见图3。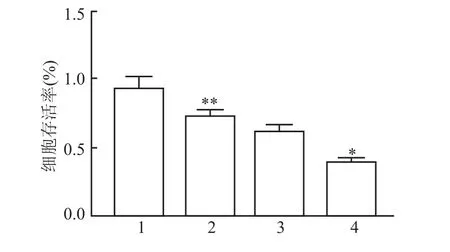
图3 MTT检测细胞增殖
2.4 p38γ对细胞凋亡的影响
转染 pEGFP-C1-p38γ质粒到处于对数期生长的L0-2细胞中,48 h后用凋亡试剂盒在流式仪上检测细胞凋亡率,结果显示正常组的细胞凋亡率为(5.15±0.81)%,模型组及对照组的细胞凋亡率分别为(13.97±1.14)%和(13.18±1.34)%,而过表达组的细胞凋亡率(17.46±1.52)%,高于对照组(F=24.33,P<0.05)。结果表明过表达p38γ能够促进乙醇刺激后的L0-2细胞的凋亡,见图4A、4B。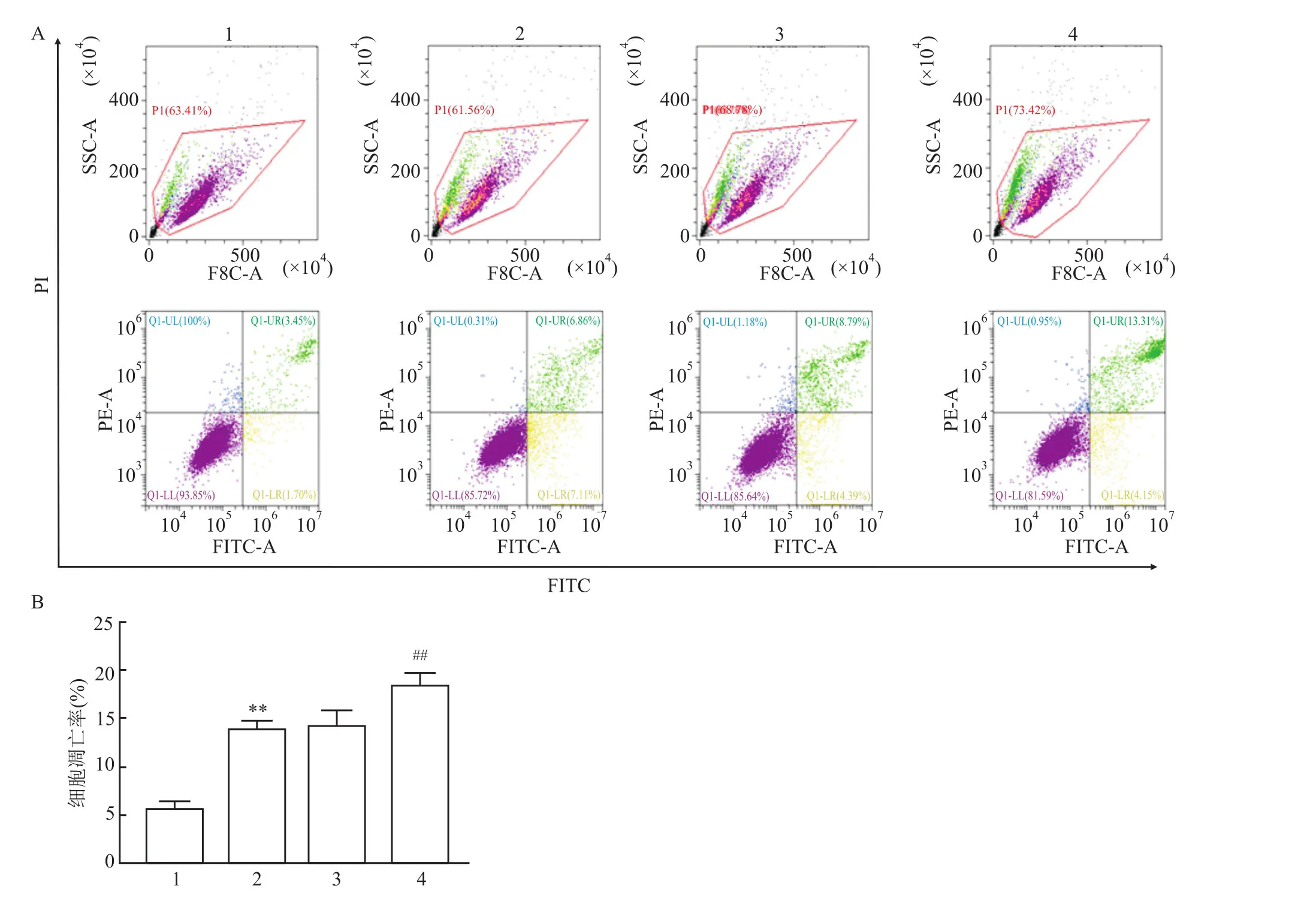
图4 重组质粒pEGFP-C1-p38γ对L0-2细胞凋亡的影响
2.5 p38γ在L0-2细胞中对炎症因子的影响
在L0-2细胞中转染pEGFP-C1-p38γ质粒,Western blot检测细胞中IL-6和TNF-α炎症因子的表达,转染后的过表达组中的 IL-6表达较对照组升高 (P<0.01);TNF-α的表达对照组升高 (F=50.33,P<0.01),表明在L0-2细胞中,p38γ促进炎症因子IL-6和TNF-α的表达。见图5。
图5 p38γ转染后Western blot检测炎症因子IL-6和TNF-α的表达
3 讨论
有丝分裂原激活蛋白激酶p38家族包含4种亚型p38α、p38β、p38γ和p38δ,是存在于各种生物细胞中一条重要的信号传导通路,其在细胞对环境应激反应中起着重要作用。其中,p38γ在骨骼肌中含量丰富,对细胞周期进展至关重要,同时参与肿瘤的发生、癌症干细胞的迁移/侵袭和细胞转化的调节。研究证实 p38γ在非酒精性脂肪肝及肝癌中都发挥着一定的调节作用,但其在酒精性肝病中的调节作用仍不清楚。酒精性肝病是由于长期大量饮酒所致的肝脏疾病,在西方国家,长期大量饮酒导致的酒精性肝硬化是肝硬化的最主要类型,也是肝移植最常见的适应证之一。炎症作为酒精性肝病的初始阶段,在酒精性肝病的发展进程中的起着至关重要的作用。其研究中主要的炎症细胞因子有IL-6和TNF-α。L0-2是正常肝细胞系,细胞多为圆核状,有中等数量的内质网、线粒体等特征,是研究肝脏毒性常用的细胞模型,可用于评价外源生物性异物的安全性或毒性实验等。乙醇刺激L0-2细胞后会促使其分泌炎症因子,该实验在乙醇刺激L0-2细胞24 h后构建p38γ过表达模型,探索p38γ对炎症因子IL-6和TNF-α的调节作用。Western blot结果显示过表达 p38γ后,IL-6和TNF-α的表达升高,表明p38γ会加重L0-2细胞的炎症反应。同时,本实验研究了p38γ对乙醇刺激的L0-2细胞增殖和凋亡的影响。研究表明正常的肝细胞增殖和凋亡可以调节正常肝细胞的数量,维持肝脏功能和体积,但病理状态下,异常的肝细胞增殖和凋亡会参与酒精性肝病的发生。尽管相关文献显示p38的主要作用为促进细胞的增殖,但p38家族和 p38γ之间的功能并不完全一致,且p38γ在不同疾病中的功能也不是完全一致。该研究MTT及流式细胞术实验结果显示,乙醇刺激24 h后,过表达p38γ能够抑制乙醇刺激后的L0-2细胞的增殖,促进乙醇刺激后的L0-2细胞的凋亡。该研究揭示p38γ可能通过调节乙醇刺激后的肝细胞的增殖和凋亡来影响酒精性肝病发病进程。

