Fibulin-2在肝癌中的表达及其与MMPs、VEGF的相关性研究
任 超,葛勇胜,荚卫东,石 旭,陈 新,刘 松
肝细胞癌(hepateocllular carcinoma,HCC,简称肝癌)是原发性肝癌(primary liver cancer,PLC)中最常见的一种,在我国其发病率和病死率分别位于第4位和第3位。随着医疗水平及早期预防意识的提高,HCC患者的诊治有了长足的进步,但术后频繁的复发与转移仍然是威胁肝癌患者长期生存的主要危险因素。细胞外基质(extracellular matrix,ECM)是一种分布在细胞表面为细胞提供结构支持以及维持动态平衡的分子,肿瘤进展的众多复杂机制中就包括细胞与ECM的黏附、蛋白酶分泌、ECM降解等过程。而原纤维蛋白2(Fibulin-2)作为ECM的主要成分之一,被认为在癌症的发展中起着重要作用,并且已经被证明对癌细胞既有致癌活性又有肿瘤抑制活性,而Fibulin-2在HCC中的表达及其影响HCC发生发展的相关作用机制尚不清楚。该研究将初步探讨Fibulin-2对HCC的具体作用及其可能的机制。
1 材料与方法
1.1 病理标本与实验试剂
该研究收集了20例新鲜冷冻肝癌组织及相对应癌旁组织(距离肿瘤边缘至少2 cm,来自安徽省肝胆胰重点实验室冷冻标本库)用于Western blot及qRT-PCR实验检测。兔抗人基质金属蛋白酶 2(matrix metalloproteinase-2,MMP-2)抗体、兔抗人基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)抗体购自北京博奥森公司;鼠抗人血管内皮生长因子(vascular endothelial growth factor,VEGF)抗体、兔抗人 Fibulin-2抗体购自美国Abcam公司;TRIzol试剂购自美国Life technogies公司;PrimeScriptRT reagent Kit with gDNA Eraser购自日本Takara公司;Novostart SYBR qPCR SuperMix Plus购自上海 novoprotein公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐 [3-(4,5-dimethylthiahiazol-2-yl)-2,5-diphenytetrazolium bromide,MTT]检测试剂盒、凋亡试剂盒购自上海BestBio公司;肝癌HepG2细胞株购自上海细胞库。1.2 实验方法
1.2.1 Western blot实验 剪取组织,称重,每个样品质量在100 mg左右,加入RIPA细胞裂解液1 ml(内含1 mmol/L苯甲基磺酰氟)进行裂解。12 000 r/min离心10 min,收集上清液,即含有组织总蛋白。配制SDS-PAGE凝胶,收集的蛋白样品中按照1∶4加入5×SDS-PAGE蛋白上样缓冲液。沸水浴加热10 min,以充分变性蛋白。待冷却到室温后,把蛋白样品按每孔加30μg上样到SDS-PAGE胶加样孔内。浓缩胶所用电压为80 V,时间为30 min;分离胶所用电压为120 V,时间为1 h。在转膜和封闭之后,参考一抗的说明书,按适当比例稀释[Fibulin-2抗体属性为兔抗1∶500稀释(10%分离胶);Actin抗体属性为鼠抗1∶1 000稀释(10%分离胶)],4℃缓慢摇动孵育过夜。加入洗涤液,每次洗涤10 min,共洗涤3次。参考二抗的说明书,按照1∶20 000用二抗稀释液稀释辣根过氧化物酶(HRP)标记的二抗。室温孵育2 h。加入洗涤液,每次洗涤10 min,共洗涤3次。参考相关说明书,使用ECL发光试剂盒来检测蛋白,Image J软件分析条带灰度值。
1.2.2 qRT-PCR实验 用TRIzol提取RNA,并经逆转录得到cDNA。qRT-PCR反应的反应条件为:95℃、1 min;95℃、20 s;60℃、1 min,40个循环。各引物序列为:Fibulin-2,5′-CACTGCTACAAGGCACTCAC-3′(正 向 引 物),5′-GTAGAAGGAGCCCTTGGTGT-3′(反向引物),扩增子大小为138 bp;β-actin,5′-CCCTGGAGAAGAGCTACGAG-3′(正向引物),5′-GGAAGGAAGGCTGGAAGAGT-3′(反 向引物),扩增子大小为96 bp。计算方法为2。
1.2.3 瞬时转染实验 对HepG2细胞株进行细胞培养后,开始采取瞬时转染方法对细胞予以Fibulin-2过表达以及沉默处理。6孔板中的细胞密度以50%~70%为宜。配置转染试剂:①将适量基因100 nmol溶于250μl无血清培养基中;② 在250 μl无血清培养基中溶入5μl lipo2000。混匀后,室温静置5 min;③ 将前2者混匀,室温放置20 min。6孔板先用无血清培养基洗涤2~3次,再将混匀后的培养基(500μl)加入到6孔板中,轻轻摇晃1~2 min,体积补至2 ml,放到培养箱培养24~48 h后检测转染效率。根据不同处理方式将肝癌细胞分为7组,分别为 Normal组(未经任何处理),Si1、Si2、Si3组(进行Fibulin-2沉默处理,3者处理方式完全一致,最终选取沉默效果最好的一组),overexpresion-Fibulin2组(进行Fibulin-2过表达处理),Si-NC组(沉默处理阴性对照)和overexpresion-NC组(过表达处理阴性对照)。
1.2.4 MTT细胞增殖实验 取状态较好肝癌细胞,0.25%胰酶消化后计数。用完全培养液(10%胎牛血清)配制成单个细胞悬液,细胞计数调整其浓度至(5~10)×10/ml。以每孔1 000个细胞接种至96孔板,每孔100μl,培养板边缘孔用磷酸盐缓冲溶液(PBS)填充。接种好的细胞培养板放入培养箱中培养数小时,至细胞满孔底(96孔,单层)。4.5% CO、37℃孵育约1~3 d,于倒置显微镜下观测。每孔加入10μl MTT溶液(5 mg/ml,即0.5% MTT),继续培养4 h。随后开始准备溶解结晶。在将上清液处理掉之后,在每个孔中加入二甲基亚砜(DMSO)150μl,置于摇床上进行低速振荡10 min。设置相应的调零孔(培养基、MTT、二甲基亚砜)。在490 nm处测定各个孔的吸光度值。
1.2.5 细胞划痕实验 用笔在6孔板的背面位置,在尺子的帮助下每间0.5~1 cm画出一道横线,线横穿过孔,每孔至少穿过5条线。在孔中加入约5×10个细胞。次日用枪头尽可能垂直于背面的横线进行划痕,在使用PBS洗涤细胞3次之后,将划下的细胞弃去,并加入无血清培养基。放入37℃、5% CO培养箱培养。观察0、6、12、24 h的划痕宽度,拍照。
1.2.6 Transwell实验 制备细胞悬液前先让细胞撤血清饥饿12~24 h,进一步去除血清的影响。消化细胞,终止消化后离心弃去培养液,用PBS洗1~2遍,重悬需要使用含牛血清白蛋白的无血清培养基。调整细胞密度至(1~10)×10/ml。使用适当量无血清培养基清洗Transwell小室,取细胞悬液100~200μl加入Transwell小室,24孔板下室加入500μl含胎牛血清或趋化因子的培养基,细胞培养24 h。将小室缓慢拿出,吸干上室液体,PBS洗2遍,在其中加入4%的多聚甲醛,室温环境下固定约15 min。去掉多聚甲醛,PBS洗2遍,0.5%结晶紫染色20~30 min。自来水冲洗干净,晾干,拍照。
1.2.7 细胞凋亡实验 贴壁细胞,先用不含EDTA的胰酶消化,计数后收集(0.5~1)×10个细胞,在1 500 r/min下进行离心约3 min,弃上清液。用预冷的 PBS洗 2次,1 500 r/min,离心 3 min。加入100μl的1×Binding Buffer重悬细胞。加入5μl FITC避光静置反应15min。加入10μl的PI,混匀,室温避光静置反应5 min后上机检测。
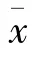
2 结果
2.1 Fibulin-2在HCC癌组织及癌旁组织中的表达
20份新鲜冷冻HCC癌组织及对应的癌旁组织采用qRT-PCR及Western blot实验对Fibulin-2的相对表达量进行分析评估,实验显示,在转录和翻译水平,Fibulin-2在HCC癌组织的表达低于所对应癌旁组织,Fibulin-2 mRNA在HCC癌组织及癌旁组织的表达量分别是(0.38±0.35)、(1.28±0.08)(图1),Fibulin-2在HCC癌组织及癌旁组织的蛋白的表达量分别是(0.50±0.12)、(1.02±0.08),差异均具有统计学意义(P<0.05)(图2)。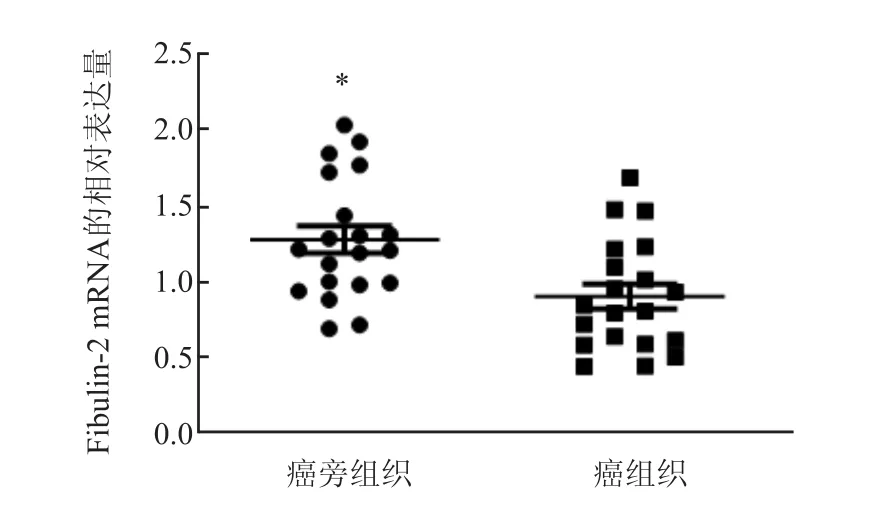
图1 Fibulin-2在HCC癌组织和癌旁组织中的相对mRNA表达水平
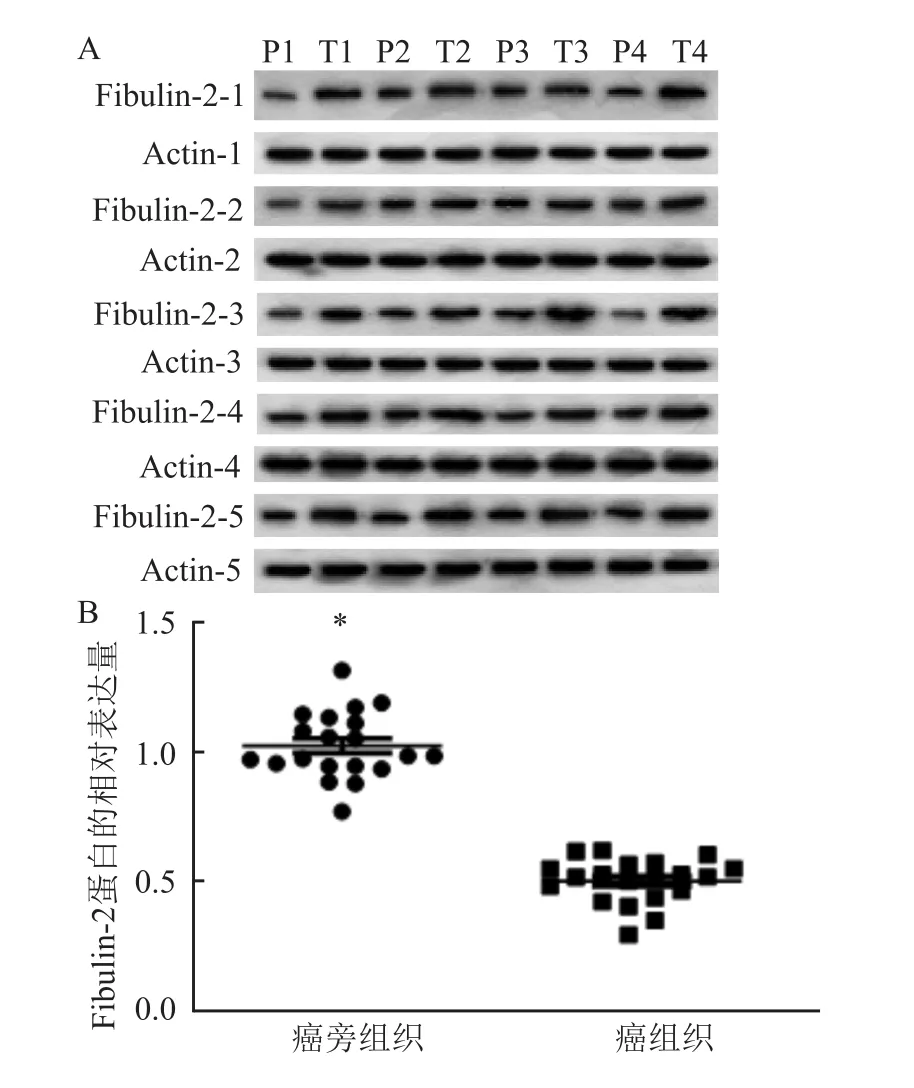
图2 Fibulin-2在HCC癌组织和癌旁组织中的相对蛋白表达水平
2.2 HepG2肝癌细胞Fibulin-2过表达及沉默转染效率
mRNA表达水平:七组细胞之间比较,差异有统计学意义(F=179.4,P<0.05);Normal组与Si-NC组、overexpresion-NC组之间皆差异无统计学意义;沉默处理的 Si1、Si2、Si3组较 Normal组皆降低(P<0.000 1,P<0.01,P<0.001),overexpresion-Fibulin2组较Normal组有所上调(P<0.000 1),差异有统计学意义。蛋白表达水平:七组细胞之间比较,差异有统计学意义(F=243.4,P<0.05);Normal组与Si-NC组、overexpresion-NC组之间差异无统计学意义;沉默处理的 Si1、Si2、Si3组较 Normal组降低(P<0.01、P<0.01、P<0.05),overexpresion-Fibulin2组较 Normal组上调(P<0.001),差异有统计学意义。见图3。沉默组中选择沉默效果最好的Si1组进行下一步实验。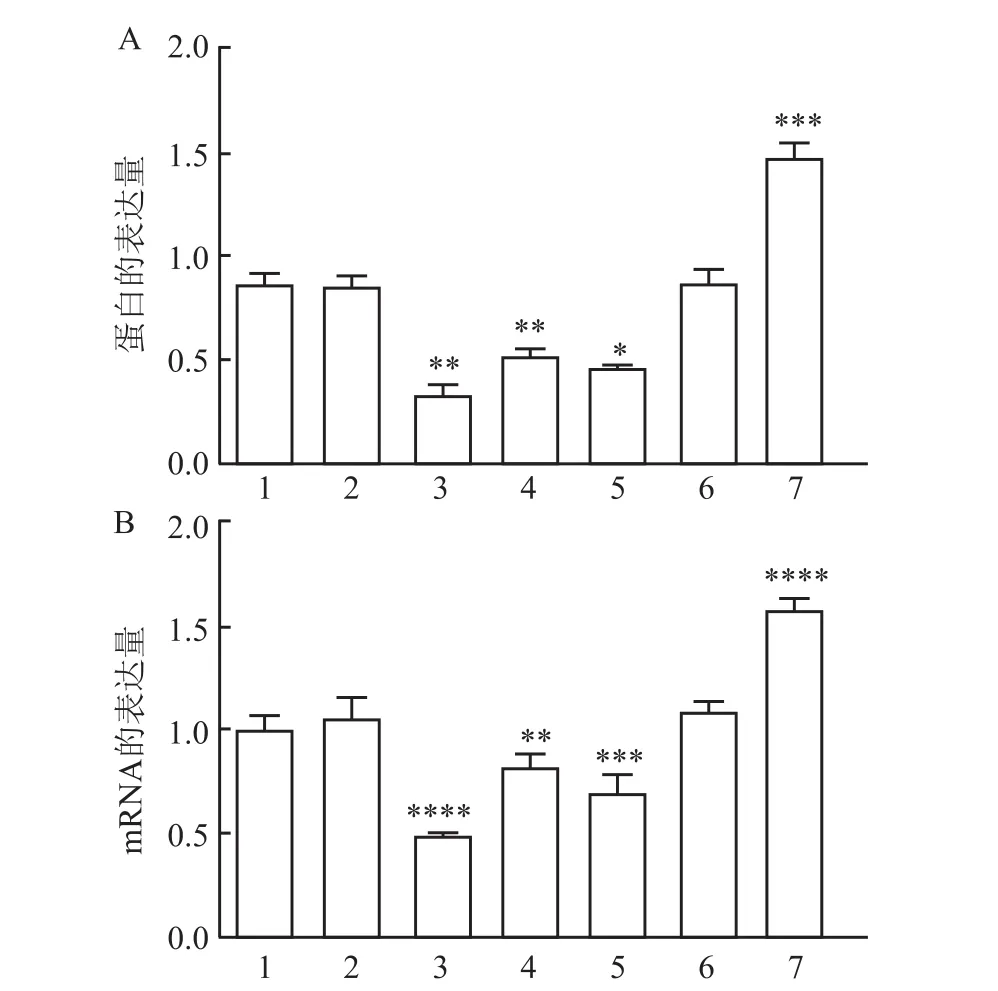
图3 HepG2各组细胞Fibulin-2 mRNA和蛋白表达情况
2.3 沉默和过表达 Fibulin-2对细胞中 MMP-2、MMP-9及VEGF表达的影响
MMP-2、MMP-9及VEGF蛋白表达水平:七组之间细胞比较,差异有统计学意义(F=95.95,F=353.3,F=195.9,P<0.05);Normal组与 Si-NC组、overexpresion-NC组之间比较,差异皆无统计学意义;沉默Fibulin-2后,Si1组较Normal组明显增高,差异有统计学意义(P<0.01、P<0.001、P<0.05);反之,过表达 Fibulin-2的overexpresion-Fibulin2组较Normal组明显下调,差异有统计学意义(P<0.05、P<0.01、P<0.01)。见图4。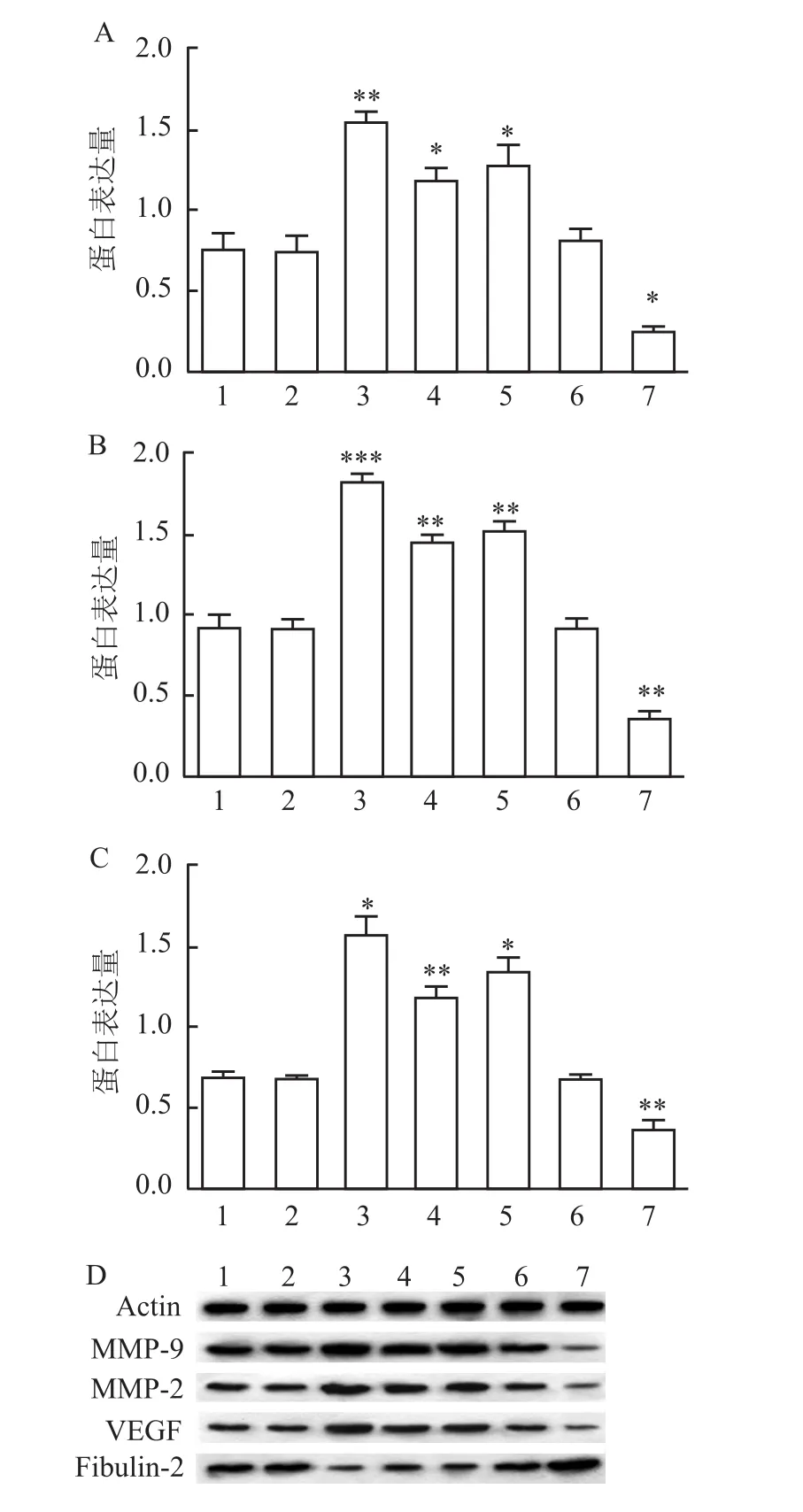
图4 各组细胞MMP-2、MMP-9及VEGF的蛋白表达及蛋白表达条带
2.4 Fibulin-2对HepG2细胞侵袭、迁移、增殖能力及凋亡率的影响
12 h和24 h细胞迁移率,七组之间比较,差异有统计学意义(F=527.3、F=343.2,P<0.05);12 h和 24 h两个时间点,Normal组与Si-NC、overexpresion-NC组之间迁移能力差异皆无统计学意义。12 h和24 h细胞迁移率,Si1组在划痕后较Normal组明显增加(P<0.000 1、P<0.000 1),overexpresion-Fibulin2组迁移能力较Normal组下降(P<0.000 1、P<0.000 1),差异有统计学意义(图5)。Transwell实验显示,12 h和24 h细胞侵袭数量:七组之间比较,差异有统计学意义(F=170.7、F=239.4,P<0.05);Normal组与 Si-NC组之间以及与overexpresion-NC组之间细胞侵袭数量差异皆无统计学意义;Si1组较Normal组细胞侵袭数量增多(P<0.000 1),overexpresion-Fibulin2组较Normal组中细胞侵袭数量减少(P<0.000 1),差异有统计学意义(图6)。细胞凋亡率:七组之间比较,差异有统计学意义(F=134.3,P<0.05);经过沉默处理的Si1组其细胞凋亡率较Normal组明显下降(P<0.01),过表达处理的overexpresion-Fibulin2组较Normal组细胞凋亡率增高(P<0.01),差异有统计学意义;而Si-NC组及overexpresion-NC组与Normal组之间凋亡率未见明显变化(图7)。MTT增殖实验提示,12、24、72 h分别观察细胞OD490值:七组之间比较,差异有统计学意义(F=135.9、F=298.4、F=320.6,P<0.05);3个时间点Si1组OD值较 Normal组明显增高(P<0.000 1、P<0.000 1、P<0.0001),而 overexpresion-Fibulin2组 较 Normal组 OD值 显 著 下 调 (P<0.001、P<0.01、P<0.000 1),差异有统计学意义;Normal组较Si-NC组以及overexpresion-NC组之间差异皆无统计学意义(图8)。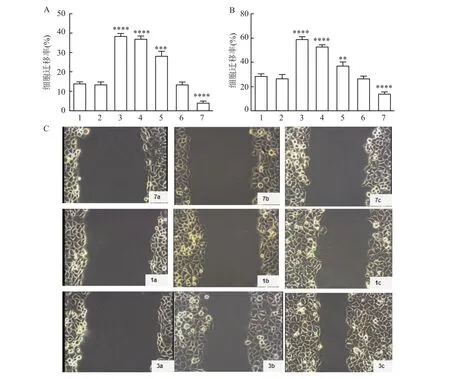
图5 各组细胞迁移率比较
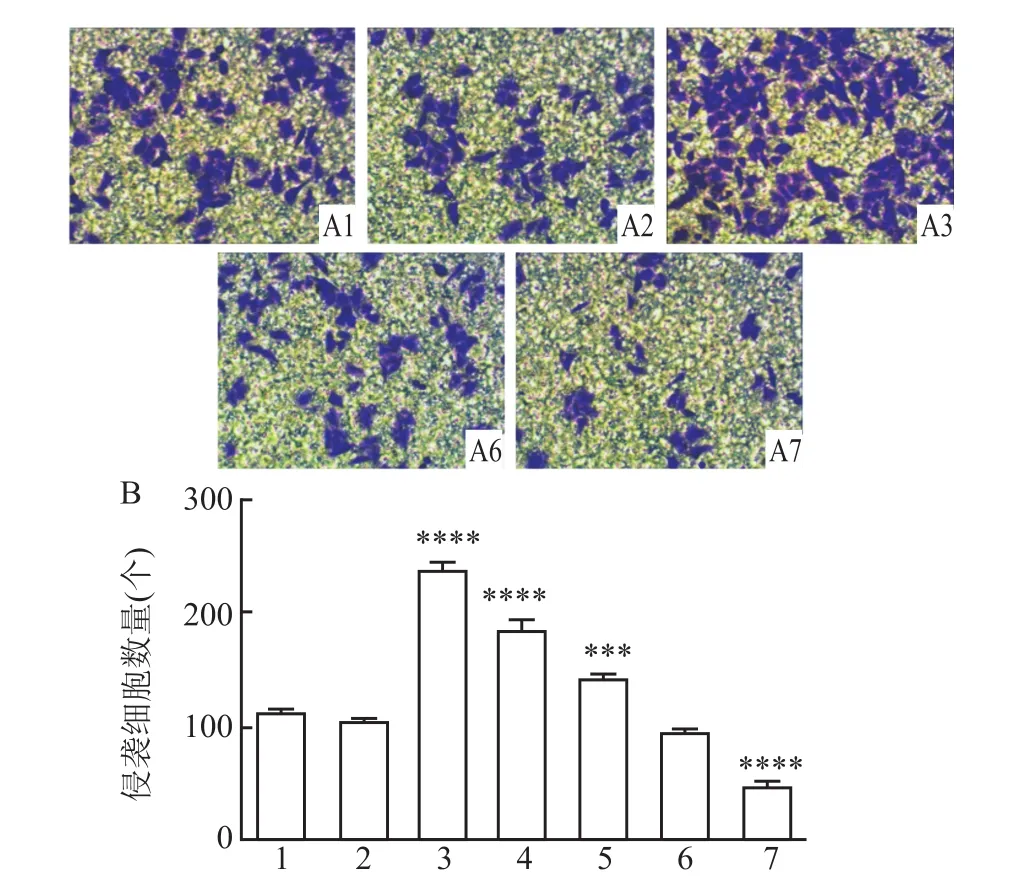
图6 HepG2各组细胞侵袭数量比较
3 讨论
Fibulin-2是Fibulin基因家族的主要成员之一,是一种与基底膜(basementmembrane,BM)和弹性ECM纤维相关的纤维蛋白,基因位于染色体3p25.1区域。癌症的侵袭和迁移是一个极其复杂的多因素作用过程,包括细胞与ECM的黏附、蛋白酶分泌、ECM降解和肿瘤细胞迁移等。已有大量研究证明Fibulin-2对肿瘤的进展具有重要作用,甚至在一些报道中出现了截然相反的结果。如在肺腺癌中,Baird et al发现突变的 K-ras和 p53小鼠(KP小鼠)共表达的肺腺癌细胞系中存在Fibulin-2的过度表达。Senapatiet al发现在胰腺癌中,MUC4的Nidogen样结构域与Fibulin-2结合,促进基底膜完整性的破坏,有助于胰腺癌细胞的扩散。在乳腺癌、卡波西肉瘤及鼻咽癌中,Fibulin-2又显示出抑制肿瘤进程的作用。而目前肝细胞癌与Fibulin-2的相关研究却鲜有报道。
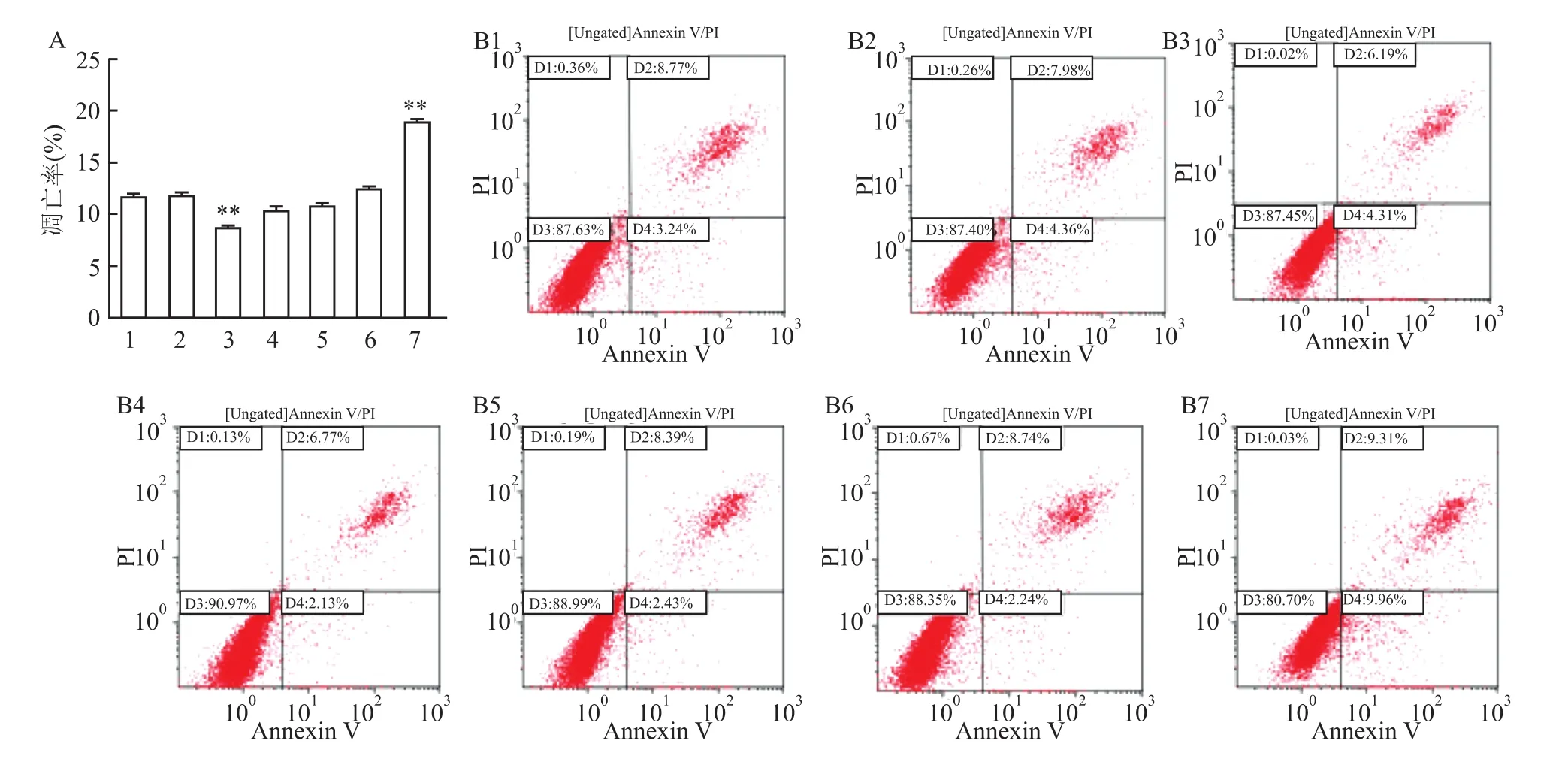
图7 HepG2各组细胞凋亡率比较

图8 HepG2各组细胞细胞增值率比较
为了探究Fibulin-2在肝细胞癌肿瘤进程中的影响,该研究通过对20份HCC癌组织和癌旁组织中Fibulin-2的表达水平采用Western blot和qRTPCR进行检测分析,结果表明Fibulin-2在癌组织中低表达,说明其在HCC中主要发挥着抑制肿瘤的作用。而通过细胞实验对Fibulin-2进行过表达和沉默处理后,观察到沉默Fibulin-2会增强肝癌细胞的生物学行为,反之过表达Fibulin-2可以抑制肝癌细胞的生物学行为。
肿瘤细胞分泌的蛋白酶如丝氨酸蛋白酶和基质金属蛋白酶(matrix metalloproteinase,MMPs)等通过宿主细胞和细胞外基质屏障,跨越组织边界进行侵袭是转移进展的关键第一步。MMPs作为ECM降解酶,最终影响ECM的动力学和基本的细胞行为如增殖能力、黏附能力、迁移能力、分化能力和凋亡。MMPs更是一种具有复杂底物特异性的降解酶,该特性为抗癌药物在肿瘤组织或其附近的局部控制释放提供了一条途径,而在 MMPs家族中,MMP-2(72 ku明胶酶A)和 MMP-9(92 ku明胶酶B)是两个重要成员,它们通过降解基底膜在肿瘤的发展进程中扮演着不可或缺的角色。众所周知,HCC有一个大的血管网络,基底膜的降解需要血管生成,而作为调节血管生成的重要因子VEGF在肝癌的进展过程中同样不可或缺。该研究中,MMP-2、MMP-9及VEGF的相对表达量在沉默Fibulin-2后皆明显增长,而过表达Fibulin-2后,三者皆下调。由此可见Fibulin-2作为一种与基底膜和弹性ECM纤维相关的纤维蛋白,其可能通过抑制MMP-2、MMP-9而降低细胞外基质屏障的破坏进而抑制肿瘤细胞跨越组织边界进行侵袭转移,同时通过抑制VEGF从而减少血管生成,起到抑制肿瘤转移、侵袭的作用。

