硅酸铜纳米颗粒作为化学动力学治疗剂的研究
陈 辉,肖建敏,许 瑞,吴正岩,邹多宏
恶性肿瘤现已成为威胁人类生命健康的第一杀手,其治疗方法主要包括外科手术、化学药物治疗等。手术治疗对已扩散的肿瘤治疗效果低且不彻底的肿瘤切除易导致肿瘤复发,而化学药物治疗杀伤癌细胞的同时也会导致正常组织细胞损伤,产生明显副作用。近年来,新型化学动力学治疗(chemodynamic therapy,CDT)受到广泛关注,其主要利用纳米粒子在癌细胞内促进芬顿反应诱导癌细胞死亡。已报道的CDT试剂在抗肿瘤效果方面与传统化疗药物仍存在一定差距,限制了其临床研究。因此,有必要开发新的高效、精准、安全的治疗方案。该研究期望利用Cu对介孔二氧化硅进行掺杂以制备出具有化学动力学疗效的硅酸铜纳米平台,提高肿瘤疗效,减少对人体正常组织的毒副作用。
1 材料与方法
1.1 试剂
正硅酸四乙酯(tetraethyl orthosilicate,TEOS)、CuSO·5HO、十六烷基三甲基溴化胺(cetyltrimethyl ammonium bromide,CTAB)、二乙胺购自上海阿拉丁公司;浓盐酸(HCl)、无水乙醇购自上海国药集团有限公司;细胞技术试剂盒(CCK-8)购自日本Dojindo公司。1.2 仪器
透射电子显微镜(JEM-ARM200F,日本Jeol公司);X射线衍射仪(TTR-Ⅲ,日本 Rigaku公司);动态光散射粒度分析仪(Nanotrac Wave Ⅱ,美国Microtrac公司);孔隙率分仪(TristarⅡ,3020M,美国Micromeritics公司);傅里叶红外光谱仪(iS10,美国Nicolet公司);电感耦合等离子体发射光谱仪(ICAP7200,美国 Thermo Fisher Scientific公司)。1.3 材料合成
1.3.1 介孔SiO的制备 首先,将1.5 g CTAB粉末加入60 ml的去离子水中混合后进行磁力搅拌,同时对其溶液加热至60℃保持20 min。随后,再将40μl的二乙胺加入上述溶液中且搅拌30 min。紧接着,将装有6 ml乙醇与3ml正硅酸四乙酯的混合溶液逐滴加入上述溶液中且保持60℃搅拌24 h。在搅拌24 h后,通过离心的方法将制备的纳米颗粒收集。最后将收集的纳米颗粒在HCl(37%)与乙醇的混合溶液(HCl∶乙醇=1∶9)中搅拌12 h。
1.3.2 CuSiO的制备 首先将介孔SiO(10 mg)加入30 ml的去离子水中搅拌20 min。随后,再将30 mg的 CuSO·5HO加入上述溶液中搅拌40 min。之后,将2 ml的氨水逐滴加入溶液中进行磁力搅拌。在搅拌30 min之后,将上述溶液转移至四聚氟乙烯反应釜中,140℃反应12 h。最后,将反应釜中的固体颗粒离心收集且用水和乙醇分别冲洗3次。
1.4 纳米材料的形貌及粒径测试
将一定量的SiO与CuSiO分别加入到装有4 ml无水乙醇的1号和2号试管中,在超声的作用下使其纳米颗粒在溶液中均匀分散。在分散之后,分别将1号与2号试管的溶液滴加到普通碳支持膜的铜网上。随后,利用透射电子显微镜观察纳米颗粒的形貌。此外,为了测试纳米颗粒的粒径,首先将一定量的SiO与CuSiO分别加入去离子水中,在超声的作用下,纳米颗粒在水溶液中均匀分散。随后,利用动态光散射粒度分析仪检测其粒径。1.5 纳米材料的结构与组分的检测
将合适量的SiO与CuSiO固体颗粒加入玛瑙研钵中进行研磨。研磨之后,纳米颗粒的粉末分为两部分:一部分通过X射线衍射仪检测纳米颗粒的晶体结构,另外一部分通过傅里叶红外光谱仪检测其组分。1.6 SiO生物安全性测定
使用含10%胎牛血清高糖DMEM培养基培养人牙龈成纤维细胞(human gingival fibroblasts,HGF),置于 37℃、5% CO恒温恒湿培养箱内培养。将培养好的HGF接种在96孔板中,置于37℃、5% CO恒温恒湿培养箱内培养至细胞增殖融合达孔底面积80%左右。接着换用不同浓度的SiO培养细胞,24 h后去除培养液,加入PBS轻轻洗涤细胞;然后每孔加入100μl含10% CCK-8培养液培养2 h,使用CCK-8试验测定细胞存活量。1.7 硅酸铜纳米颗粒的细胞毒性测定
使用含10%胎牛血清高糖DMEM培养液培养口腔鳞癌细胞(HSC3),置于37℃、5% CO恒温恒湿培养箱内培养。将培养好的HSC3分别接种在96孔板中,置于37℃、5% CO恒温恒湿培养箱内培养,至细胞增殖融合达孔底面积80%左右。接着换用不同浓度硅酸铜纳米材料培养细胞,24 h后去除培养液,加入PBS轻轻洗涤细胞;然后每孔加入100μl含10% CCK-8培养液培养2 h,使用CCK-8试验测定细胞存活量。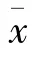
2 结果
2.1 纳米材料的形貌结构表征
2.1.1 纳米材料的透射电子显微镜图 介孔SiO纳米颗粒呈现出规则的球形,粒径均一,且在溶液中均匀分布。此外,其纳米颗粒的粒径大约为48 nm,且展现出明显孔道结构。见图1A、1B。CuSiO纳米颗粒呈现出不规则的梭形结构,见图1C、1D。与介孔SiO纳米颗粒的相比,CuSiO纳米颗粒表面存在较多的针状颗粒,CuSiO纳米颗粒的粒径要远大于介孔SiO纳米颗粒,见图1C、1D。此外,通过电感耦合等离子体原子发射光谱仪测试 Cu在CuSiO纳米颗粒中的质量分数为4.74%。
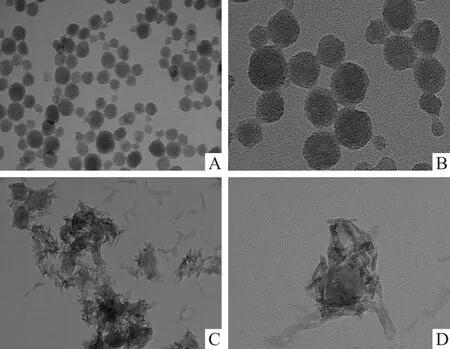
图1 不同纳米材料的透射电镜图
2.1.2 SiO与CuSiO材料表征 通过动态光散射粒度分析仪检测SiO与CuSiO纳米颗粒的水合粒径。介孔SiO纳米颗粒的水合粒径分布范围较为狭窄,其水合粒径为85.9 nm。CuSiO纳米颗粒的水合粒径为204.4 nm,其水合粒径也要远大于介孔SiO纳米颗粒,该结果与上述的透射电子显微镜图的结果相一致。见图2A。介孔SiO纳米颗粒的X射线衍射图出现一个大宽峰,提示SiO具有无定形晶体结构。并且纳米颗粒X射线衍射图还存在其他的峰,提示 Cu嵌入介孔 SiO形成 CuSiO。见图2B。
红外光谱图显示SiO与CuSiO纳米颗粒具有相同的组分。见图2C。在469 cm出现吸收带主要归属于CuSiO纳米颗粒中的Si-O键之间的弯曲振动。相对于SiO纳米颗粒的Si-O的弯曲振动峰,CuSiO纳米颗粒中的Si-O弯曲振动峰发生了明显的偏移,归属于Cu的嵌入。此外,在797 cm出现的吸收带是Si-O-Si的对称伸缩振动峰。其中,1 039 cm处的吸收峰是Si-O的不对称伸缩振动峰,其中2 856 cm与2 922 cm处的吸收带归属于C-H键的伸缩振动所产生的。
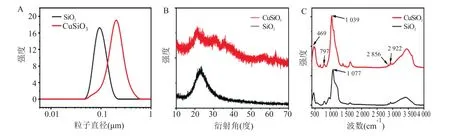
图2 SiO2与CuSiO3材料表征
2.1.3 SiO与CuSiO纳米材料X射线能谱分析SiO的X射线光电子能谱图没有展现出Cu元素的存在。然而,CuSiO纳米颗粒的X射线光电子能谱图展现出了Si、Cu、O元素的存在,显示Cu成功掺杂进入SiO纳米颗粒中。见图3A。与SiO中的Si2p与O 1s峰相比,经Cu的掺杂,CuSiO纳米颗粒中Si2p与O 1s峰发生了明显的偏移。见图3B、3D。此外,935.7 eV(Cu 2p)的峰显示 CuSiO纳米颗粒中铜离子的价态为正二价。见图3C。
2.1.4 SiO和CuSiO比表面积及孔径分布 利用孔隙率分仪测量介孔SiO与CuSiO纳米颗粒的氮吸附-脱附等温曲线,进一步获得纳米颗粒的比表面积。介孔SiO展出较大的比表面积。见图4A。其次,介孔SiO的孔径大约是18.9 nm,见图4C。使用Cu铜离子对介孔SiO纳米颗粒进行掺杂,大大降低了纳米颗粒的比表面积和孔径,CuSiO的比表面积要远小于介孔SiO,见图4B、4D。
2.2 SiO的生物相容性研究
通过CCK-8试验评价SiO对细胞的毒性以研究SiO的生物相容性。分别使用不含SiO纳米粒子的培养基(对照组,SiO纳米粒子浓度0μg/ml)和含不同浓度SiO纳米粒子的培养基培养牙龈成纤维细胞(实验组,SiO纳米粒子浓度分别为 9.375、18.75、37.5、75、150、300、600μg/ml),培养时间为24 h。随后比较对照组(SiO纳米粒子浓度0μg/ml)与实验组(含不同浓度SiO纳米粒子)细胞存活率,进行单因素方差分析。由24 h的数据显示,细胞存活率差异无统计学意义(F=1.699,P=0.157)。见图5。以上结果表明SiO纳米粒子具有很好的生物相容性。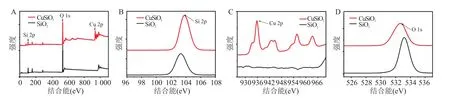
图3 SiO2与CuSiO3 X射线能谱分析
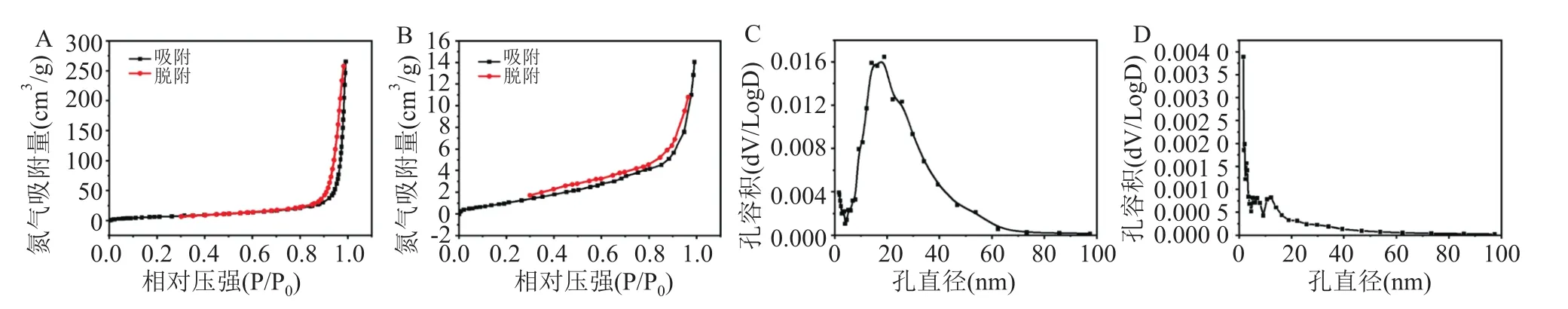
图4 SiO2和CuSiO3氮吸附-脱附等温曲线及孔径分布图
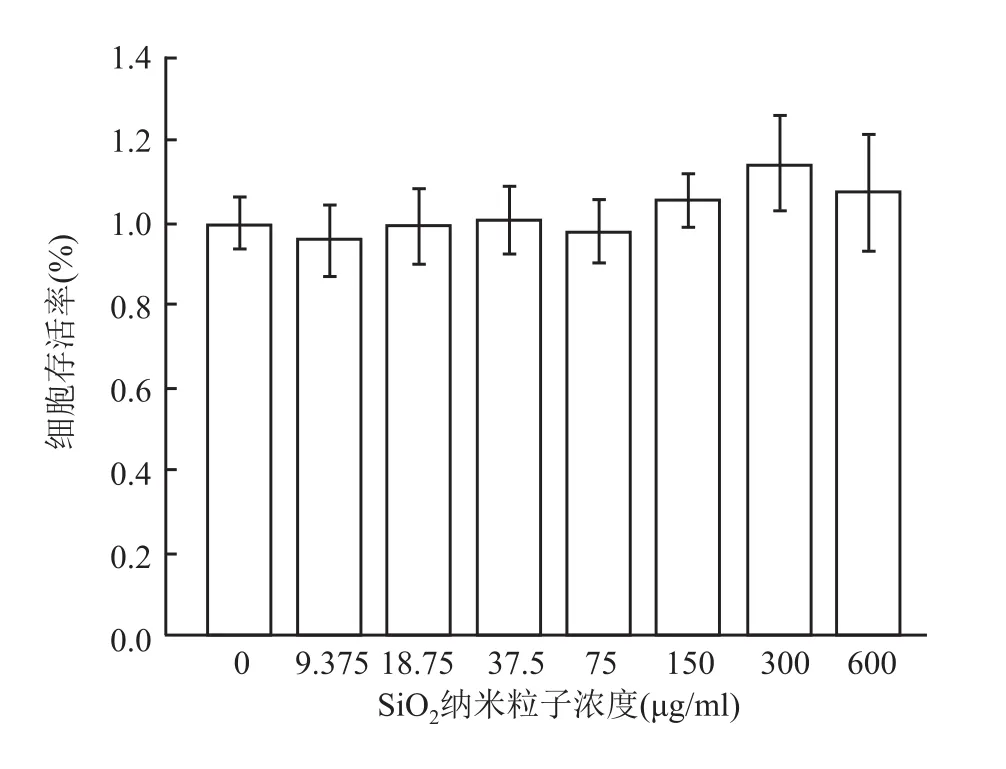
图5 不同浓度SiO2纳米颗粒与牙龈成纤维细胞共同培养24 h细胞存活率
2.3 硅酸铜纳米材料的细胞毒性研究
用CCK-8试验研究和评价硅酸铜纳米材料对肿瘤细胞HSC3的毒性。分别使用不含CuSiO纳米粒子的培养基(对照组,CuSiO纳米粒子浓度0μg/ml)和含不同浓度CuSiO纳米粒子的培养基培养HSC3肿瘤细胞(实验组,CuSiO纳米粒子浓度分别为9.375、18.75、37.5、75、150、300、600μg/ml),培养时间为24 h。随后比较对照组(0μg/ml)与实验组(含不同浓度CuSiO纳米粒子)细胞存活率,进行单因素方差分析。由24 h的数据显示,细胞存活率差异有统计学意义(F=22.248,P<0.05),细胞存活率降低。见图6。以上表明硅酸铜纳米材料对口腔癌细胞具有一定的杀伤作用。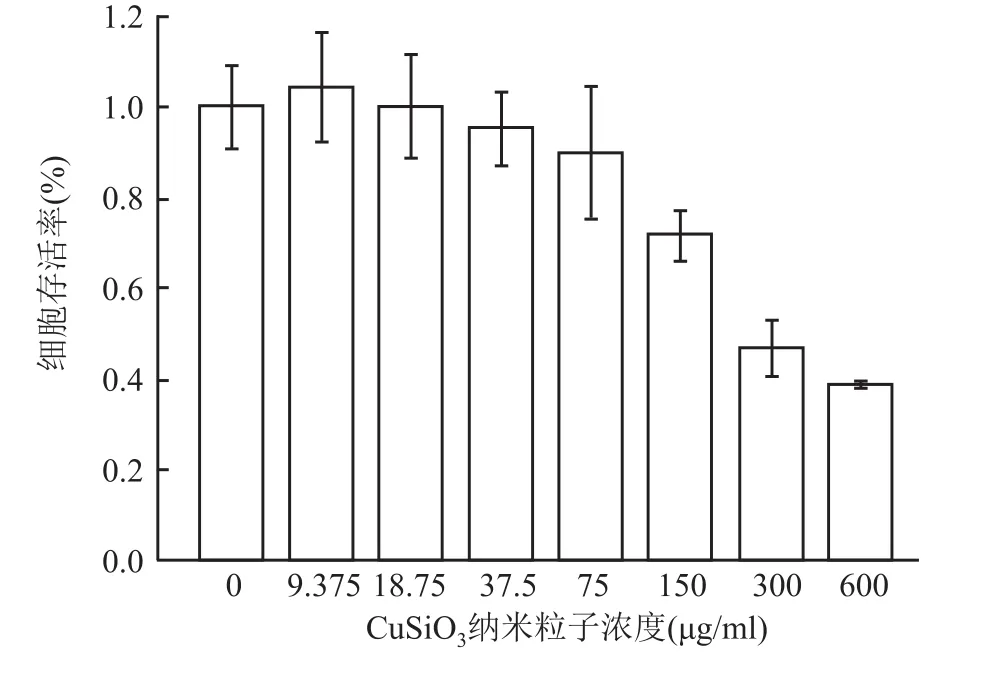
图6 不同浓度下硅酸铜纳米颗粒与HSC3细胞共同培养24 h细胞存活率
3 讨论
当前,恶性肿瘤患者数目逐增,病况愈加复杂,临床常见手术治疗切除组织多且易复发,化学治疗对患者副作用较大,传统肿瘤疗法已渐显不足。近年来,开发安全、高效、智能化的治疗手段已成为医药领域研究热点之一。纳米技术的不断创新为发展一种安全高效的肿瘤治疗手段提供了新思路,该技术借助化学动力学治疗剂在癌细胞内发生芬顿/类芬顿反应产生大量羟基自由基。该羟基自由基具有一定的细胞毒性,会破坏胞内蛋白、DNA和细胞膜的结构,从而诱导癌细胞的死亡。同时,癌细胞内外的微酸环境可加快芬顿/类芬顿反应的发生,提高癌细胞内羟基自由基的产生数量,进一步促进癌细胞的死亡,提高化学动力学治疗剂对肿瘤的治疗效果。
本研究参考文献制备出了高比表面积和孔径的介孔SiO,该纳米颗粒在水溶液中均匀分布且具有优异的分散性,其颗粒的水合粒径大约为85.9 nm。生物相容性检测表明了介孔SiO有良好的生物相容性,可以安全地应用于人体。随后,将Cu与介孔SiO溶液混合进行水热反应。在碱性和高温条件下,游离的Cu掺杂进入介孔SiO结构中,形成CuSiO纳米颗粒;该纳米颗粒的水合粒径为204.4 nm左右,对口腔癌细胞展现出较强的抗肿瘤效果,是一个理想的CDT试剂。透射电子显微镜图显示,与介孔SiO纳米颗粒相比,CuSiO纳米颗粒表面存在较多的针状颗粒,这主要是由于Cu嵌入介孔SiO所导致。由动态光散射粒度分析仪的结果可知CuSiO纳米颗粒的水合粒径为204.4 nm,远大于介孔SiO纳米颗粒的水合粒径85.9 nm,该结果与透射电子显微镜图结果一致;纳米颗粒的水合粒径分布范围较窄,表明该纳米颗粒具有均一的粒径,在溶液中具有较好的稳定性。随后的红外光谱图显示合成的CuSiO纳米颗粒中Si-O弯曲振动峰发生明显偏移,表明了Cu嵌入成功。红外光谱图和X射线衍射仪检测确定了本研究所合成的材料为CuSiO纳米颗粒,符合纳米制剂要求。比表面积和孔径分析显示SiO比表面积较大,这将有利于 SiO与溶液中的 Cu相接触,加快 Cu对SiO的掺杂;CuSiO纳米颗粒具有一定的孔道结构,有利于其与癌细胞中的谷胱甘肽以及过氧化氢相接触,进一步加快类芬顿反应的发生,提高癌细胞内羟基自由基的数量,促进癌细胞的死亡。细胞实验结果表明SiO的生物相容性良好,负载Cu后形成的硅酸铜纳米材料在肿瘤细胞微酸环境中可释放Cu,产生肿瘤细胞杀伤作用。该材料肿瘤杀伤效能源于硅酸铜纳米材料的化学动力疗效及肿瘤组织本身存在的高渗透长滞留效应,即纳米材料更易在肿瘤组织处富集,且其在肿瘤组织细胞酸性微环境中会响应性地释放出Cu,促使细胞内芬顿/类芬顿反应发生,诱导癌细胞的死亡,其在临床应用中有pH响应定点释放、靶向治疗的意义。
综上所述,CuSiO纳米颗粒对肿瘤细胞可产生较明显的杀伤作用,该纳米颗粒可作为一种新型的化学动力学治疗剂对肿瘤进行化学动力学治疗,拥有着广泛的抗肿瘤应用前景。

