姜黄素通过PI3K/p53信号通路调控人胃癌细胞SGC-7901的增殖、凋亡和周期
李淑兰,贺倩倩,宫凯凯,满玉清
胃癌(gastric cancer,GC)作为全球常见的恶性肿瘤之一,正威胁着全球人的健康。GC的早期症状不突出,临床早期诊断率低及手术治疗效果不佳是如今困扰医学界的主要难题。在现代医学中,包括紫杉醇在内的多种中药提取物已被证明能有效治疗GC;然而,许多该类药物不能有效清除所有肿瘤细胞,这往往预示着预后不良。因此,目前迫切需要寻找有效、安全的抑制肿瘤增殖、迁移的预防药物。如今,许多常用的药物都是从天然产品中提取的,姜黄素(Curcumin,Cur)作为重要的天然产物之一,逐渐成为医药学家研究的主要课题。近几十年来,Cur在肿瘤治疗中的作用已被广泛研究,包括诱导细胞凋亡、抑制血管生成、提高化疗和放疗的敏感性。研究显示:Cur在 GC中能逆转化疗药物的耐药性,抑制癌细胞增殖,抑制侵袭;且相当多的证据表明Cur具有多种分子靶点,包括STAT3、ROS、NF-κB转录因子和环氧合酶-2等。该研究旨在通过观察不同浓度的Cur处理下,GC细胞增殖、凋亡及周期变化情况,进而探究其治疗GC新的分子机制。
1 材料与方法
1.1 主要试剂与仪器
RPMI 1640培养基、胎牛血清FBS、青链霉素购自美国Gibco公司;姜黄素、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT)细胞增殖及细胞毒性检测试剂盒购于北京索莱宝公司;Hoechst 33258染色试剂盒、PI单染细胞周期检测试剂盒、Annexin V-FITC/PI双染细胞凋亡检测试剂盒购于上海碧云天公司;全蛋白提取及BCA法蛋白定量测定试剂盒购自南京建成生物技术有限公司;抗PI3K、Akt和p-Akt兔一抗购自英国Abcam公司;抗p21、p53及β-actin兔一抗和山羊抗兔IgG二抗购自武汉三鹰公司。3111型CO培养箱为美国Thermo公司产品;倒置显微镜为日本尼康公司产品;凝胶处理分析系统为美国ABI公司产品;酶标仪为美国Bio-Tek公司产品;FC500型流式细胞仪为美国Beckman公司产品。1.2 细胞培养
人胃癌细胞株SGC-7901购自中科院细胞库。细胞培养在含有10%胎牛血清、100 U/ml青霉素、100μg/ml链霉素的 RPMI 1640完全培养基中;培养条件:37℃、5% CO及饱和湿度的培养箱中培养。根据细胞生长状态定期换液,待细胞接近长满培养瓶底部时,用0.25%的胰酶消化传代。在药物处理实验开始之前,需对细胞进行同步化处理后再进行分组及药物处理。1.3 MTT法检测Cur对SGC-7901细胞的增殖抑制作用
取生长处于对数期的SGC-7901细胞,按照1.0×10/ml浓度接种于12孔培养板中。将细胞分为 4组,分别为对照组(0μmol/L Cur)、10 μmol/L Cur处理组、20μmol/L Cur处理组、40 μmol/L Cur处理组,每组设置3个平行复孔。37℃、5% CO和饱和湿度的培养箱中培养72 h,分别在24、48、72 h取样,按MTT法操作处理后测量各孔细胞在490 nm处的吸光度(OD);计算各组细胞在不同时间点的增殖抑制率,抑制率(%)=(1-药物组OD值/对照组OD值)×100%。以时间点为横坐标,以抑制率为纵坐标,绘制各组细胞的增殖抑制率变化统计图并分析。1.4 Hoechst33258荧光染色观察SGC-7901细胞凋亡状况
采用Hoechst 33258荧光染色的方法检测细胞凋亡状况:取生长处于对数期的SGC-7901细胞,按照1.0×10/ml浓度接种于24孔培养板中。将细胞按上述1.3操作分为4组。药物与细胞共孵育48 h后,收集各组细胞,按Hoechst 33258染色试剂盒操作,依次经过固定、洗涤、制片、染色、去染及淬灭后于荧光显微镜下观察细胞核形态并拍照。1.5 Annexin V-FITC/PI双染检测 SGC-7901细胞凋亡水平
取生长处于对数期的SGC-7901细胞,按照1.0×10/ml浓度接种于24孔培养板中。将细胞按上述1.3操作分为4组,共培养48 h后,根据Annexin V-FITC/PI双染试剂盒操作检测各组细胞凋亡率:1 000 r/min离心5 min,弃上清液,收集细胞;加入1 ml预冷的PBS,轻轻震荡使细胞悬浮,1 000 r/min,4℃离心 5 min,弃上清液,重复 2次;将细胞重悬于200μl的结合缓冲液;加入10μl Annexin V-FITC和10μl PI,轻轻混匀,4℃避光孵育30 min;加入300μl结合缓冲液,随即进行流式细胞仪检测;使用CXP分析软件进行分析并记录结果。总凋亡率=(第二象限B2细胞占比+第四象限B4细胞占比)。1.6 PI单染检测SGC-7901细胞周期变化
按上述1.3操作对各组细胞进行分组及对应处理。然后根据PI细胞周期流式检测试剂盒说明书进行操作:收集培养48 h后的各组细胞,分别用胰蛋白酶进行消化处理;用1×PBS溶液浸洗2次,移至1.5 ml离心管中;加入冰冷70%乙醇3 ml固定细胞,4℃放置24 h;用冷PBS清洗细胞2次,1 000 r/min离心5 min,弃上清液;加入1 ml PI染液(含核糖核酸酶),轻轻震荡混匀,室温下避光放置30 min;用流式细胞仪进行上机检测;使用CXP分析软件进行分析并记录结果。1.7 Western bolt检测 SGC-7901细胞中 PI3K/p53信号通路相关蛋白的表达
收集培养48 h后的各组细胞,采用全蛋白提取试剂盒进行蛋白提取;用BCA蛋白浓度检测试剂盒检测蛋白浓度;取20 μg蛋白和4μl 2×SDS缓冲液混合均匀,100℃变性10 min;上样,SDS-PAGE凝胶电泳分离后转至PVDF膜上;用5%脱脂牛奶封闭1 h;PBS洗膜;PBS洗膜后分别加入一抗(PI3K,1∶1 000;p-Akt,1∶1 000;Akt,1∶2 000;p53,1∶1 000;p21,1∶1 000;β-actin,1∶1 500),在 4℃下孵育过夜;PBS洗膜;加入HRP标记的IgG二抗(1∶5 000)室温孵育0.5 h;PBS洗膜;用ECL化学放光进行显色。以β-actin为内参蛋白,后采用Quantity One图像分析软件进行灰度比(蛋白相对表达水平)分析。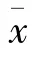
2 结果
2.1 Cur处理对SGC-7901细胞增殖的影响
本研究设不同浓度梯度的 Cur(0、10、20、40μmol/L)处理组,以MTT法检测SGC-7901细胞不同时间点(24、48、72 h)增殖抑制率。结果显示:24 h时各处理组细胞增殖抑制率分别为(3.70±1.44)、(9.23±0.63)、(14.40±1.14);48 h时各处理组细胞增殖抑制率分别为(9.77±1.43)、(21.79±0.76)、(27.40±0.36);72 h时各处理组细胞增殖抑制率分别为(12.33±0.87)、(27.42±1.18)、(34.20±0.49)。与同时间点10μmol/L的Cur处理组比较,20μmol/L、40μmol/L的 Cur处理组细胞增殖抑制率均增加(F=37.70、176.73、313.25,P<0.01);与同时间点20μmol/L的 Cur处理组比较,40μmol/L的Cur处理组细胞增殖抑制率均增加(F=20.32、89.80、56.08;P<0.05,P<0.01)。提示 Cur呈一定的剂量依赖性抑制SGC-7901细胞的增殖(图1)。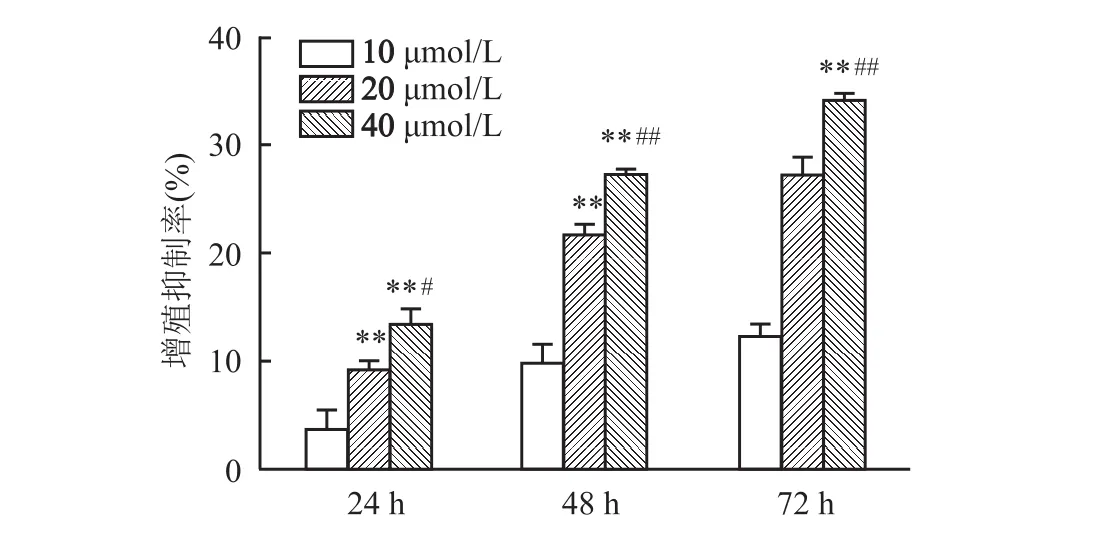
图1 Cur对SGC-7901细胞增殖的影响
2.2 Cur处理对SGC-7901细胞凋亡的影响
本研究设不同浓度梯度的 Cur(0、10、20、40μmol/L)处理组,以Hoechst33258染色法及Annexin V-FITC/PI双染法检测SGC-7901细胞的凋亡状况。Hoechst 33258染色结果显示(图2):对照组细胞细胞核轮廓清晰可见,小核及染色质浓缩现象不突出;而Cur梯度处理组细胞细胞核染色呈亮白色,蓝色荧光强度降低,染色质浓缩现象加重,其中尤以40μmol/L Cur处理组效果最突出。流式细胞术结果显示(图3):4组细胞凋亡率依次分别为(4.69%±0.85%)、(14.57% ±1.05%)、(27.52% ±1.22%)和(34.46%±1.91%);与对照组比较,3个 Cur梯度处理组细胞总凋亡率均增加(F=106.05、468.01、405.60,P<0.01);与 10μmol/L Cur处理组比较,20、40μmol/L Cur处理组细胞总凋亡率均上升(F=128.77、166.69;P<0.01);与 20μmol/L Cur处理组比较,40μmol/L Cur处理组细胞总凋亡率上升(F=128.78,P<0.05)。结果提示Cur呈剂量依赖性促进SGC-7901细胞凋亡。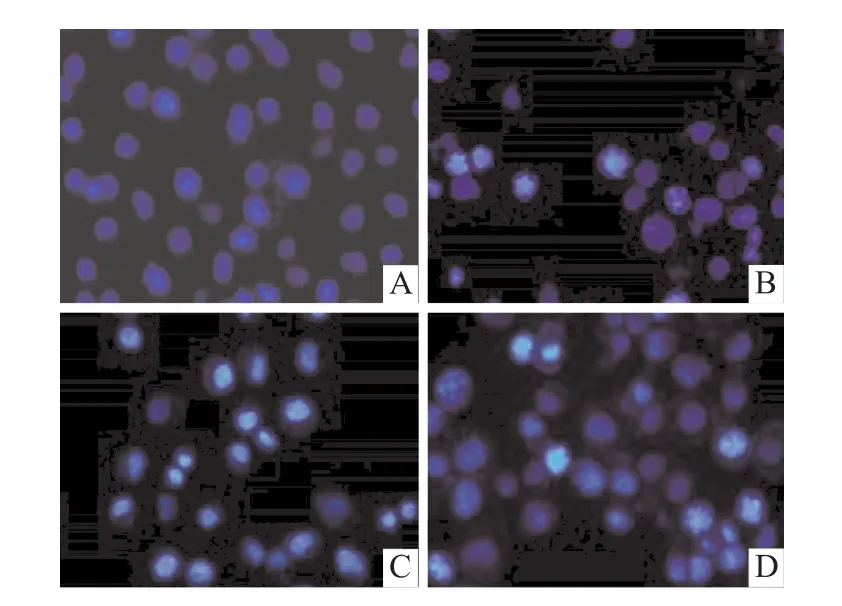
图2 Hoechst 33258荧光染色 ×400
2.3 Cur处理促进 SGC-7901细胞发生 G/G期细胞阻滞
为检测Cur对SGC-7901细胞周期的影响,本研究设不同浓度梯度的 Cur(0、10、20、40 μmol/L)处理组,以PI单染法检测SGC-7901细胞的周期变化。结果显示(图4):4组细胞G/G期细胞占比依次分别为(32.93% ±1.16%)、(42.49% ±1.07%)、(57.12% ±1.41%)和(69.24%±2.28%);与对照组比较,3个 Cur梯度处理组细胞G/G期细胞占比均增加(F=73.47、349.87、403.83,P<0.01);与 10μmol/L Cur处理组比较,20、40μmol/L Cur处理组细胞 G/G期细胞占比均上升(F=135.92、225.97,P<0.01);与20 μmol/LCur处理组比较,40μmol/LCur处理组细胞G/G期细胞占比同样上升(F=40.90,P<0.01)。结果提示Cur呈剂量依赖性影响细胞周期进程,主要表现为G/G期细胞阻滞。
图3 Cur对SGC-7901细胞凋亡的影响
2.4 Cur处理对SGC-7901细胞PI3K/p53信号通路的影响
为探究Cur对SGC-7901细胞增殖、凋亡和周期影响的分子机制,本研究采用Western blot检测了PI3K/p53信号通路相关蛋白的表达。结果显示(图5),4组各指标蛋白相对表达量分别为[PI3K:(0.41±0.01)、(0.32±0.01)、(0.25±0.01)、(0.19±0.01);p-Akt/Akt:(0.85±0.01)、(0.73±0.02)、(0.54±0.02)、(0.32±0.01);p53:(0.23±0.02)、(0.29±0.01)、(0.37±0.02)、(0.57±0.01);p21:(0.24±0.02)、(0.32±0.01)、(0.36±0.01)、(0.49±0.02)]。与对照组比较,3个 Cur梯度处理组细胞PI3K蛋白表达量、p-Akt水平均降低(F=132.95、358.94,P<0.01),而 p21和 p53蛋白表达量均升高(F=119.88、243.38;P<0.01);与10 μmol/L Cur处理组比较,20、40μmol/L Cur处理组细胞PI3K蛋白表达量、p-Akt水平均降低(F=70.65、234.06,P<0.01),而p21和p53蛋白表达量均升高(F=81.15、217.42;P<0.05,P<0.01);与20μmol/L Cur处理组比较,40μmol/L Cur处理组细胞PI3K蛋白表达量、p-Akt水平均降低(F=36.10、124.27,P<0.01),而p21和p53蛋白表达量均升高(F=84.05、195.84,P<0.01)。提示 Cur呈剂量依赖性抑制PI3K信号通路的活化,同时激活p53。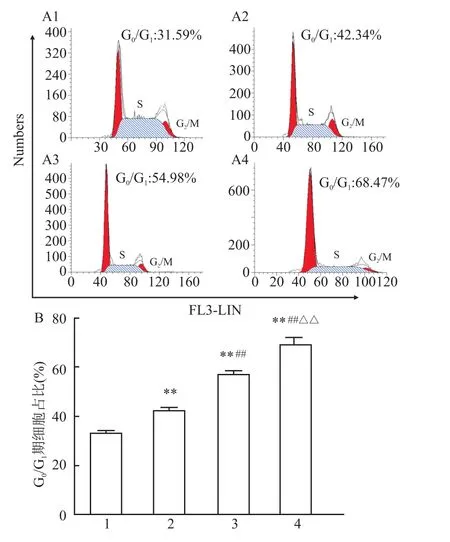
图4 Cur对SGC-7901细胞周期的影响
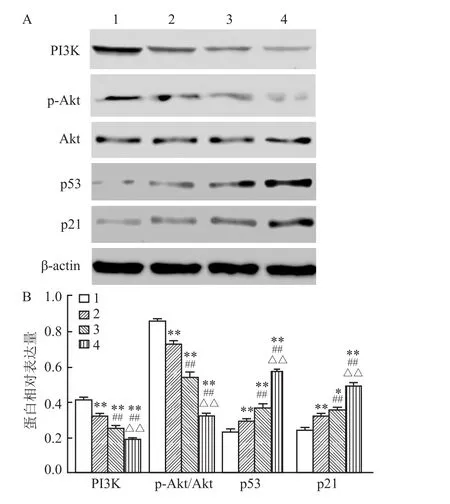
图5 Cur对SGC-7901细胞PI3K/p53信号通路的影响
3 讨论
本实验研究了Cur对GC细胞SGC-7901增殖、凋亡和周期的影响,同时还探讨了Cur的作用机制与PI3K/p53通路的关系。结果表明 Cur能抑制SGC-7901细胞的增殖效应,通过诱导细胞发生G/G期阻滞进而促进其凋亡进程。
本研究中的Cur是一种天然植物化学物质,能够抑制GC细胞中PI3K通路,激活p53,从而诱导凋亡。已有研究证实PI3K是GC的致癌基因,p53是GC的抑癌基因,这在一定程度上支持了本研究结果的可信性。有研究表明,Cur可以通过多种生物学过程抑制GC,包括肿瘤发生、周期、增殖、凋亡以及侵袭调控等。在本研究中,MTT结果显示Cur呈剂量依赖性的抑制GC细胞SGC-7901增殖,Hoechst33258荧光染色结果显示癌细胞核染色质固缩严重,且亮蓝色荧光强度随Cur浓度的增加而逐渐减弱。随后的流式细胞凋亡检测结果进一步证实了Cur对SGC-7901细胞的促凋亡作用与其对细胞的周期调控密切相关,主要表现为促使细胞发生G/G期阻滞。
目前,Cur对GC细胞的分子机制的研究较多。Sun et al证实,Cur可通过上调胃肿瘤细胞 miR-33b水平进而抑制肿瘤细胞生长,诱导凋亡。同时,Cur可以下调NF-κB信号通路和激活 Ras/ERK信号通路增强人类GC细胞的药物敏感性。此外,Cur还能通过调控NF-κB/VEGF信号通路抑制间充质干细胞介导的血管生成进而抑制 GC发生。Cur类似物CH-5同样能抑制人GC细胞株HGC-27的增殖、迁移和侵袭,其机制被证实与下调基质金属蛋白酶2的表达和胶原酶活性有关。该研究中,对于Cur作用机制的研究针对的是PI3K/p53通路。肿瘤抑制蛋白p53能够通过调控包括细胞周期阻滞、细胞凋亡和DNA修复等在内的微观机制抑制癌细胞生长。譬如,p53可抑制人类结直肠癌、肺癌、卵巢癌和GC的细胞增殖、迁移和侵袭。相反,PI3K在乳腺癌、子宫内膜癌、肺癌及GC等多种癌症中扮演着癌症促进作用,而p53是其下游负调控靶基因。PI3K信号通路是细胞内信号通路的重要协调因子,可以调节多种信号通路,包括细胞增殖、迁移和代谢等。Xu et al证实,Cur通过下调PI3K信号通路抑制甲状腺癌细胞的侵袭。在食管癌相关研究中,Cur被证明通过调节 PI3K/Akt/mTOR信号通路有效抑制食管癌细胞Ec-9706的增殖过程。该研究中通过Western blot检测在Cur的处理下,SGC-7901细胞PI3K/p53通路相关蛋白的表达变化情况。结果显示随着Cur浓度的增加,GC细胞中PI3K蛋白以及p-Akt水平逐渐下调。然而,p53及相关蛋白p21表达增加,表明Cur是通过抑制PI3K信号通路的活化进而促进p53的激活。

