结缔组织生长因子/聚L-乳酸纳米微球的制备及其体外释药特性研究
程义成,孔祥伟,梅盛林,尹 伟,王晨辰,刘向辉
种植体周围感染是引起种植失败的主要原因之一。牙科种植体是一个穿龈的结构,其上半部分暴露在口腔这个有菌环境中,因此种植体基台与软组织结合的部位成为了细菌入侵的最主要途径。种植体要维持长期稳定地行使功能,其穿龈的基台部与软组织尽快形成稳定、有效的软组织生物学封闭维持至关重要。然而目前临床上种植体基台多为光滑表面,难以形成并维持稳定的软组织生物学封闭。研究表明结缔组织生长因子具有良好的促进成纤维细胞黏附、增殖的作用。该研究以聚L-乳酸为载体材料,拟制备结缔组织生长因子/聚L-乳酸纳米微球,对微球特性及体外释药性能进行研究,为下一步在种植体基台表面构建促进软组织封闭涂层奠定实验基础。
1 材料与方法
1.1 材料与仪器
结缔组织生长因子(connective tissue growth factor,CTGF)(美国 Sigma-Aldrich公司);聚 L-乳酸[poly(L-lactic acid),PLLA,数均相对分子质量152 000]、聚乙烯醇(poly vinyl alcohol,PVA)(美国 Sigma-Aldrich公司);二氯甲烷(色谱纯,天津协和试剂公司);CTGF ELISA试剂盒(美国Ray Biotech公司);其他化学试剂为国产分析纯;超声波细胞粉碎仪(JY92-IIN型,宁波新芝生物科技有限公司);场发射扫描电子显微镜(S-4800型,日本日立公司);激光粒径分析仪(Mastersizer 2000型,英国 Malvem Instruments公司);台式高速离心机(TGL-16G型,上海医用分析仪器厂);冷冻干燥器(FD-1型,北京博医康技术公司);微量电子天平(FA135S型,上海精密科学仪器有限公司);振荡培养箱(HZQ-x100型,哈尔滨市东联电子技术开发有限公司);恒温定时磁力搅拌器(上海精科仪器厂);超声波清洗器(TI-H160型,德国Elma公司)。1.2 方法
1.2.1 CTGF/PLLA纳米微球的制备 采用复乳法(W/O/W)制备 CTGF/PLLA纳米微球。超声作用下将5 mg CTGF溶于0.2 ml去离子水中作为内水相(W);100 mg PLLA溶于2 ml二氯甲烷中作为油相(O)。将内水相逐滴加入油相中,在冰水浴中利用超声波细胞粉碎仪超声乳化(功率80 W)1 min形成初乳(W/O)。在形成的初乳中加入10 ml 1%的PVA水溶液(外水相W),继续在冰水浴中利用超声波细胞粉碎仪超声乳化(功率80 W)1 min形成复乳(W/O/W)。将得到的 W/O/W乳液快速加入到100 ml 0.5%的PVA水溶液中以500 r/min转速磁力搅拌4 h,以除尽二氯甲烷。微球经固化后,15 000 r/min转速下离心20 min,分离收集微球,并用蒸馏水洗涤3次以除去微球表面残留的PVA,再经离心冷冻干燥后得到微球粉末。
1.2.2 CTGF/PLLA纳米微球粒径的测定 取一定量的干燥CTGF/PLLA纳米微球在去离子水中超声分散20 min后,应用激光粒度分布测试仪测定其粒径及多分散系数。
1.2.3 CTGF/PLLA纳米微球包封率和载药量的测定 精确称量10mg CTGF/PLLA纳米微球加入到5 ml乙晴中,超声处理以加速微球溶解,待微球完全溶解后,以15 000 r/min离心10 min后取沉淀加入10 ml蒸馏水超声处理,用ELISA法测定所得水溶液中CTGF含量。纳米微球的载药量和包封率公式如下:

1.2.4 CTGF/PLLA纳米微球表面形貌观察 取少量的CTGF/PLLA纳米微球在去离子水中超声分散20 min后,均匀滴在清洁玻片上,干燥喷金后场发射扫描电镜观察微球表面形貌。
1.2.5 CTGF/PLLA纳米微球释药特性研究 本实验选择磷酸盐缓冲液(phosphate-buffered saline,PBS,pH=7.4)溶液作为释药介质。精密称取CTGF/PLLA纳米微球20 mg(约含有CTGF 0.685 mg)超声使其悬浮于5 m l PBS缓冲液中,再转移到透析袋(截留物质相对分子质量>1 000)内,放入盛有100 m l PBS缓冲液的三角烧瓶内,密封后置于振荡培养箱中恒速振荡(37℃,100 r/min),在预定的时间点从袋外缓冲液中取样1 m l,并立即补加等量同质同温PBS。同样用ELISA法测定取样中CTGF含量,从而计算其释放浓度和累计释放百分率,并绘制释药曲线。作为对照组,将含有0.685 mg CTGF粉末的5 m l PBS转移至透析袋中,也在同样的条件下进行实验。
1.2.6 CTGF/PLLA纳米微球降解形貌观察 按照1.2.5方法将CTGF/PLLA纳米微球放入透析袋内置于PBS中,分别在1、10、20、30 d时从透析袋里取出少量悬浊液,超声分散在去离子水中后均匀滴在清洁玻片上,干燥喷金后场发射扫描电镜观察微球降解形貌。
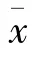
2 结果
2.1 CTGF/PLLA纳米微球粒径
应用激光粒度分布测试仪测定CTGF/PLLA纳米微球平均粒径为(376.5±18.2)nm,多分散系数为(0.152±0.009),其粒径分布图见图1。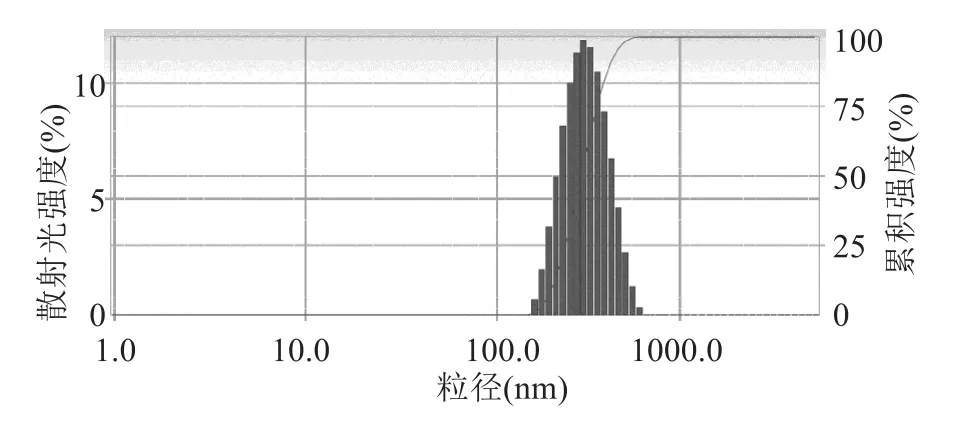
图1 CTGF/PLLA纳米微球粒径分布图
2.2 CTGF/PLLA纳米微球包封率和载药量
根据公式计算,CTGF/PLLA纳米微球包封率为(68.62±1.34)%,载药量为(34.26±0.73)μg/mg。2.3 CTGF/PLLA纳米微球表面形貌
图2为载药微球经干燥喷金后经场发射扫描电镜观察到的表面形貌照片。低倍镜下(图2A)可见所有微球均呈现良好的球面形态,彼此无任何粘连和聚合,粒径分布比较均匀,与粒径测试结果一致;高倍镜下(图2B)可见微球外形圆整,无明显的裂纹和孔隙。
图2 CTGF/PLLA纳米微球扫描电镜图
2.4 CTGF/PLLA纳米微球释药曲线
CTGF/PLLA纳米微球释药曲线见图3,可见微球释药特性表现为初期CTGF的快速释放和随后的缓慢释放。快速释放主要集中在前12 h,而随后的药物缓慢释药时间长达30 d。在各时间点,CTGF粉末中CTGF累积释药量均显著高于载药纳米微球(P<0.01)。作为对照组,在前12 h,有90.4%的CTGF自CTGF粉末中释放。2.5 CTGF/PLLA纳米微球降解形貌
图4为CTGF/PLLA纳米微球降解过程中的扫描电镜图片。可见在降解1 d后微球表面变得粗糙(图4A);降解10 d后微球表面变得更加粗糙并且出现了较多的皱褶(图4B);降解20 d后微球的球面形貌出现了明显的变形(图4C);而降解30 d后微球已经完全变形,基本丧失了球状形貌(图4D)。
图3 CTGF/PLLA纳米微球与CTGF粉末释药曲线
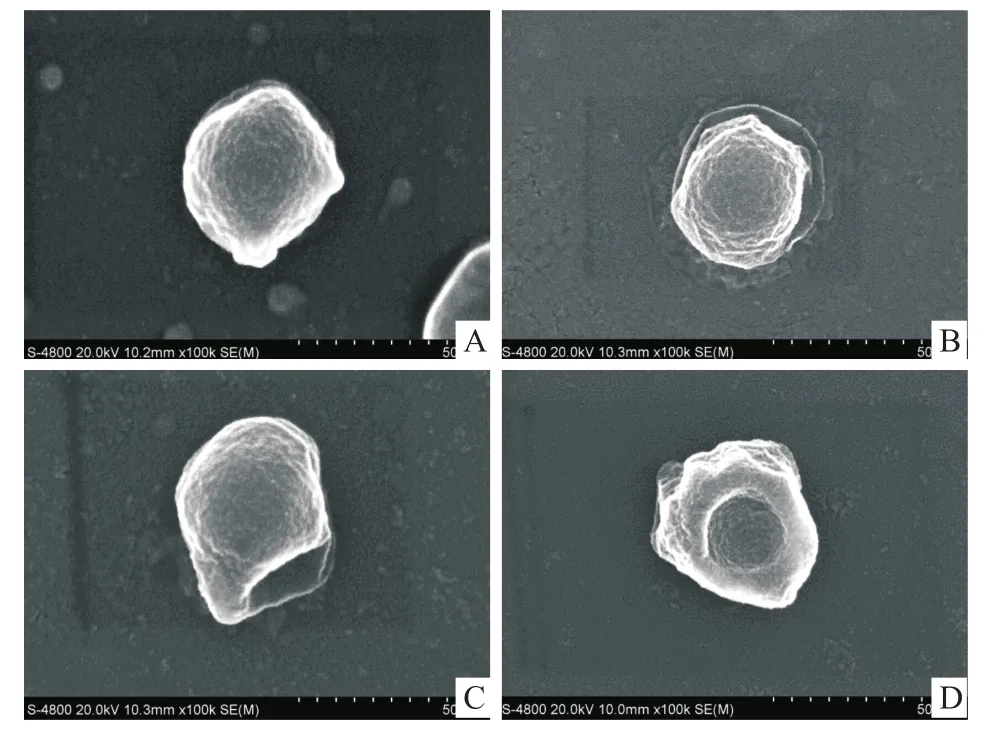
图4 CTGF/PLLA纳米微球降解扫描电镜图 ×100 000
3 讨论
近20年来,牙科种植体已经越来越广泛应用于口腔医学临床,虽然临床长期随访研究表明种植体成功率已达到93.8%~95%,但种植体周围感染的发生率仍高达14%~30%。牙科种植体是一个穿龈的结构,细菌最初在穿龈的基台处黏附和堆积并形成菌斑,随着基台处菌斑的成熟和其中致病菌比例的增高,种植体基台周围软组织出现了炎性浸润导致结缔组织降解,致病菌也随之逐步向种植体基底迁移,破坏种植体与骨组织的骨结合,且持续的炎症导致起支持作用的骨组织丧失,并最终影响种植体的成功率和使用寿命。因此,如何处理种植体基台表面来促进基台与软组织形成更快、更有效的生物学封闭,从而抵御细菌的侵袭,预防种植体周围感染是提高种植体成功率和使用寿命的关键问题之一。该研究选择了具有明确促进软组织生长的CTGF来制作纳米级微球,对微球特性及体外释药性能进行研究,为下一步在种植体基台表面构建促进软组织封闭涂层奠定实验基础。
以PLLA为载体材料将CTGF制成微球不仅可以根据特定的治疗需要实现药物的缓慢释放和局部释放,还可以提高其生物利用度。由于CTGF水溶性较好,在微球制备过程中选择了复乳法,从制备结果来看包封率达到了令人满意的68.62%。本研究制备载CTGF微球的目的是后期在微弧氧化的基台表面构建促进软组织封闭的涂层,而微弧氧化处理后在钛表面会形成孔径1~3μm的微孔,如果微球粒径太大,就无法嵌合在这些微孔中。激光粒度分布测试仪检测制备出来的CTGF/PLLA微球平均粒径为376.5 nm,粒径上符合后期应用要求,并且多分散系数为0.152,小的多分散系数对纳米微球的长期稳定非常重要。场发射扫描电镜观察纳米微球形貌可见微球外形圆整,无明显裂纹和孔隙。研究表明微球的表面形貌对微球的释药性能有极大影响——粗糙多孔的表面会增大微球的亲水性并使得药物更易扩散,从而加大药物的突释现象。
透析袋扩散法是载药微球体外释药研究的常用方法,其具有操作简单,重复性好的优点。体外释药曲线显示CTGF/PLLA纳米微球释药特征表现为典型的两相曲线:初期的突释以及随后的药物缓慢释放。造成药物突释的原因主要为吸附在微球表面或接近表面的药物迅速溶解至释放介质中。在药物的缓慢释放阶段,随着PLLA的降解,微球中包裹着的CTGF也随之释放出来进入释放介质中。从载药微球的降解扫描电镜照片可见,微球的降解最初表现为表面的降解变形,随着降解的进行微球的球面形貌出现了塌陷,最终丧失了球面的形貌。
综上所述,该研究采用复乳法制备出了粒径较小,分布比较均匀,具有较高包封率的CTGF/PLLA纳米微球,其体外释药时间长达30 d,是应用于牙科种植体基台表面的理想微球。该研究为下一步在种植体基台表面构建促进软组织封闭涂层奠定实验基础。

