基于SREBP-2/Lipin1轴调控的线粒体途径探讨糖尿病周围神经病变的发生机制
肖丽霞,柯瑞琼,王 瑒,郭 莉,洪世华,吕维名
糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是糖尿病(diabetic mellitus,DM)最常见的慢性并发症之一,起病隐匿,进展缓慢,以感觉神经受累最为常见。在糖尿病确诊后10年内,有60%~90%患者有不同程度的神经病变,是糖尿病患者致残的主要原因。DPN发病机制复杂,涉及多元醇通路激活、氧化应激、线粒体功能障碍、糖基化终末产物堆积、神经营养改变、蛋白激酶 C(PKC)途径激活等。线粒体是机体细胞能量代谢的重要场所,高血糖导致的线粒体氧化应激反应在DPN的发病机制中发挥重要作用。在周围神经系统中,细胞间液高糖会导致能量代谢异常,造成周围神经侧芽及轴突再生修复障碍。固醇调节元件结合蛋白(sterol regulatory element binding proteins,SREBPs)是脂质代谢的关键转录因子,包括两种异构体SREBP-1和SREBP-2,可调控脂肪酸和胆固醇的合成。脂素(Lipin1)是一种新的脂肪因子,参与调节脂肪垫以及雪旺细胞中的磷脂酸磷酸酯酶活性,缺乏Lipin1会导致磷脂酸磷酸酯酶活性不足,神经传导速度减慢,进而引发周围神经病变。目前关于 SREBPs、Lipin1与 DPN发病机制的相关研究相对较少,该研究从新的脂肪因子角度出发,探索DPN大鼠坐骨神经病变可能的作用机制,为DPN的临床治疗寻找新的治疗靶点。
1 材料与方法
1.1 动物
60只成年雄性SD大鼠,体质量(200±20)g,购自北京维通利华实验动物技术有限公司。按照动物实验伦理学指导给予动物人文关怀,实验前适应性饲养1周,自由摄取食水。1.2 试剂
链脲佐菌素(streptozotocin,STZ)(美国Sigma公司);GHb(微柱法)试剂盒(美国泰康公司);活性氧(reactive oxyopen species,ROS)检测试剂盒(北京华英生物技术研究所);SREBP-2-siRNA、Lipin1慢病毒载体及空载体(上海吉凯基因化学技术有限公司);羊抗大鼠SREBP-2、Lipin1、B淋巴细胞瘤2蛋白(Bcl-2)及 Bcl-2相关X蛋白(Bax)、细胞色素 C(cytochrome C,Cyto C)、β-actin抗体(美国Santa Cruz公司)。1.3 仪器
Mac/Lab400生理数据记录系统(澳大利亚ADI公司);血糖仪和血糖试纸(美国强生公司);线粒体膜电位 JC-1试剂(北京康宝莱科技有限公司);流式细胞仪(美国 Beckman Coulter公司);荧光酶标仪(美国BioTek公司)。1.4 实验造模
适应性饲养1周,将大鼠随机分为2组:正常对照组20只,给予标准饲料;模型对照组40只,给予高糖高脂饮食(含66.5%普通词料,20%蔗糖,10%猪油,2.5%胆固醇,1%猪胆盐)。8周后按30 mg/kg剂量腹腔内一次注射浓度为1%的STZ溶液(称取1 g STZ粉剂加入0.1 mol/L柠檬酸钠缓冲液100 ml中,现用现配)制备糖尿病大鼠模型,注射72 h后,禁食禁水12 h,大鼠尾静脉采血,血糖仪检测空腹血糖,血糖>16.7 mmol/L者为造模成功,待DM模型建立后,继续饲养6周,检测大鼠尾部坐骨神经传导速度(sciatic nerve conduction velocity,SNCV),以SNCV<30 m/s为DPN模型成功。1.5 实验分组及处理
取10只大鼠作为正常对照组,另外取30只DPN模型大鼠,随机分为空白对照(NC)组、Lipin1过表达(LV-Lipin1)组、SREBP-2-siRNA(si-SREBP-2)组,每组10只。后三组通过尾静脉分别注射si-SREBP-2空慢病毒载体(2×10TU/ml)5×10TU、Lipin1慢病毒载体(1.7×10TU/ml)5×10TU及 si-SREBP-2,每月1次,连续2次,8周后结束实验,断头处死大鼠,迅速分离并取双侧坐骨神经(在膝关节上方取长约4 cm的坐骨神经干),入液氮保存待测。1.6 指标测定
1.6.1 记录各组小鼠空腹血糖水平 处死前尾静脉采血,采用血糖仪和血糖试纸测定血糖水平,微柱法检测糖化血红蛋白(hemoglobin Alc,HbAlc)浓度。
1.6.2 大鼠SNCV 大鼠腹腔注射10%的水合氯醛(300 mg/kg)麻醉,俯卧位固定,暴露并分离右侧坐骨神经,使用Mac/Lab400生理数据记录系统,通过诱发电位测定各组大鼠潜伏期、坐骨神经传导速度和振幅。
1.6.3 坐骨神经线粒体膜电位 取坐骨神经制备单细胞悬液,取100μl细胞悬液置于5 ml的流式测定管,加入100μl JC-1工作液,轻轻混匀,阴性对照管不加,于37℃培养箱中孵育20 min,加入500μl PBS缓冲液,上机检测,以红/绿荧光强度比值(R1/R2)衡量线粒体膜电位去极化比例。
1.6.4 ROS检测 取50 mg坐骨神经,加入1 ml匀浆缓冲液,用玻璃匀浆器充分匀浆。3 600 r/min、4℃离心10 min,弃沉淀,取上清液。在96孔板中加入190μl匀浆上清液、10μl DHE探针,用移液器吹打,使之充分混匀;在37℃避光孵育30 min;置于荧光酶标仪中,后于激发波长为488~535 nm、发射波长610 nm检测荧光强度。以荧光强度/毫克蛋白表示组织ROS强度。
1.6.5 检测 SREBP-2、Lipin1、Bcl-2、Bax、Cyto C表达变化 取100 mg坐骨神经,加入适量裂解液于冰浴充分裂解,4℃离心30 min,吸取上清液,采用BCA试剂盒测量蛋白质含量。取少量蛋白质制成上样缓冲液,进行电泳、转膜、封闭后,加入一抗SREBP-2、Lipin1、Bcl-2、Bax、Cyto C、β-actin,4℃过夜。TBST洗涤,加辣根过氧化物酶标记的二抗,室温轻摇1 h,TBST充分洗涤,用 ECL化学发光试剂显色后,化学发光仪成像。
2 结果
2.1 造模后DPN大鼠坐骨神经ROS含量变化
与正常对照组比较,DPN组大鼠ROS含量升高(P<0.01)。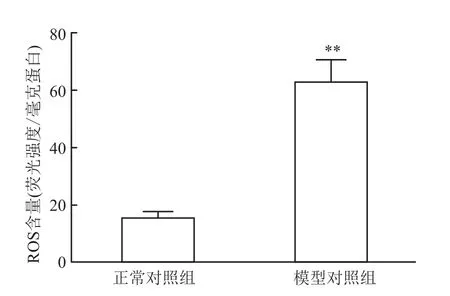
图1 DPN大鼠坐骨神经ROS含量
2.2 造模后大鼠坐骨神经SREBP-2、Lipin1蛋白表达变化
与正常对照组比较,DPN组大鼠坐骨神经组织SREBP-2蛋白表达升高(P<0.01),Lipin1蛋白表达下降(P<0.01)。见图2。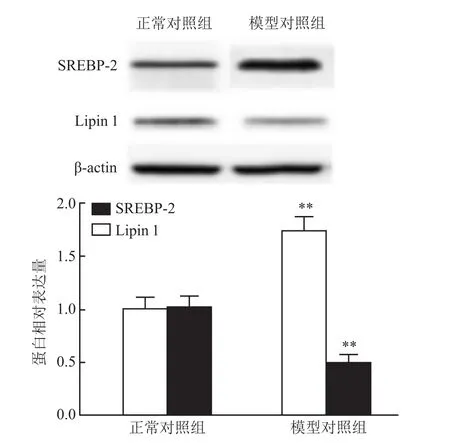
图2 DPN大鼠坐骨神经SREBP-2、Lipin1蛋白表达
2.3 转染 SREBP-2、Lipin1后坐骨神经组织中SREBP-2、Lipin1表达结果
与NC组比较,转染SREBP-2、Lipin1后模型组大鼠坐骨神经中SREBP-2蛋白表达下降(P<0.01),Lipin1蛋白表达升高(P<0.01)。见图3。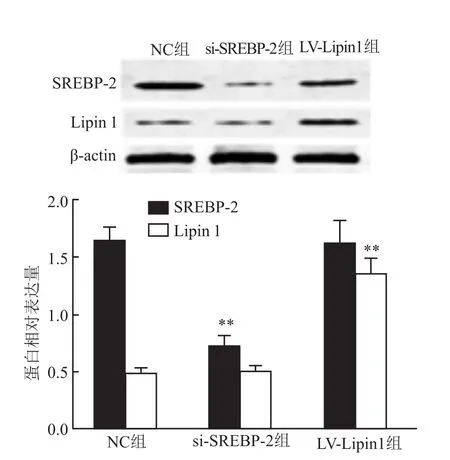
图3 转染SREBP-2、Lipin1后坐骨神经组织中SREBP-2、Lipin1表达(±s,n=10)
2.4 调节SREBP-2、Lipin1表达后对大鼠尾尖血糖的影响
与正常对照组比较,NC组大鼠空白血糖和HbAlc水平升高(P<0.01);与 NC组比较,si-SREBP-2、LV-Lipin1组大鼠血糖和HbAlc水平均降低(P<0.01)。见表1。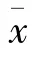
表1 调节SREBP-2、Lipin1表达后对大鼠尾尖血糖的影响(±s,n=10)
2.5 调节 SREBP-2、Lipin1表达后SNCN变化
与正常对照组相比,NC组大鼠SNCV减慢(P<0.01);与NC组大鼠相比,si-SREBP-2组、LV-Lipin1组大鼠 SNCV加快(P<0.01)。见表2。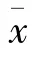
表2 调节SREBP-2、Lipin1表达后对大鼠SNCN的影响(±s,n=10)
2.6 调节SREBP-2、Lipin1表达后大鼠坐骨神经线粒体膜电位变化
与正常对照组比较,NC组大鼠坐骨神经线粒体膜电位降低(P<0.01);与NC组大鼠相比,si-SREBP-2、LV-Lipin1组大鼠坐骨神经线粒体膜电位升高(P<0.01)。见图4。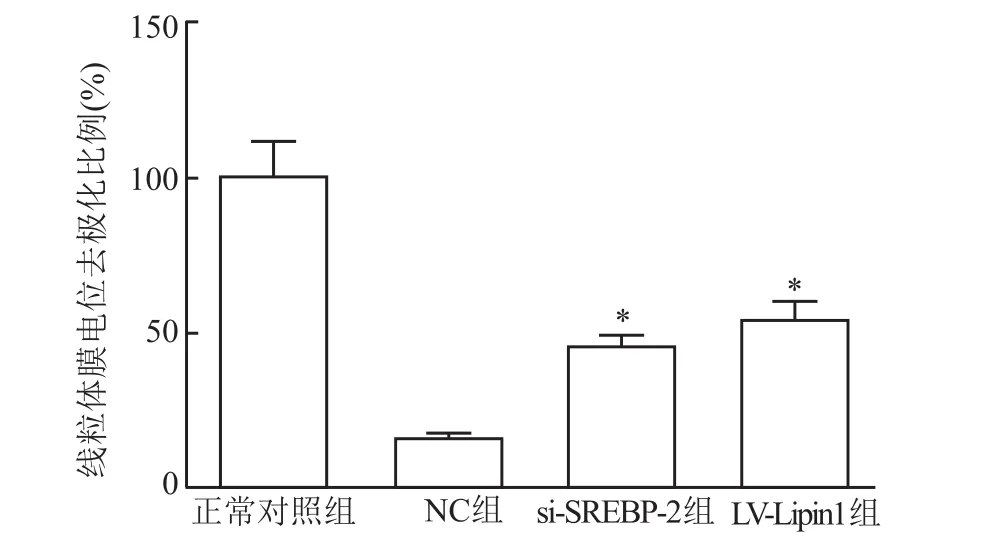
图4 调节SREBP-2、Lipin1表达后对大鼠坐骨神经线粒体膜电位的影响
2.7 调节SREBP-2、Lipin1表达后大鼠坐骨神经ROS含量变化
与正常对照组比较,NC组大鼠坐骨神经ROS含量升高(P<0.01);与NC组大鼠相比、si-SREBP-2、LV-Lipin1组大鼠坐骨神经ROS含量降低(P<0.01)。见图5。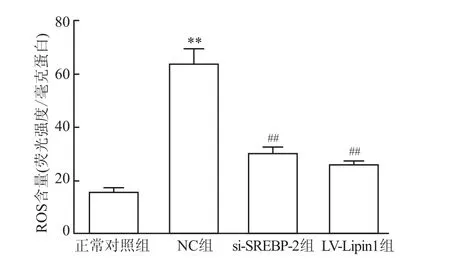
图5 调节SREBP-2、Lipin1表达后对大鼠坐骨神经ROS含量的影响
2.8 调节SREBP-2、Lipin1表达后大鼠坐骨神经中CytoC、Bcl-2、Bax表达变化
与正常对照组比较,NC组大鼠坐骨神经中Cyto C、Bcl-2水平降低,同时Bax蛋白水平增加 (P<0.01);与 NC组比较,si-SREBP-2、Lipin1组大鼠坐骨神经中Cyto C、Bcl-2水平升高,同时Bax蛋白水平下降(P<0.01)。见图6。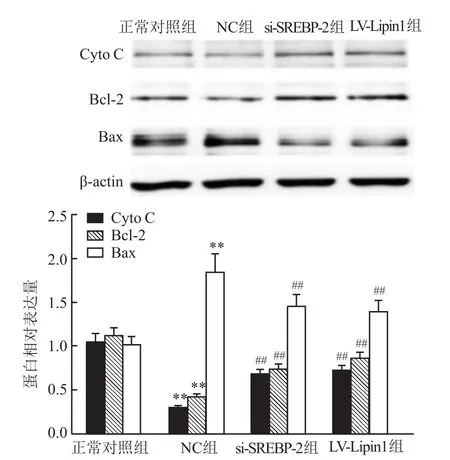
图6 调节SREBP-2、Lipin1表达后对大鼠坐骨神经中Cyto C、Bcl-2、Bax蛋白表达的影响
3 讨论
DPN是糖尿病常见的慢性并发症之一,而且随着糖尿病病程的增加,DPN的发病率也逐渐升高。DPN发病机制较为复杂,其中以线粒体相关的氧化应激是核心因素。SREBP-2参与调节葡萄糖代谢相关酶基因的表达及三酰甘油、脂肪酸的合成,有研究显示 SREBP-2参与糖尿病脂质性肾病的发生,但关于其在DPN方面的研究鲜有报道。Lipin1通过调控磷脂酸磷酸酯酶活性参与髓磷脂的合成,Lipin1缺乏会造成髓磷脂合成减少,神经传导速度减慢,是造成周围神经病变的原因之一。
高血糖诱导的氧化应激是通过线粒体途径来诱导细胞凋亡的,线粒体膜电位下降会增加线粒体的通透性,线粒体中的凋亡蛋白释放到胞质中,启动细胞的凋亡程序。高血糖会先引起线粒体膜电位超极化,该过程产生的大量ROS,导致细胞产生氧化应激损伤。
本实验以高糖高脂饮食结合腹腔注射STZ成功诱导DPN模型,造模后DPN组大鼠坐骨神经组织ROS含量、SREBP-2蛋白表达升高,Lipin1蛋白表达下降,说明糖尿病大鼠的周围神经病变可能与ROS含量、SREBP-2、Lipin1的表达变化有关。为进一步探讨其发生机制,本研究通过慢病毒高表达载体和小干扰RNA转染方法对DPN大鼠进行干预,结果显示si-SREBP-2组和LV-Lipin1组大鼠尾尖血糖明显降低,坐骨神经传导速度明显加快,结果表明其周围神经病变得到改善。进一步检测线粒体损伤,结果表明DPN模型组大鼠ROS含量明显升高,线粒体膜电位下降,Cyto C、Bcl-2水平降低,同时Bax蛋白水平增加 (P<0.01);而 si-SREBP-2、LVLipin1组大鼠ROS含量升高,线粒体膜电位显著升高,Cyto C、Bcl-2水平升高,同时Bax蛋白水平下降(P<0.01)。以上结果表明调节 SREBP-2、Lipin1表达可能是通过抑制氧化应激、减少细胞凋亡来改善DPN大鼠周围神经组织损伤。
综上所述,DPN大鼠坐骨神经中存在 SREBP-2、Lipin1表达异常,调节SREBP-2、Lipin1表达后可改善DPN大鼠坐骨神经线粒体损伤和氧化应激反应,提示DPN的发生机制与SREBP-2/Lipin1调控的线粒体途径有关。

