人红白血病斑马鱼异种模型的建立
王一慧,刘 庆,杨小燕,王念雪,王 猛,舒莉萍,何志旭,5,吴西军
急性红白血病(acute erythroid leukemia,AEL)属于急性髓性白血病的M6型,其特征在于发育异常的红细胞数量增多与增多的原始粒细胞共存,导致造血功能降低、血小板减少、贫血和出血。目前临床没有针对AEL的特异性治疗药物,亟需研发新型药物对AEL进行有效治疗。
药物的研发离不开理想的动物模型。斑马鱼因易于繁殖、胚胎透明、免疫系统成熟较晚等特点,在异种移植方面拥有天然优势。2011年,Pruvot et al研究组构建斑马鱼K562模型用于药物研发,目前斑马鱼异种移植模型的研究领域也已从最初的白血病领域覆盖至黑色素瘤、神经胶质细胞瘤等多个领域。但既往研究中关于建立AEL高通量药物筛选模型的研究依然欠缺。该研究旨在以人红白血病(human erythroleukemia,HEL)细胞建立斑马鱼白血病模型,同时使用阿糖胞苷药物暴露进行干预为之后的新型药物筛选及临床化疗方案比选提供实验基础。
1 材料与方法
1.1 材料与试剂
本实验中选取野生型Tubingen品系斑马鱼作为实验用鱼,由贵州医科大学组织工程与干细胞实验中心实验室繁殖。人红白血病HEL细胞由本实验室传代冻存,复苏后传代备用。活细胞示踪剂CM-DiI购自美国Thermo Fisher Scientific公司;RPIM 1640培养基与新鲜牛血清购自美国Gibco公司;3-乙氧酰基苯胺甲磺酸盐购自上海阿拉丁生化科技股份有限公司;2-苯硫脲、甲基纤维素购自美国Sigma公司;阿糖胞苷购自大连美仑生物技术有限公司。1.2 实验仪器
生化培养箱(常州市科迈公司);体视显微镜(日本Nikon公司);活细胞工作站(日本Olympus公司);HC-3018R高速冷冻离心机(安徽中佳科技有限公司);显微注射仪(美国Harvard公司);拉针仪(日本Narishige公司);斑马鱼养殖系统(北京爱生公司)。1.3 方法
1.3.1 斑马鱼的饲养及胚胎获取 选用性成熟的野生型Tubingen品系斑马鱼进行繁殖,于次日收集受精卵,收集后培养于斑马鱼胚胎培养用水中,受精后12 h(12 hours post-fertilization,12 hpf)加入含有0.003%的2-苯硫脲的胚胎培养液并置于28℃生化培养箱中培养,实验过程中遵循实验动物使用的3R原则。
1.3.2 细胞培养 复苏冻存的 HEL细胞,在RPMI 1640加入10%的胎牛血清及1%的双抗,将细胞置于37℃、5% CO、饱和湿度细胞培养箱中培养,选择对数生长期细胞用于实验。
1.3.3 活细胞示踪剂CM-DiI标记HEL细胞 将处于对数生长期的HEL细胞平均分为空白组和CM-DiI组,CM-DiI组细胞进行CM-DiI染色,先用复温的PBS清洗细胞3遍,弃上清液,再加入1ml PBS混匀,加入 20μl CM-DiI,放入 37℃、5% CO、饱和湿度细胞培养箱5 min,再放入4℃15 min,取出后加入磷酸缓冲盐溶液(phosphate buffer saline,PBS)清洗细胞3遍,吸取少量细胞在荧光显微镜下检查染色是否成功,通过细胞计数检测CM-DiI对HEL细胞增殖抑制曲线,连续计数5 d,每组重复3次。
1.3.4 HEL细胞显微移植 收集48 hpf的Tubingen系野生型斑马鱼胚胎,分为空白对照组、PBS实验组和HEL实验组,3组孵育温度、光照、数量等均一致。在注射前,使用HARVARD(C-13410)注射仪记录从注射针内打出的液滴直径,计数包括注射前及注射后的50个液滴内的细胞数,计算其平均值作为实验注射的细胞数量;在注射时,PBS注射组和HEL细胞注射组斑马鱼用0.05%的3-乙氧酰基苯胺甲磺酸盐麻醉,然后将其置于琼脂糖针板上,使用拨针将斑马鱼摆放为腹部面向针头体位,将经CMDiI标记好的HEL细胞注入卵黄囊中,经计算,每条斑马鱼约注射50个细胞左右;PBS组斑马鱼胚胎仅注射PBS,且除注射样品外实验条件各组均一致。注射完成后先在28℃温箱中恢复1 h,再将各组斑马鱼放在含有0.003%的2-苯硫脲的胚胎培养液中34℃孵育。通过体视显微镜和荧光显微镜对移植后斑马鱼体内的细胞的增殖扩散进行观察。
1.3.5 HEL细胞在斑马鱼体内外增殖检测
1.3.5.1 体内增殖与迁移情况检测 随机选取移植后的斑马鱼,利用荧光显微镜观察带红色荧光的HEL细胞在斑马鱼体内荧光分布情况。
1.3.5.2 体外增殖检测 在注射HEL细胞后的第1天(1 days post-injection,1 dpi)、第 3天(3 dpi)、第5天(5 dpi)从培养皿中随机选择PBS注射组、HEL细胞注射组和空白对照组各6条,将其置于96孔微量培养板中匀浆化,每组1条,做好标记,每孔滴加25μl胶原酶(2 U/ml)和 25μl中性蛋白酶(60 U/ml),均用基础培养液配制,37℃孵育 2 h,然后用20μl枪头将整条消化后的斑马鱼吹打成单个细胞,再将50μl液体用60目细胞筛进行过滤,最后吸取10%过滤后的细胞悬液滴于血球计数板上,在荧光显微镜下对带红色荧光的细胞进行计数并记录,比较实验组第1、3、5天的荧光细胞数,同时利用活细胞工作站拍照,在斑马鱼体外明确HEL细胞是否发生增殖。
1.3.6 斑马鱼红白血病模型的生存情况检测 观察HEL植入后斑马鱼的生长情况及存活状况等。
1.3.7 人红白血病移植模型阿糖胞苷药物暴露荧光显微镜下选取荧光强度大致相同的HEL实验组斑马鱼,将其随机平分到6孔板中,分为阿糖胞苷50 nmol/L组、阿糖胞苷 100 nmol/L组、阿糖胞苷200 nmol/L组、模型对照组。吸干液体,在对应分组中再加入配制完成的50、100、200 nmol/L的阿糖胞苷溶液6 ml,模型对照组加6 ml含0.003%的2-苯硫脲的胚胎培养液,将6孔板置于铝盒中34℃温箱中培养。并通过活细胞工作站观察药物暴露第0、1、3、5天四个组中斑马鱼体内的HEL细胞增殖情况,同时在药物暴露的第0、1、3、5天每组各取1尾制作单细胞悬液,在荧光显微镜下计数荧光细胞数量,每组重复3次。
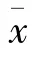
2 结果
2.1 活细胞示踪剂CM-DiI标记HEL细胞
通过CM-DiI标记HEL细胞,统计分析显示,CM-DiI组与空白组之间的细胞生长差异无统计学意义(t=1.642,P>0.05)(图1A);而活细胞工作站观察显示红色荧光细胞的数量随着细胞数量的增加而增加,并且荧光强度在7 d内几乎无变化(图1B)。结果提示CM-DiI可用于活细胞标记且对细胞增殖无明显影响。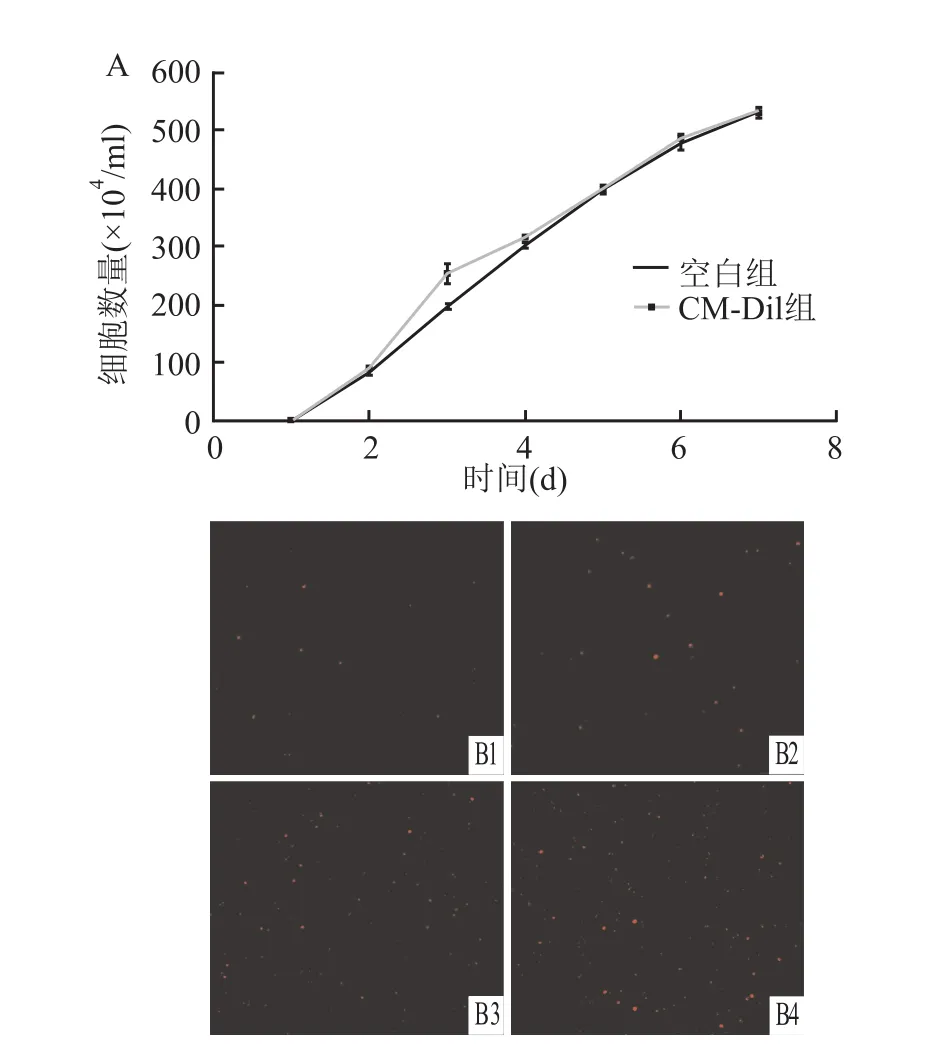
图1 CM-Dil标记HEL细胞后增殖情况
2.2 植入的HEL细胞在斑马鱼体内增殖及迁移
在活细胞工作站观察时,注射HEL细胞的斑马鱼卵黄囊内有红色的荧光细胞簇,但在其他两组未出现。1~5 d后,在HEL细胞组中出现了斑马鱼卵黄囊中发出红色荧光的细胞,随着时间的增加逐渐扩散充满腹腔并部分到达尾部(图2)。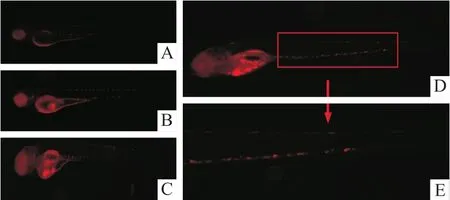
图2 HEL细胞在斑马鱼体内增殖及迁移情况
2.3 体外定量计数移植组斑马鱼体内HEL细胞的增殖
在斑马鱼体内对移植的HEL细胞的增殖情况进行分析,并对其进行定量化检测。结果表明,注射后的第1天,斑马鱼荧光细胞的数量为(200±8)个/条,第5天为(420±5)个/条,细胞数目增加约为1.1倍(图3A)。在荧光显微镜下对单细胞悬液进行观察并计数,可见红色荧光细胞数目增多(图3B)。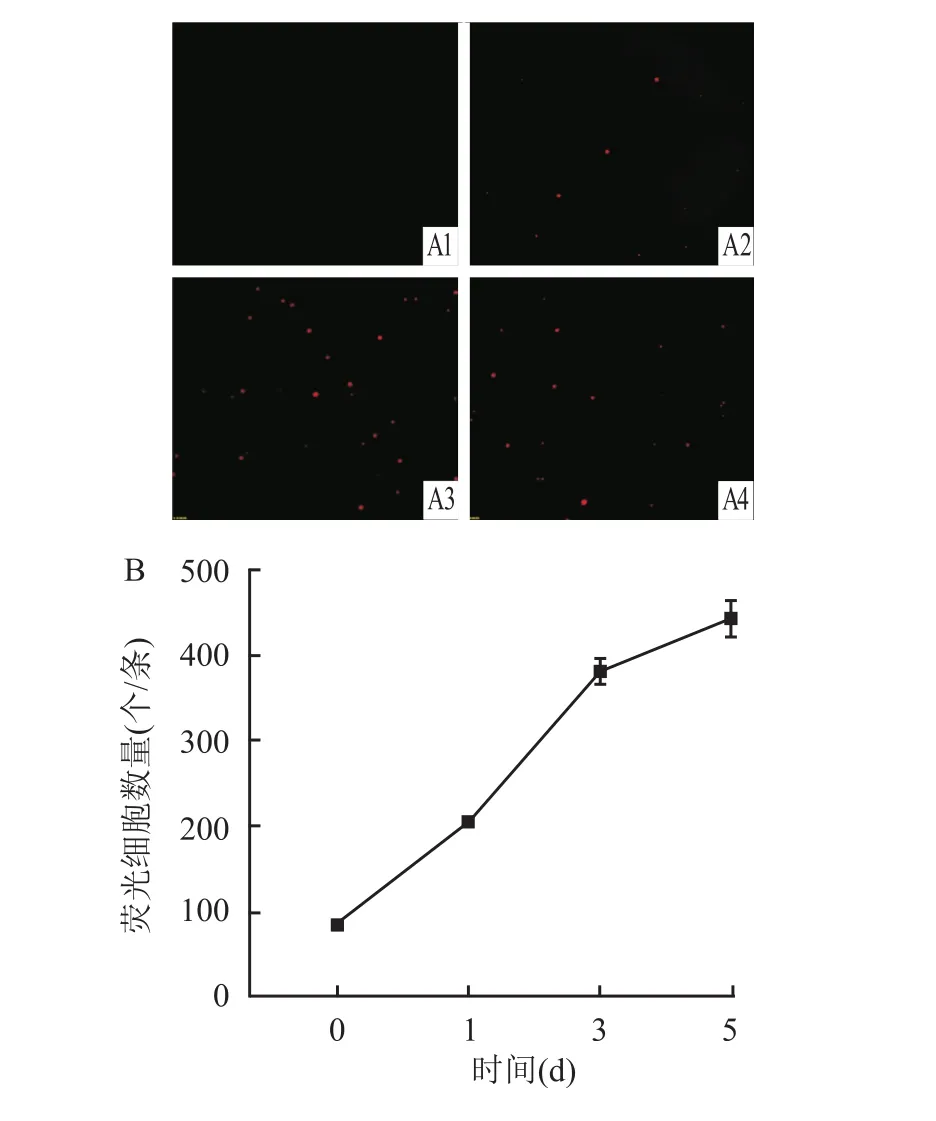
图3 HEL细胞体外增殖检测
2.4 HEL细胞植入后斑马鱼的行为状态
空白对照组、PBS注射实验组、HEL注射实验组每组取290条进行实验。在斑马鱼接种HEL细胞后,实验组斑马鱼出现游动减少现象。另外分别在1 dpi和5 dpi观察并分析了上述3组中存活的斑马鱼。在1 dpi时,HEL注射实验组有(249±5)条存活,PBS注射实验组和空白对照组有(269±4)条存活,前者与后两组之间差异无统计学意义(t=3.584,t=4.022,P>0.05)。在5 dpi时,HEL注射实验组的斑马鱼数量(67±3条),明显少于空白对照组(237±5)条和PBS注射实验组(230±5)条,差异有统计学意义(t=14.72,t=18.5,P<0.05),空白对照组和 PBS注射实验组在5 d后斑马鱼的存活率之间差异无统计学意义(t=2.333,P>0.05),结果表明 PBS及注射引起的机械操作对斑马鱼的存活率没有显著影响。斑马鱼用HEL细胞接种7 d后全部死亡(图4)。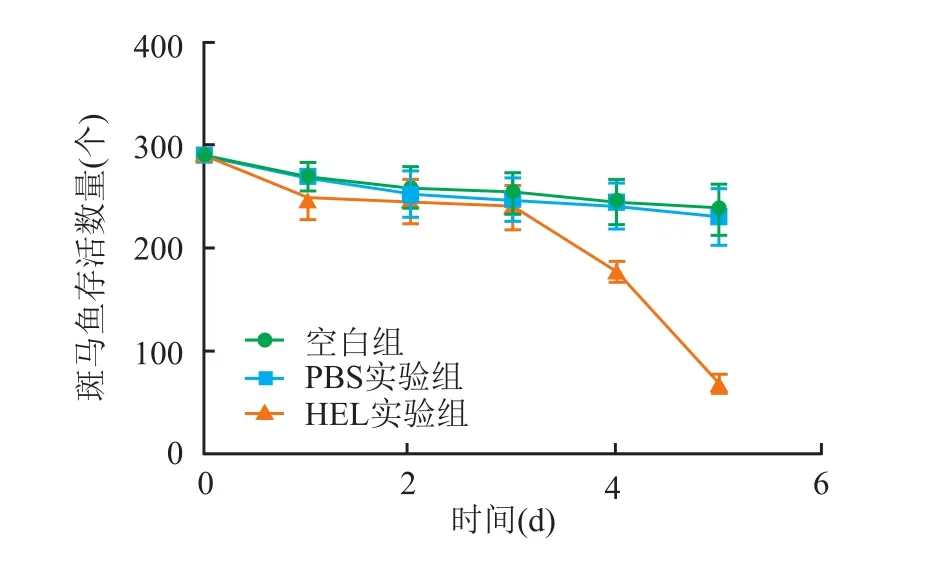
图4 HEL细胞注射后斑马鱼生存情况
2.5 人红白血病异种移植模型阿糖胞苷药物暴露
使用荧光显微镜观察时,药物干预后第1天(1 days post-treatment,1 dpt),模型对照组斑马鱼卵黄囊内的红色荧光细胞簇与药物暴露斑马鱼(50 nmol/L)相比,差异无统计学意义(t=3.159,P>0.05),与药物暴露斑马鱼(100、200 nmol/L相比,差异有统计学意义(t=8.533,t=7.233,P<0.05);药物干预后第5天发现药物暴露的斑马鱼(50、100、200 nmol/L)体内的红色荧光细胞簇荧光强度相对于模型对照组减弱,差异有统计学意义(t=6.635,t=24.111,t=34.671,P<0.05),这表明 HEL细胞增殖被抑制(图5A)。单细胞悬液计数显示随着阿糖胞苷浓度增加,荧光细胞数量降低(图5B、5C)。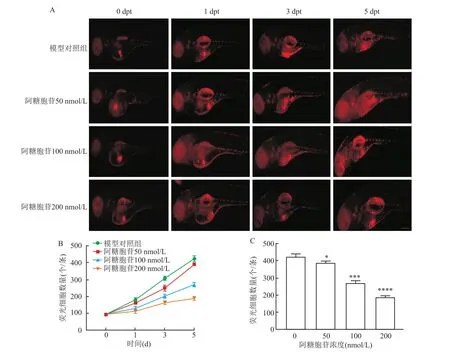
图5 阿糖胞苷药物暴露后斑马鱼体内HEL细胞增殖及迁移情况
3 讨论
AEL又称AML-M6变异型。临床上,AEL患者通常与其他类型的AML患者接受相似的治疗,其中阿糖胞苷是最有效的药物,阿糖胞苷作为一种重要的抗白血病药物,在体内能干扰DNA的合成,从而抑制白血病细胞的增殖,实现抗肿瘤的药理作用。但目前仍无针对这种疾病的特定靶向治疗药物。寻找合适且有效的AEL治疗药物成为当务之急。然而,如何在模式生物体内进行新型药物的快速安全且有效的验证成为需要解决的问题,美国科研团队曾将人类肿瘤细胞移植到斑马鱼和小鼠中,使它们成为癌症患者的替身,并借助其研究癌症治疗的用药和术后反弹等问题,实验结果表明使用小鼠作为模型自实验开始到分析结果需要2~6个月,相比于用斑马鱼耗时更久,花费更高。
斑马鱼作为新兴的异种移植模型,确定具有人类癌症主要参与者的许多癌基因和肿瘤抑制基因的同源物,并且斑马鱼造血系统相关转录因子与人类高度保守。2017年,研究者通过将KG-1细胞植入斑马鱼体内构建髓系白血病模型,并通过体内外检测得出植入的白血病细胞可在斑马鱼体内存活、增殖及扩散。参照此研究,本实验将经活细胞示踪剂CM-DiI标记的人急性红白血病HEL细胞通过显微注射技术植入斑马鱼体内,从而构建斑马鱼白血病模型,其中涉及的各个参数,包括注射时期、注射部位、注射细胞数量及注射完毕后放置温度等均通过参与文献及实际操作得到了最优化。结果得出移植入斑马鱼体内的HEL细胞可发生增殖及迁移,但是随着细胞增殖越多,斑马鱼的死亡、畸形增多,而对照组斑马鱼并未致死。进一步使用阿糖胞苷对HEL移植组斑马鱼进行了药物暴露,证实阿糖胞苷对HEL细胞增殖出现抑制作用。这说明该实验成功建立了斑马鱼白血病模型,亦为以后使用此模型进行新型药物的高通量筛选提供了实验依据。同时该模型也可用于临床个体化治疗方案比选,将患者来源白血病细胞移植到斑马鱼体胚胎内建立人源肿瘤异种移植模型,能更好地保持患者临床肿瘤的异质性,进行多个化疗方案疗效评价,进而选取抑制肿瘤细胞最好的化疗方案。因此,该模型具有较好的应用前景。

