右美托咪定减轻脑缺血再灌注大鼠氧化应激损伤的作用
秦智刚,徐尤年,李 锟
脑缺血再灌注损伤(cerebral ischemia reperfusion injury,CIRI)常见于心肺复苏、脑外伤等脑缺血低氧后的再灌注过程,临床尚无有效的治疗手段。研究显示,CIRI的发生可能与机体过量的氧自由基、炎症反应、细胞凋亡等有关。转录因子E2相关因子 2(nuclear factor erythroid 2 related factor 2,Nrf2)/抗氧化反应元件(antioxidant response element,ARE)信号通路是机体内最重要的抗氧化应激系统,可以抵抗内外界的氧化应激,应对各种外来损伤。研究显示,Nrf2/ARE信号通路在 CIRI的发生发展中具有重要作用,可以清除机体过多的氧自由基,保护脑组织损伤。右美托咪定(dexmedetomidine,Dex)是一种临床常用的镇静剂,近年来研究显示Dex可以减少炎性因子的释放,减轻脑组织炎性损伤,但其对CIRI的氧化应激损伤尚不清楚。该研究分析了Dex对CIRI大鼠Nrf2/ARE信号通路的影响,旨在为临床应用提供理论依据。
1 材料与方法
1.1 仪器、试剂与动物
多功能酶标检测仪(iMark680)购自美国Bio-Rad公司;Dex注射液(国药准字H20183219)购自江苏扬子江药业集团有限公司;超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)和 NO检测试剂盒购自南京建成生物工程研究所;标记二抗的辣根过氧化物酶,购于丹麦DAKO公司;RT-PCR试剂盒购自上海恒斐生物科技有限公司;B细胞淋巴瘤2(Bcl-2)、Bcl-2相关 X蛋白(Bax)、裂解的半胱氨酸天冬氨酸蛋白酶3(cleaved caspase-3)、Nrf2、血红素加氧酶(hemeoxygenase-1,HO-1)、醌氧化还原酶 1(quinone oxidoreductase 1,NQO-1)单克隆抗体均购于美国Santa Cruz公司;SPF级SD雄性大鼠30只,6~8周龄,体质量均为(240±10)g,购自上海斯莱克实验动物有限责任公司[动物许可证号:SCXK(沪)2017-0005],饲养于北大医疗株洲恺德医院动物中心实验室,自由摄食与饮水。1.2 动物造模及给药
将30只SD大鼠随机分为假手术组、模型组和Dex组各10只。模型组和Dex组大鼠采用Longa法制备大鼠CIRI模型,常规麻醉,采用MCAO栓线结扎脑中动脉,缺血120 min后拔出栓线实现脑组织的再灌注;假手术组仅插入栓线,不结扎。Dex组于再灌注后即刻腹腔注射100 μg/kg Dex(浓度为 10 mg/L);模型组和假手术组腹腔注射等体积0.9%氯化钠溶液。1.3 各组大鼠神经体征缺失评分和脑梗死体积分数
再灌注24 h后,参照Zea Longa 5分制标准进行神经体征缺失评分。处死大鼠,取大鼠缺血区脑组织,氯化三苯基四氮唑(triphenyl tetrazolium chloride,TTC)染色法计算脑梗死体积分数。1.4 各组大鼠脑组织损伤检测
取甲醛固定的大鼠脑缺血区组织,制作切片,分别进行HE染色和TUNEL染色,显微镜下观察组织的病理变化和阳性细胞数,计算细胞凋亡率;严格按照试剂盒说明操作染色。1.5 脑组织中SOD、MDA和NO测定
取新鲜的大鼠脑缺血区组织,严格按照试剂盒说明,采用ELISA法测定脑组织中SOD、MDA、NO水平。1.6 RT-PCR检测脑组织 Nrf2、HO-1、NQO-1 mRNA的表达
取新鲜的大鼠脑缺血组织匀浆,按照试剂盒操作提取总RNA,经反转录合成cDNA,参考已有研究进行RT-PCR反应。1.7 Westernblot检测脑组织 Nrf2、HO-1、NQO-1、Bcl-2、Bax和cleavedcaspase-3的表达
取新鲜的大鼠脑缺血组织,匀浆,提取总蛋白,进行SDSPAGE凝胶电泳、转膜、封闭,加一抗(Nrf2、HO-1、NQO-1、Bcl-2、Bax和 cleaved caspase-3,稀释比例均为1∶1 000),4℃孵育过夜,加二抗室温孵育2 h,显影,以β-actin为内参,凝胶成像分析系统对比条带强弱。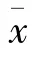
2 结果
2.1 CIRI大鼠的神经功能缺失评分和脑组织梗死体积分数
与模型组相比,Dex组大鼠神经功能缺失评分和脑梗死体积分数降低(P<0.05),见表1。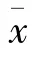
表1 大鼠的神经功能缺失评分和脑组织梗死面积(±s,n=10)
2.2 CIRI大鼠脑组织损伤
假手术组大鼠脑组织细胞结构完整,未见明显异常;模型组大鼠脑组织缺血区皮质出现水肿,胞间隙变宽,细胞核固缩深染,出现变性和坏死区;Dex组大鼠脑缺血区皮质病理损伤减轻。见图1。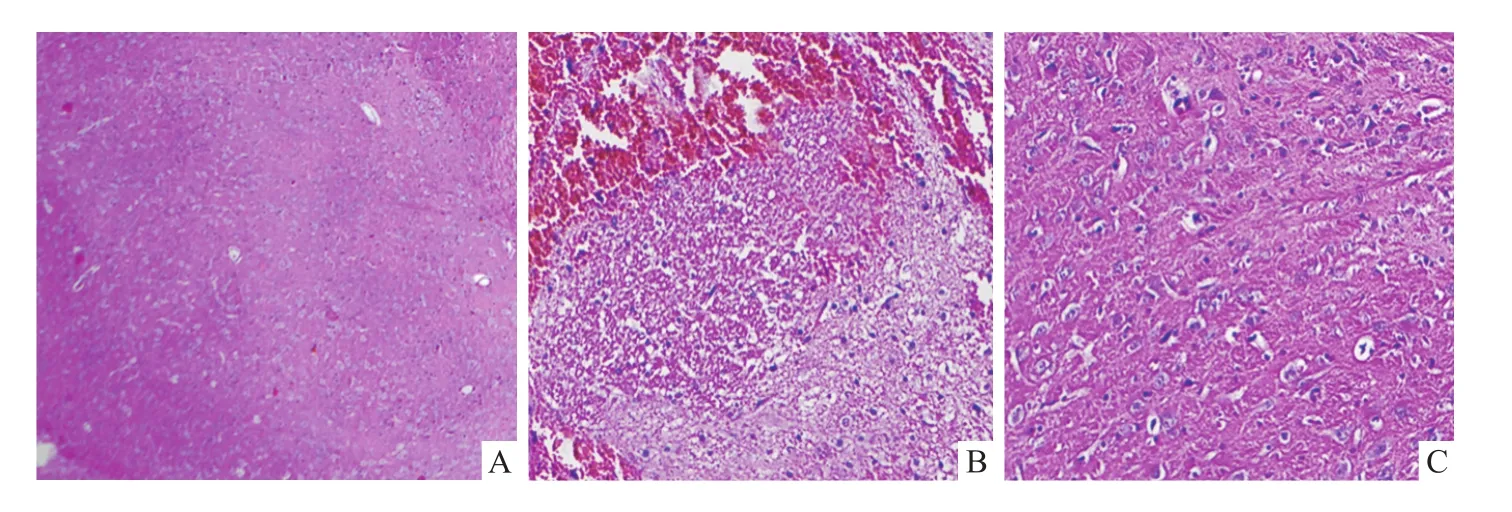
图1 大鼠脑组织病理损伤 HE ×200
2.3 CIRI大鼠脑组织细胞凋亡
与假手术组相比,模型组和Dex组大鼠脑组织细胞凋亡率升高(P<0.05);与模型组相比,Dex组脑组织细胞凋亡率下降(P<0.05)。与假手术组相比,模型组和Dex组大鼠脑组织 cleaved caspase-3/Bcl-2、Bax/Bcl-2的表达上调(P<0.05);与模型组相比,Dex组大鼠脑组织 cleaved caspase-3/Bcl-2、Bax/Bcl-2的表达下调(P<0.05)。见图2、表2。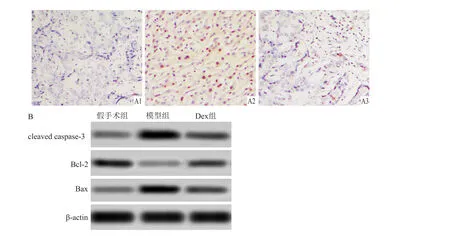
图2 脑组织细胞凋亡及相关蛋白的表达 ×200
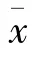
表2 脑组织细胞凋亡及相关蛋白的表达(±s,n=10)
2.4 CIRI大鼠脑组织SOD和MDA水平
与假手术组相比,模型组和Dex组大鼠脑组织SOD活性下降(P<0.05),MDA和NO水平升高(P<0.05);与模型组相比,Dex组大鼠脑组织SOD活性升高(P<0.05),MDA和 NO水平下降(P<0.05),见表3。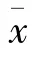
表3 脑组织SOD和MDA水平(±s,n=10)
2.5 CIRI大鼠脑组织 Nrf2、HO-1、NQO-1mRNA表达
与假手术组相比,模型组和Dex组大鼠脑组织Nrf2、HO-1和 NQO-1 mRNA的表达上调(P<0.05);与模型组相比,Dex组大鼠脑组织Nrf2、HO-1和NQO-1 mRNA的表达上调(P<0.05),见表4。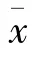
表4 脑组织 Nrf2、HO-1、NQO-1 mRNA表达(±s,n=10)
2.6 CIRI大鼠脑组织 Nrf2、HO-1、NQO-1蛋白表达
与假手术组相比,模型组和Dex组大鼠脑组织Nrf2、HO-1和 NQO-1蛋白的表达上调(P<0.05);与模型组相比,Dex组大鼠脑组织 Nrf2、HO-1和NQO-1蛋白的表达上调(P<0.05),见图3、表5。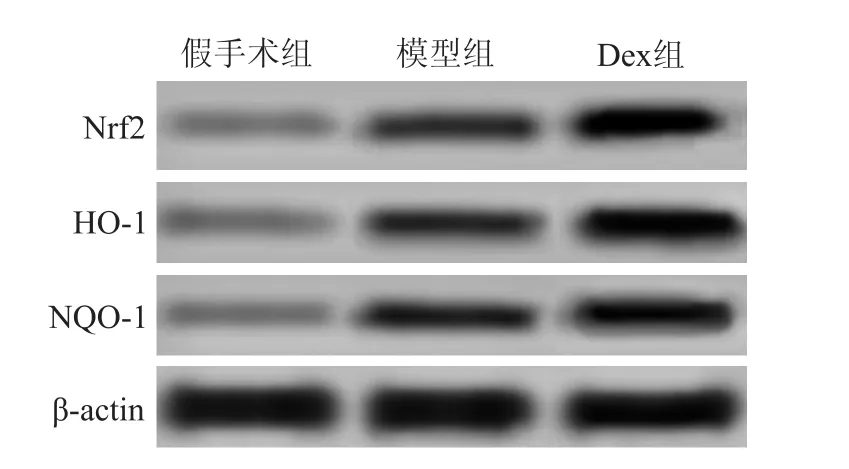
图3 Western blot法检测脑组织Nrf2、HO-1、NQO-1蛋白
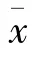
表5 脑组织Nrf2、HO-1、NQO-1蛋白表达(±s,n=10)
3 讨论
脑缺血一定时间后再灌注时,大量的氧自由基一方面可引起细胞膜脂质过氧化、能量代谢障碍等导致神经细胞坏死,另一方面也可激活凋亡相关的信号通路,诱导神经细胞凋亡。Dex是一种镇静剂,近年来研究显示,Dex还可以激活神经系统及其他脏器的α2受体或咪唑啉受体,保护神经、心脏、肾脏、肺等的功能。本研究中,Dex后处理可以显著改善CIRI的大鼠的神经功能和脑组织损伤,缩小其脑梗死面积。龚辉等的研究显示,Dex可以减轻CIRI大鼠的炎症反应,抑制神经元细胞凋亡,保护CIRI大鼠的脑组织损伤,改善其神经功能,与本研究结果基本一致,提示Dex后处理可以改善CIRI大鼠的脑组织损伤和功能障碍,有望应用于临床治疗。
Nrf2/ARE信号通路是机体内最重要的内源性抗氧化信号通路,在正常的生理状况下,Nrf2与Kelch样环氧氯丙烷相关蛋白-1在细胞浆中相偶联,处于被抑制状态,一旦细胞受到氧自由基刺激时,前者可与后者发生解偶联,转位至细胞核,启动ARE调控的靶基因的表达。ARE是一个DNA-启动子结合序列,当活化的Nrf2转位至细胞核与其结合后,可激活下游多个抗氧化基因HO-1、NQO-1、谷胱甘肽-S转移酶等的表达,清除机体过多的氧自由基。本研究中,Dex后处理可以显著上调Nrf2、HO-1和NQO-1的表达。HO-1和NQO-1具有抗氧化、抗细胞凋亡、抗炎和维持微循环的功能,在机体抗氧化应激中具有重要作用,提示Dex后处理可能通过激活Nrf2/ARE信号通路,发挥其抗氧化作用。本研究中,Dex后处理还可以显著升高SOD活性,降低脑组织MDA和NO水平,提示Dex后处理可能通过激活Nrf2/ARE信号通路,激活下游抗氧化基因HO-1和NQO-1的表达,清除机体过多的氧自由基,保护脑组织细胞免于损伤。
本研究中,Dex后处理可以显著减少CIRI大鼠脑组织细胞的凋亡率,下调 Bax/Bcl-2和 cleaved caspase-3/Bcl-2的表达。临床研究显示,细胞凋亡在CIRI损伤中具有重要作用,是脑组织神经细胞死亡的主要原因。Bcl-2/Bax蛋白是一组调节线粒体凋亡途径的重要蛋白,在凋亡信号刺激下,Bax可与Bcl-2结合,破坏线粒体膜结构,导致细胞色素C释放,激活 caspase反应,诱导细胞凋亡。兰琛的研究显示,Dex干预可以上调凋亡基因Bcl-2的表达,抑制Bax基因转膜,抑制细胞色素C的释放,抑制caspase相关的凋亡级联反应,从而抑制脑组织细胞的凋亡,保护脑组织免于损伤,与本研究结果基本一致,提示Dex后处理可能通过清除机体过多的氧自由基,抑制脑组织细胞的凋亡,改善脑组织损伤。
综上所述,Dex后处理可以促进HO-1和NQO-1的表达,清除机体过多的氧自由基,抑制脑组织细胞凋亡,改善CIRI大鼠脑组织细胞损伤和神经功能障碍,其作用机制可能与Nrf2/ARE信号通路的激活有关。但该研究仅初步探讨了Dex后处理可能的机制,其具体的作用机制尚需进一步研究。

