基于多数据库分析FAM 50A在肝细胞癌中的临床意义及生物学功能
熊 竹,马丹丹,张智勇
肝细胞癌(hepatocellular carcinoma,HCC)是全球第6位常见恶性肿瘤,且其在全球恶性肿瘤致死病因中居第3位,HCC发病隐匿、进展快、易转移、恶性程度高,多数患者就诊时已属晚期,预后较差。因此,寻找与HCC发生发展、复发转移及生物学功能密切相关的特异性生物标志物,对改善HCC患者的预后具有重要的临床意义。
50序列相似的家庭成员A(family with sequence similarity 50member A,FAM50A),又称X染色体相关蛋白5(X-chromosome-associated protein 5,Xap5)。FAM50A细胞遗传学定位在人类染色体Xq28,包含5个外显子,编码339个氨基酸,分子量大小为40 ku,有望成为DNA结合蛋白或转录因子蛋白。但其功能不明确,目前国内外关于FAM50A在HCC中表达及功能的相关报道甚少。该研究主要分析FAM50A在HCC组织中的表达、预后及生物学功能,旨在为HCC的早期诊断、病情监测及预后判断提供新思路。
1 材料与方法
1.1 数据库资料收集整理
① 在人类蛋白图谱(Human Protein Atlas,HPA)数据库检索“FAM50A”,提取 FAM50A的表达及定位。② 在Oncomine数据库筛选FAM50A基因,收集Roessler et al、Wurmbach et al、Mas et al研究中FAM50A在HCC组织与正常肝组织中的表达差异,并荟萃分析。基因表达谱数据动态分析 (gene expression profiling interactive analysis,GEPIA)数据库可获得FAM50A在HCC组织与正常肝组织中的表达差异。③ 在 Kaplan Meier Plotter数据库检索“FAM50A”,按照 “auto select best cutoff”进行分组,绘制HCC患者的生存曲线。④ MethHC数据库分析HCC中FAM50A启动子区甲基化水平在正常肝组织与HCC组织中的差异。⑤在String中搜索蛋白质名称“FAM50A”,选择物种“Homo sapiens”,可获取FAM50A蛋白相互作用网络。⑥利用基因集富集分析(gene set enrichment analysis,GSEA)研究FAM50A mRNA表达水平与京都基因和基因组百科全书 (Kyoto encyclopdia of genes and genomes,KEGG)通路基因集的相关性。⑦从癌症基因图谱(the cancer genome atlas,TCGA)数据库下载 HCC患者的临床病理特征与基因芯片矩阵的数据,并统计分析。1.2 FAM50A在HCC及癌旁组织中的表达差异
收集2018年7月—2019年6月在中部战区总医院普通外科接受根治性肝切除术治疗的45例HCC患者的组织标本。分别采用Real-time PCR和Western blot检测FAM50A在45例HCC组织及配对癌旁组织中的表达。1.3 统计学处理
利用SPSS 21.0软件进行分析,率的比较采用χ检验,HCC与癌旁组织表达量的比较采用t检验,P<0.05为差异有统计学意义。2 结果
2.1 FAM50A的表达及定位
HPA数据库分析结果显示FAM50A基因mRNA在61种人体正常组织中均有表达,在骨骼肌组织中的表达量最高,在肝脏组织中的表达量排在第37位,见图1。FAM50A基因mRNA在17种肿瘤组织中均有表达,在卵巢癌组织中的表达量最高,在HCC组织中的表达量处于第9位,见图2。免疫组化染色结果显示FAM50A在正常肝组织中定位在细胞质、细胞膜及细胞核,在HCC组织中定位在细胞核,见图3。细胞免疫荧光染色结果显示FAM50A定位在细胞核,见图4。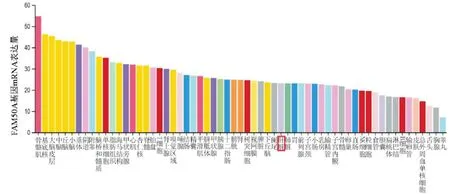
图1 FAM 50A基因mRNA在人体正常组织中的表达
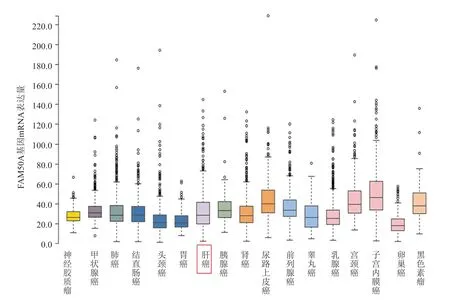
图2 FAM 50A基因m RNA在不同肿瘤组织中的表达
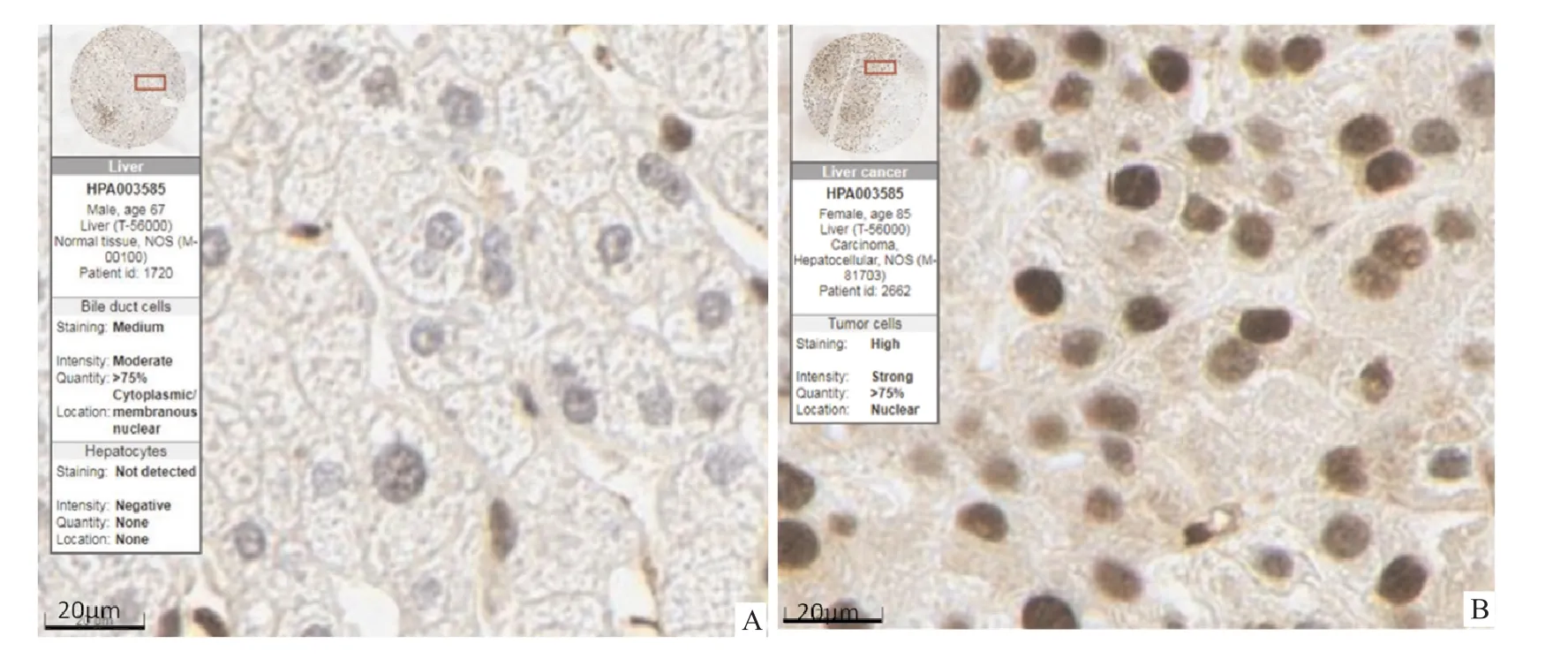
图3 FAM 50A在正常肝组织及HCC组织中定位免疫组化染色 ×400
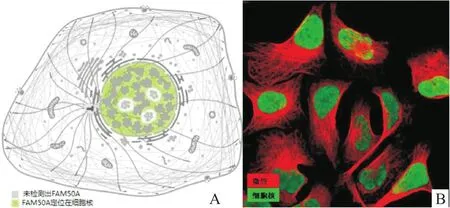
图4 FAM 50A定位在细胞核
2.2 FAM50A在HCC及癌旁组织中的表达水平
Real-time PCR显示FAM50A在HCC组织中的mRNA表达量高于癌旁组织[(1.789±0.199)vs(0.804±0.117)],差异有统计学意义(t=28.555,P<0.001)。Western blot检测结果显示FAM50A在HCC组织中的蛋白表达高于癌旁组织,差异有统计学意义(P<0.05)。见图5。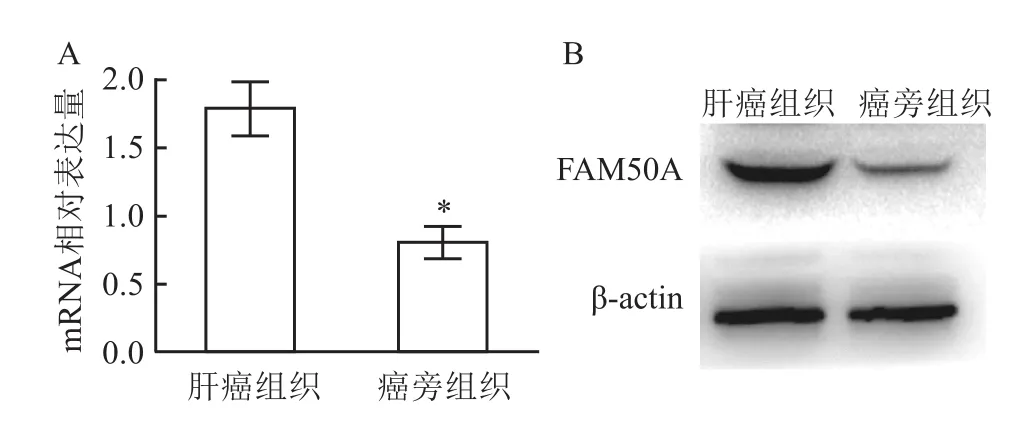
图5 FAM 50A在HCC及癌旁组织中的表达水平
荟萃分析 Oncomine数据库中 Roessler et al、Wurmbach et al、Mas et al的4项研究结果表明,与正常肝组织相比,FAM50A在HCC组织中的mRNA表达量升高,差异有统计学意义(P=5.36×10)。见图6。利用GEPIA平台分析TCGA数据库中的529例样本,结果显示FAM50A在HCC组织(369例)中的mRNA表达量高于正常肝组织(160例),差异有统计学意义(P<0.05)。见图7。

图6 Oncomine数据库预测FAM 50A基因在HCC中高表达
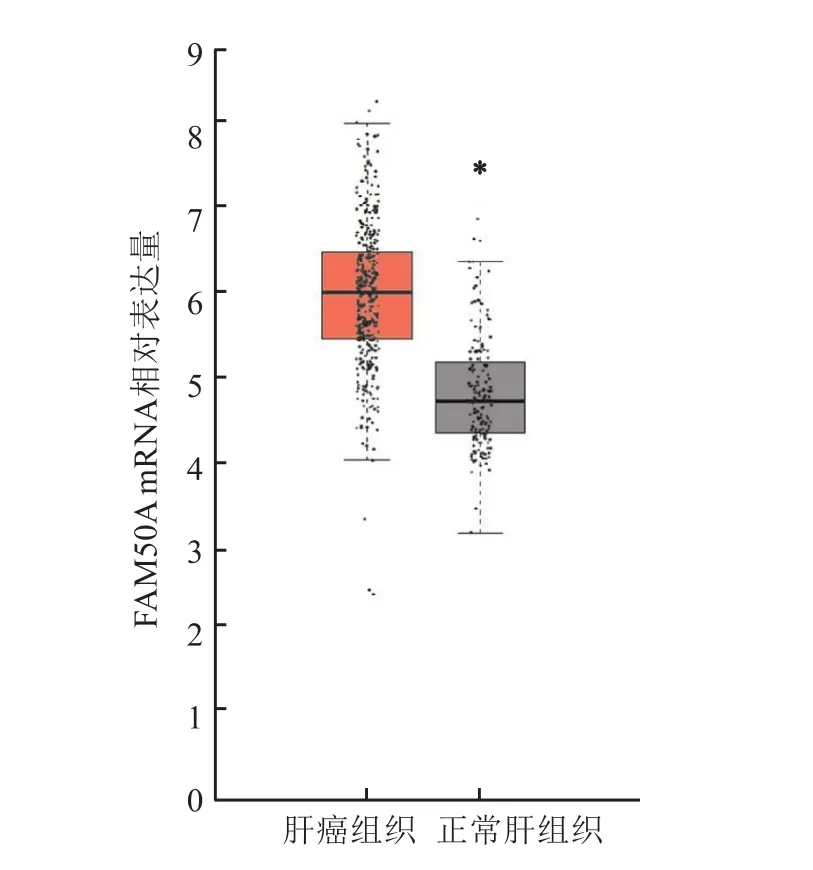
图7 GEPIA数据库预测FAM 50A基因在HCC中高表达
2.3 FAM50A表达水平与HCC患者临床病理特征的关系
TCGA数据库中,根据FAM50A基因mRNA表达量中位数将HCC患者分为FAM50A高表达组(n=181例)和FAM50A低表达组(n=180例)。经统计分析得FAM50A表达量与HCC患者的性别、肝硬化、脉管癌栓相关,与年龄、甲胎蛋白水平、肿瘤大小、肿瘤病理分期、肿瘤分化程度及是否远处转移无关。见表1。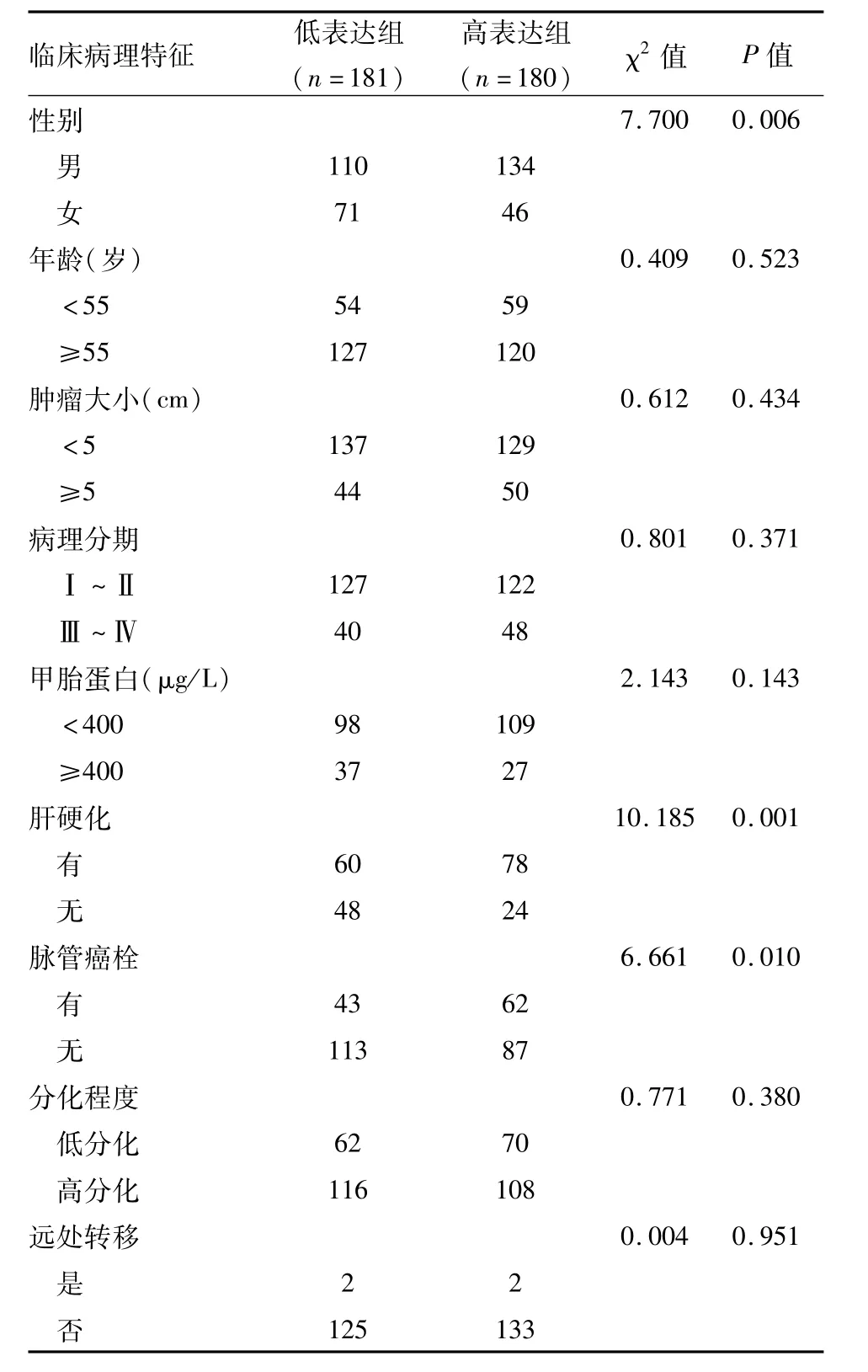
表1 FAM 50A表达水平与HCC患者临床病理特征的关系(n)
2.4 FAM50A表达水平与HCC患者预后的关系
Kaplan Meier Plotter数据库分析结果显示FAM50A高表达组247例患者的中位生存时间为45.7个月,低表达组117例患者的中位生存时间为81.9个月。与FAM50A低表达组相比,FAM50A高表达组的预后更差,差异有统计学意义(HR=2.31,P=6.1×10)。见图8。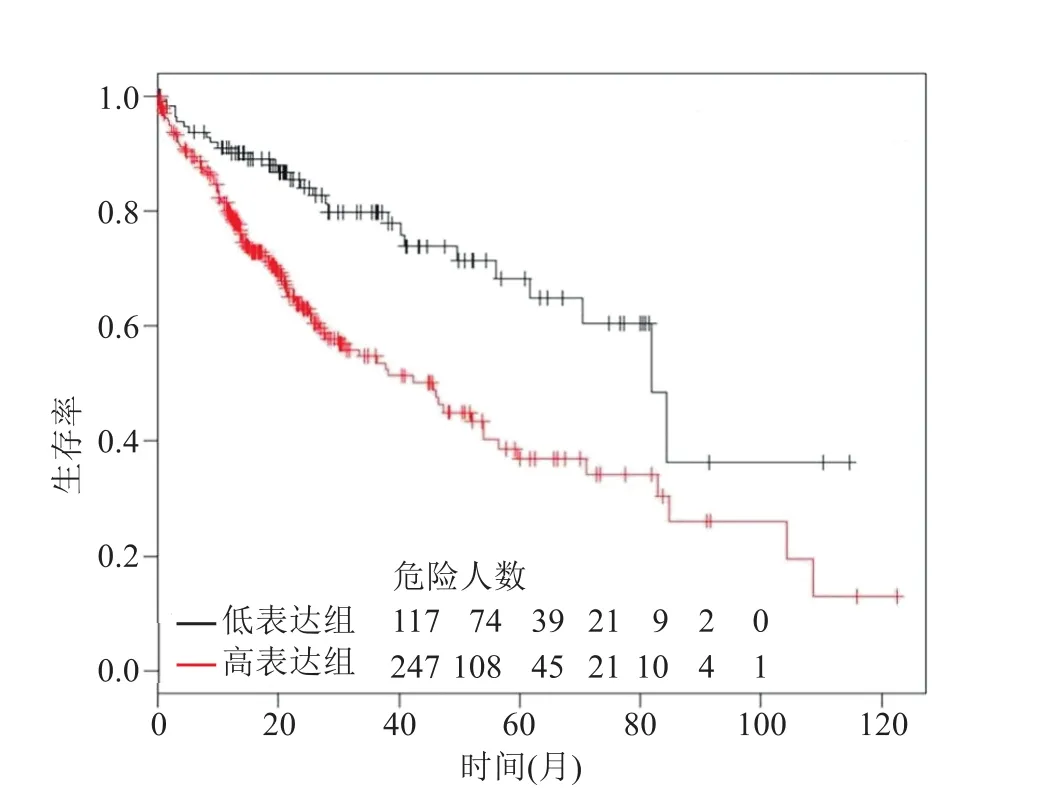
图8 FAM 50A高表达组与低表达组患者的生存曲线
2.5 FAM50A启动子区甲基化水平分析
MethHC分析结果显示FAM50A的转录模板为NM_004699,与正常肝组织相比,FAM50A在HCC组织中的启动子区甲基化水平降低,差异有统计学意义(P<0.005)。见图 9。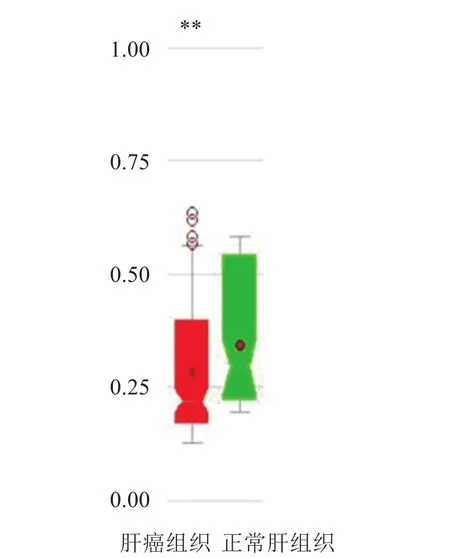
图9 FAM 50A启动子区甲基化水平分析
2.6 FAM50A可能存在的蛋白相互作用网络
String数据库分析结果表明,与FAM50A相互作用得分排名前10的蛋白分别为:SF3B3、ATP6AP1、NSFL1C、PDAP、TPD52L2、NAPA、METTL2A、RSU1、THOC2、CIAPIN1。见图10。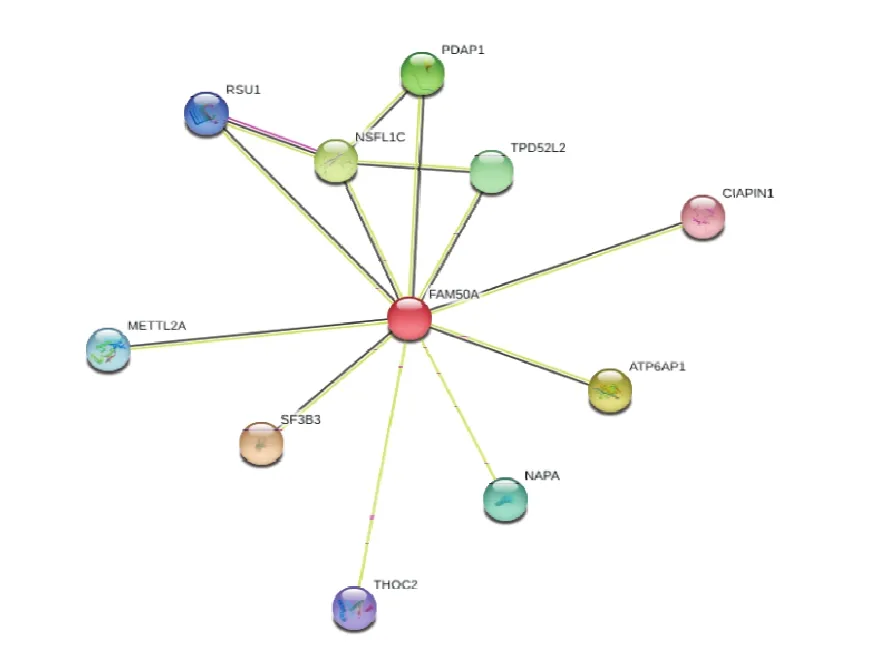
图10 FAM 50A可能存在的蛋白相互作用网络
2.7 FAM50A功能富集分析
GSEA研究结果显示FAM50A mRNA高表达样本富集到MAPK信号通路(P=0.022)、Wnt信号通路(P=0.018)、Notch信号通路(P=0.026)等相关基因集。且其mRNA表达水平与上述通路中的基因表达呈正相关,即当FAM50A基因表达上调时,上述通路被激活。见图11。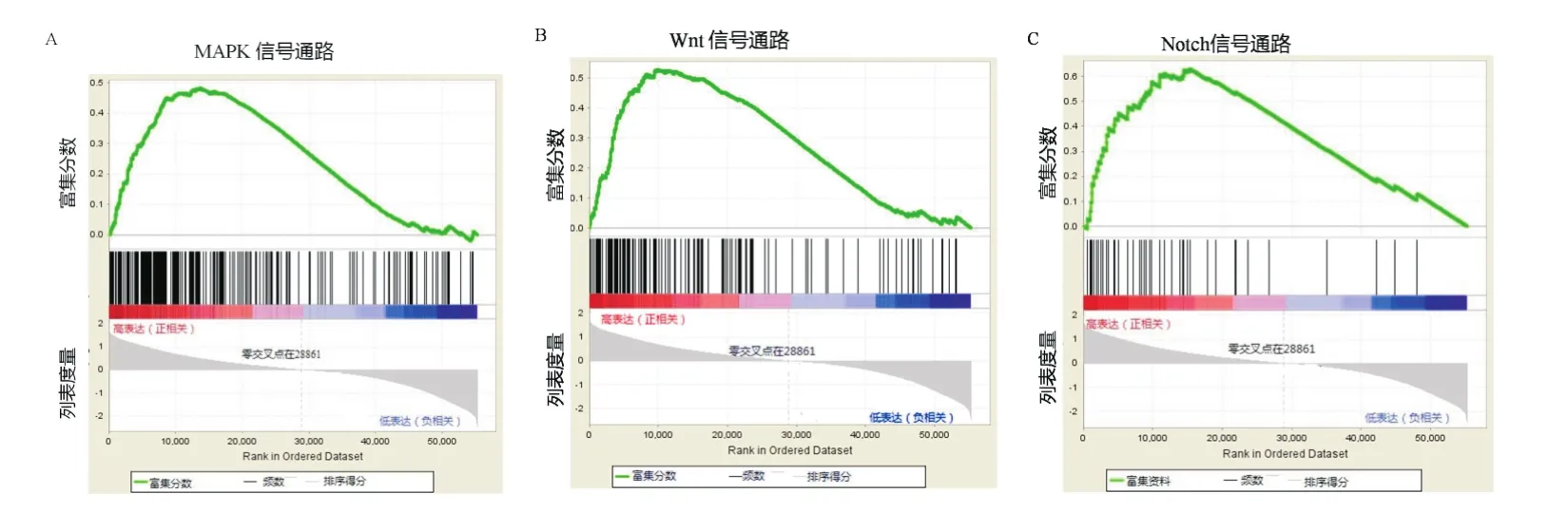
图11 FAM 50A mRNA高表达相关基因集的富集
3 讨论
目前,国内外关于FAM50A的研究报道甚少,FAM50A的功能尚未明确。Kostianets et al报道FAM50A作为髓样乳腺癌自身抗原,FAM50A蛋白在大多数乳腺癌组织和非癌乳腺组织中均有表达,且无显著差异。但其在HCC中的表达未知。本研究中,HPA数据库分析结果显示FAM50A在人体不同组织及不同肿瘤中表达水平均有差异。可能原因是组织特异性的存在、参与的信号调节机制不同及表观遗传修饰的不同等。本研究45例HCC临床样本及数据库研究结果均证实FAM50A在HCC组织中的表达量高于正常肝组织。
HPA数据库中,FAM50A蛋白在正常肝组织中主要定位在细胞质、细胞膜及细胞核,在HCC组织中主要定位在细胞核。细胞免疫荧光染色结果显示FAM50A定位在细胞核。Mazzarella et al研究表明FAM50A具有核定位信号。Kostianets et al报道免疫组化染色结果显示FAM50A在大多数乳腺癌组织及乳腺正常组织中定位在细胞核和细胞质,且与乳腺正常组织相比,FAM50A在乳腺癌组织中的核染色更强。本研究结果与国外文献报道基本一致。
男性罹患HCC的风险明显高于女性,据统计男女之比为7~10∶1左右。脂联素水平降低是男性HCC风险增加的原因。肝硬化是HCC患者发病的主要危险因素,在一定程度上决定HCC患者肝切除的安全性及长期疗效。张长坤 等表明脉管癌栓是影响HCC患者预后的独立因素。本研究结果表明FAM50A表达量与HCC患者的性别、肝硬化、脉管癌栓相关。与国内外文献报道基本一致。本研究中,与低表达组相比,FAM50A高表达组患者的预后更差,病死率更高,提示FAM50A有可能成为预测HCC的候选生物标志物。
本研究结果表明,与正常肝组织相比,FAM50A在HCC组织中的启动子区甲基化水平降低。张玉鹏等报道,在特定条件下,基因启动子区甲基化修饰会下调基因的表达亦或促进基因的表达,基因启动子区甲基化水平越高,该基因mRNA表达水平越低。本研究结果提示FAM50A启动子区甲基化水平降低可能是调节HCC组织中FAM50A表达水平升高的因素之一。
Anver et al研究表明 FAM50A是一种染色质蛋白,通过与H2A.Z蛋白相互作用,在不同生物体中起染色质调节作用。Kim et al研究表明FAM50A与Runx2相互作用,正向调节成釉细胞的分化,上调釉原蛋白、釉白蛋白及釉质蛋白的表达。上述2项国外研究结果提示FAM50A通过与相互作用蛋白作用发挥功能。本研究结果表明在HCC中与FAM50A相互作用的蛋白有SF3B3、ATP6AP1、NSFL1C等,可为FAM50A在HCC发生发展中的功能研究提供新线索。
Wang et al报道 miR-370通过下调 BEX2基因,抑制 MAPK/JNK信号通路的激活,从而抑制HCC的发生发展。研究表明Wnt信号通路具有调节细胞增殖、胚胎正常发育及维持细胞内稳态等作用。Wnt/β-catenin信号通路异常激活可导致HCC恶性进展。Huang et al报道Notch信号通路异常将导致肿瘤发生,尤其是HCC,该通路通过调节肿瘤微环境在HCC发生发展中发挥关键作用。本研究结果与国外文献报道基本一致。本研究推测FAM50A在HCC中发挥功能的可能信号通路为MAPK信号通路、Wnt信号通路、Notch信号通路等。这为FAM50A在HCC中的作用机制研究提供了更多线索。
综上所述,该研究团队利用多数据库及该院病例资料证实FAM50A在HCC中高表达,且与HCC恶性程度及不良预后相关,可能在HCC发生发展中发挥促进作用。

