奥硝唑损害鼠精子线粒体功能诱导大鼠弱精子症的病理机制
杨雪梅,李广森,张培海,尤耀东,黄晓朋,陈帝昂,常德贵
男性不育症是指因男方的某些因素导致婚后1年以上,性生活规律且未采取任何避孕措施而女方未孕的一类疾病。目前尚未有治疗少、弱精子症的特效药物,通过构建动物少弱精子症模型并进行药物干预,来研究少弱精子症的发病机制及药物干预机制是男性不育的研究热点。奥硝唑是第三代硝基咪唑类衍生物,具有良好的抗厌氧菌及原生质感染的作用,其结构上的硝基在体内转化为活性更高的胺类损伤微生物DNA是其可能的抗微生物机制,但硝基转化过程中会有大量氨基及自由基生成,而精子对氧化攻击极为敏感,容易受损使精子功能降低,导致不育。目前奥硝唑用于少弱精子症模型制备的相关报道较多,但其影响生殖功能的具体机制尚不清楚。该研究通过对SD大鼠进行不同剂量的奥硝唑灌胃处理,来研究其建模效果、可能的病理机制及对线粒体功能的影响,旨在为少弱精子症的研究提供理论基础。
1 材料与方法
1.1 实验动物
SPF级雄性SD大鼠40只,体质量200~220 g,购于成都达硕实验动物有限公司[许可证号:SCXK(川)2015-030],所有SD大鼠均饲养在成都达硕生物科技有限公司屏障环境动物房[SYXK(川)2019-189],培育室温度 20~25℃,湿度保持在65%~70%,进行人工光照(12 h/12 h昼夜),大鼠全天自由饮水,常规饲料饲养。1.2 主要试剂与仪器
奥硝唑(批号160206)购自四川百利药业有限责任公司;酸性磷酸酶(acid phosphatase,ACP)、碱性磷酸酶(alkaline phosphatase,ALP)、乳 酸脱氢酶 (lactate dehydrogenase,LDH)、琥珀酸脱氢酶 (succinate dehydrogenase,SDH)、超氧化物歧化酶 (superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)酶联免疫吸附(ELASE)试剂盒(批号:20150104、20150125、20150108、20150115、20150114、20150105)购自南京建成生物工程研究所;JC-1检测试剂盒(J)(批号20151109)购自上海碧云天生物技术公司;迈朗一次性精子计数板购自南宁松景天伦生物科技有限公司;Olympus BX60光学显微镜购自日本Olympus公司;GF 1755011型全自动酶标仪购自英国Anthos公司;CF16 RXII型高速冷冻离心机购自日本Hitachi公司;MACSQuant Analyzer 10型流式细胞仪购自德国美天旎生物技术有限公司;LKB-NOVE型超薄切片机购自瑞士DAKO公司;JEM-1230型透射电镜购自日本JEOL公司。1.3 实验动物分组与药物处理
将40只SD大鼠随机分为对照组及奥硝唑低、中、高剂量组各10只,奥硝唑组分别给予 200、400、800 mg/(kg·d)奥硝唑(0.5% CMC-Na制成)灌胃处理,对照组给予等量的0.5% CMC-Na溶液灌胃,共持续4周。1.4 样本采集及处理
末次给药30 min后,3.5%水合氯醛麻醉后断头处死大鼠,冰上迅速取出睾丸、附睾组织,清除组织外脂肪后,用4℃0.9%氯化钠溶液冲洗干净,称取睾丸、附睾重量,用于计算脏器指数=脏器重量(g)/体质量(g)×100%;取部分左侧附睾尾部,剪碎后放置在含有1 ml 37℃ Ham′s F 10培养液的无菌杯中,温浴30 min,检测精子浓度及活力;取剩余部分的睾丸及附睾组织0.1~0.2 g于匀浆管中,根据组织重量与PBS体积比1∶9加入PBS溶液,剪成碎块后制成10%匀浆液,低温3 500 r/min离心 15 min后,取上清液保存于-80℃待测;取右侧的附睾及睾丸,分为2份,1份用4%的多聚甲醛固定,进行常规脱水、包埋、切片后用于组织形态学观察,另取部分附睾头部位置,剪成1 mm×1 mm×1 mm的小块,用4%的戊二醛固定,用于电镜观察。1.5 大鼠一般情况观察
所有大鼠从开始处理之后,每周进行1次称重,并每日观察记录大鼠的外观体征、行为活动、摄食及排便等一般情况。1.6 精子质量的检测
取1.4中制备好的精子悬液,吸出10μl加入含990μl的离心管中混合均匀,将稀释后的精子悬液滴加到预热的一次性精子计数板上,使用WLJY-9000型精子质量检测系统对精子质量进行分析。所有的操作均由同一人操作完成以减少实验误差。1.7 睾丸及附睾组织形态学观察
取1.4中制备好的睾丸及附睾组织切片,行常规脱蜡脱水后,进行HE染色,利用Olympus光学显微镜观察睾丸及附睾组织形态结构变化。1.8 睾丸及附睾组织匀浆中 ACP、ALP、LDH、SDH、SOD、MDA活性的检测
取1.4中制备好的组织匀浆,由专业的检验人员按照试剂盒操作说明进行 ACP、ALP、LDH、SDH、SOD、MDA活性的检测。1.9 精子线粒体超微结构的观察
取1.4中固定好的附睾头部组织,参考文献方法,PBS浸洗2 h后,1%的四氧化锇固定液继续固定1 h,完成后PBS冲洗10 min,洗尽固定液;乙醇梯度脱水后,70%的醋酸铀乙醇饱和液中浸泡12 h,继续80%、95%的乙醇中脱水15 min,无水乙醇中脱水2次,40 min/次;环氧树脂浸透包埋后,切成1~2μm的半薄切片,亚甲蓝染色后光学镜下观察定位后切成50~70 nm的超薄切片,醋酸铀和柠檬酸铅双染色15 min后,ddHO冲洗3次,15 min/次。透射电镜下观察附睾精子线粒体超微结构并拍照。1.10 精子线粒体膜电位检测试验
将1.4中制备的精子悬液用200目的滤网进行过滤直至上清液变清后,加入0.9%氯化钠溶液调整悬液浓度为2×10/L,将调整好的悬液添加到6孔板上,PBS缓冲液冲洗1次后,加入1 ml JC-1工作液,混合均匀后37℃的5% CO的培养箱中孵育20 min,并将JC-1染色缓冲液按1∶5的比例稀释,孵育结束后,吸去上清液,用稀释后的JC-1缓冲液清洗3次后,加入流式细胞测试缓冲液后上机,检测红绿光信号比例,红色信号表示线粒体膜电位正常,绿色表示膜电位丧失,以红色荧光精子百分率表示线粒体膜电位正常精子比例。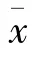
2 结果
2.1 大鼠一般情况
对照组大鼠实验过程中精神状态良好,活动反应正常,体质量增长迅速;奥硝唑低、中、高剂量组大鼠均出现不同程度的少动、反应迟缓、倦态萎靡的情况,进食量减少,体质量增长缓慢,毛色稀松无光泽,并且高剂量组大鼠出现症状的时间及症状的严重程度要早于奥硝唑中、低剂量组。2.2 奥硝唑对大鼠脏器指数、精子浓度、活力、活率的影响
与对照组相比,奥硝唑低、中、高剂量组大鼠的体质量增量、睾丸、附睾脏器指数、附睾的精子浓度、活率及活力均显著降低,且呈浓度依赖,差异有统计学意义(P<0.05)。见表1。2.3 奥硝唑对大鼠睾丸及附睾组织形态的影响
HE染色结果(图1)显示:对照组大鼠的睾丸及附睾生精小管生精细胞排列整齐,且各级生精细胞之间层次清晰,并在管中可见大量的精子生成;低、中剂量奥硝唑处理后可见大鼠睾丸及附睾中生精细胞数目减少,细胞排列出现紊乱,但可以看到大致层次,并且有部分生精细胞脱落,附睾管内有非精子细胞成分存在,精子数减少;高剂量奥硝唑处理后大鼠中睾丸生精小管间距明显变宽,生精细胞大量减少,并可见大量的坏死脱落的生精细胞,管壁生精细胞的排列紊乱,层级基本消失,附睾管明显萎缩,管腔内精子数量减少,可见大量非细胞成分。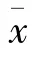
表1 各组大鼠脏器指数、精子浓度、活力、活率情况(±s,n=10)
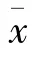
表2 各组大鼠附睾组织中ACP、ALP、LDH、SDH、SOD、MDA活性比较(±s,n=10)
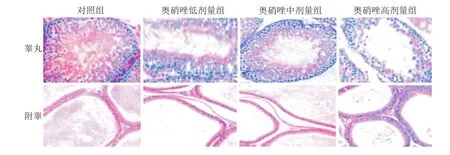
图1 各组大鼠睾丸及附睾的HE染色结果 ×200
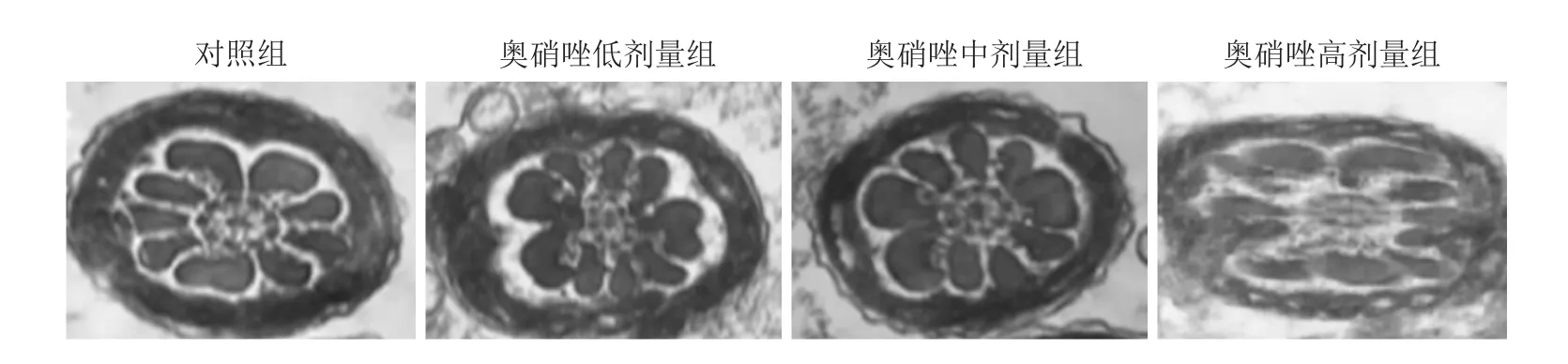
图2 各组大鼠精子尾部线粒体中段横切电镜结果 ×40 000
2.4 奥硝唑对大鼠附睾组织中ACP、ALP、LDH、SDH、SOD、MDA活性的影响
与对照组相比,奥硝唑低、中、高剂量组大鼠附睾组织中ACP、ALP、LDH、SDH、SOD活性均显著降低,MDA水平显著升高,且呈浓度依赖,差异有统计学意义(P<0.05)。见表2。2.5 奥硝唑对大鼠精子线粒体结构及膜电位的影响
电镜结果(图2)显示:对照组大鼠精子尾部中段横切可见完整的线粒体鞘,并成环形包裹着内部9根外周致密纤维、9根轴丝及2个微管,呈结构清晰的9+9+2结构;低、中剂量奥硝唑干预大鼠精子的线粒体鞘有部分损伤及轻微肿胀,内部致密纤维、轴丝结构比较完整,尚能看出9+9+2结构;高剂量奥硝唑干预大鼠精子壳体出现严重肿胀,大小不一,有空腔出现,并且内部轴丝断裂,9+9+2结构被破坏。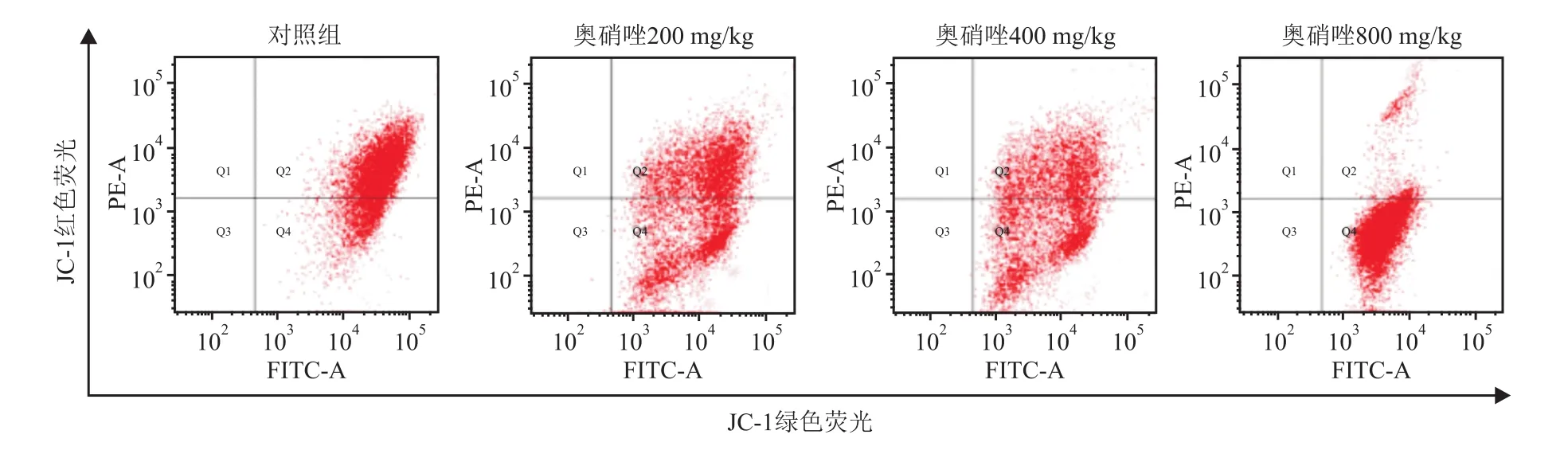
图3 各组大鼠精子线粒体膜电位染色细胞流式结果
JC-1染色结果(图3)显示:与对照组(73.94%±12.61%)相比,低(54.39% ±9.52%)、中(42.95%±10.53%)、高(7.28% ±3.65%)奥硝唑剂量组大鼠精子线粒体的膜电位正常比率均显著降低,且呈浓度依赖(F=83.891,P<0.001)。
3 讨论
奥硝唑是临床较为常用的一种构建大鼠模型的药物,相关研究表明,中剂量的奥硝唑从处理后的第2周开始就会使大鼠表现出不育症状,但对生精功能不会有特别影响,但高剂量处理不仅会降低精子的活力还能够影响大鼠的生精能力。虽然通过药物处理能够一定程度上的模拟男性不育症的病理变化,但引起不孕症的因素较多,因此在造模的时候应该从多因素来进行考虑,所以本研究通过采用不同剂量奥硝唑处理来进行建模,并对其可能病理机制进行了分析。通过对不同剂量奥硝唑处理的大鼠一般情况观察显示,其出现明显少动、反应迟缓、倦态萎靡的情况,并且进食量减少、体质量增长缓慢。对精子浓度、活力、活率等进行分析显示,不同剂量奥硝唑处理后上述指标均显著减低,且呈浓度依赖,表明增加奥硝唑的药物剂量会加重少弱精子症病情。对睾丸及附睾的组织学形态观察显示,中、低奥硝唑处理时对睾丸及附睾的病理损伤较轻,而高剂量奥硝唑处理后这种损伤程度加深,因此对于生殖器官损伤引起的少弱精子症的研究可以通过采取高剂量奥硝唑处理的方式进行建模并对其可能病理机制进行分析。
精子尾部线粒体主要通过糖酵解产生ATP来支持精子运动,只有线粒体功能完整才能确保精子能够运动足够长的时间来进入卵细胞完成受精。活性氧在人精子相关的病理方面有较多的研究,精子主要是由不饱和脂肪酸和线粒体组成的,其内胞浆极少,而活性氧对于脂膜的攻击会使得精子极易发生过氧化反应,破坏线粒体膜结构,功能丧失,合成ATP能力减弱,从而使得精子活力减弱。ACP和ALP是睾丸中葡萄糖磷酸化通路的关键酶;LDH是精子细胞的标志酶,主要反映精子的糖酵解代谢过程,其活性降低表示生精细胞的ATP的产生不足;SDH则是睾丸线粒体中的主要标志酶,主要为精子提供能量。本研究结果表明,不同剂量奥硝唑处理后,大鼠附睾组织匀浆中ACP、ALP、LDH、SDH、SOD活性均显著降低,MDA水平显著升高,表明睾丸及附睾组织的能量代谢受到显著抑制,并且氧化还原平衡被打破,有明显的脂膜过氧化情况,可能是因为奥硝唑被机体摄入后,经代谢产生大量的活性氧,攻击生精细胞及精子的脂膜,主要能量代谢场所线粒体被破坏,能量代谢受到影响,从而影响精子活力。电镜下精子的线粒体超微结构观察也显示,高剂量奥硝唑处理后线粒体9+9+2超微结构有明显崩解,线粒体膜电位正常精子数也明显降低,进一步证实了奥硝唑引起少精、弱精的生殖毒性是通过破坏线粒体功能来完成的,与Siva et al的研究一致。
综上所述,奥硝唑诱导大鼠弱精子症可能是通过诱导睾丸及附睾内的氧化应激损伤,破坏线粒体功能,使能量代谢受阻,无法提供足够能量给精子,继而影响睾丸及附睾的生精功能及精子的活力。该研究采用不同浓度奥硝唑建模成功,可供临床相关研究方向参考。

