乙醛脱氢酶2基因的可变剪接分析*
夏万松,夏英,韦四喜,周春欢,杜洪,袁婷,金泳,黄海*
(1.贵州医科大学 医学检验学院,贵州 贵阳 550004;2.贵州中医药大学第一附属医院 检验科,贵州 贵阳 550001;3.贵州医科大学附属医院 临床检验中心,贵州 贵阳 550004;4.贵航贵阳医院 检验科,贵州 贵阳 550009)
人类基因组中超过90%的基因转录后发生可变剪接[1-3]。在可变剪接的过程中,剪接复合体选择不同的5′ 端或3′ 端剪接位点,导致外显子的包含或跳跃[4-5],同一基因产生多种成熟的RNA变异体[6-7],并翻译出多种蛋白质亚型[8-9],导致这些蛋白质亚型的功能差异甚至完全相反[10-11],例如人类线粒体核糖体蛋白L33(mitochondrial ribosomal protein L33,MRPL33)基因在胃癌中通过可变剪接产生MRPL33-L和MRPL33-S两个转录本,MRPL33-S通过抑制PI3K/AKT/CREB信号通路诱导细胞凋亡,而MRPL33-L功能则相反[12]。由此可见,可变剪接在机体生理病理的过程中都发挥非常重要的作用。人类乙醛脱氢酶2(aldehyde dehydrogenase 2,ALDH2)是19种乙醛脱氢酶同工酶之一,在催化有毒醛方面起着关键的作用[13-15]。ALDH2对乙醛的Km值约为0.2 μmol,是19 种同工酶中最低的,是对醛类亲和力最高的同工酶[16-17]。因此,在人类不同的ALDH同工酶中,ALDH2是清除体内有毒醛最为有效的酶[18-19]。在美国国家生物技术信息(national center for biotechnology information,NCBI)数据库中,ALDH2被报道位于染色体12q24.12,存在两个变异体(variant,V),ALDH2 V1共13个外显子,编码的蛋白质为517氨基酸(amino acid,aa);ALDH2 V2共12 个外显子,编码的蛋白质为470 aa。与ALDH2 V1相比,ALDH2 V2缺少外显子3,长度为141核苷酸(nucleotide,nt)(https://www.ncbi.nlm.nih.gov/gene/217),见图1。然而,ALDH2在可变剪接方面的研究未见报道,因此,本研究采用胃癌细胞作为模型研究ALDH2基因发生可变剪接的现象。为了确定人类ALDH2基因发生可变剪接的情况,本研究在正常胃黏膜上皮细胞GES-1、胃癌细胞(AGS、HGC-27、MKN45)及正常人外周血中,通过逆转录-聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)检测ALDH2基因发生可变剪接的情况,以期为ALDH2基因在可变剪接方面的研究提供实验基础。

图1 在NCBI数据库中ALDH2存在两个变异体
1 材料与方法
1.1 材料
1.1.1材料 GES-1、AGS、HGC-27、MKN45细胞购买于中国科学院上海生命科学院,正常人外周抗凝全血收集于贵州医科大学附属医院,于-80 ℃冰箱保存。本实验经贵州医科大学附属医院伦理委员会批准。
1.1.2主要试剂及仪器 1640培养基、DMEM培养基购于美国Gibco公司,胎牛血清(fetal bovine serum,FBS)购于乌拉圭Lonsera公司,红细胞裂解液购于北京索莱宝科技有限公司,总RNA提取试剂盒、TRIZOL reagent、T载体PCR产物快速连接试剂盒、DNA纯化试剂盒购于生工生物工程(上海)股份有限公司,实验所需引物由生工生物工程(上海)股份有限公司合成,克隆质粒测序由生工生物工程(上海)股份有限公司完成,RT试剂盒购于TaKaRa公司,Taq DNA聚合酶购于美国Vazyme公司,ABI Pro FlexTM梯度PCR扩增仪(美国Thermo Scientific公司)、琼脂糖水平电泳仪(北京六一生物科技有限公司)、GeneGnome凝胶成像分析仪(美国Bio-Rad公司)。
1.2 方法
1.2.1细胞培养 GES-1、AGS、HGC-27细胞在含有10% FBS的1 640培养基中培养,MKN45细胞在含有10% FBS的DMEM培养基中培养,所有细胞在37 ℃,5% CO2湿化培养箱中培养,当细胞生长融合率为80%左右时收获细胞。
1.2.2引物设计 在NCBI数据库下载ALDH2基因的基本信息。设计正向引物F46(位于外显子1)、正向引物F80(位于外显子1)、反向引物R441(位于外显子3)、反向引物R493(位于外显子4)用于ALDH2基因的可变剪接分析。引物序列见表1。
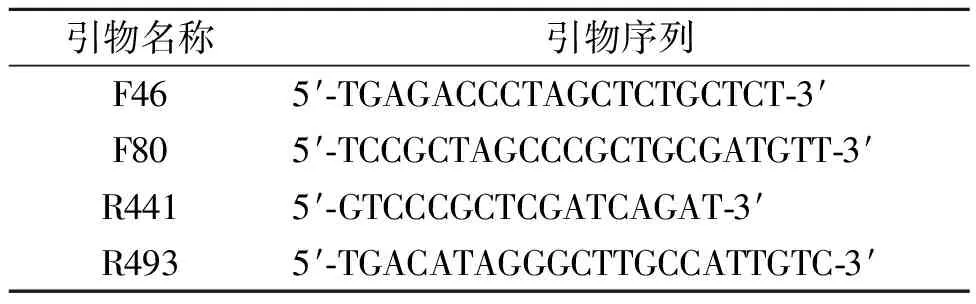
表1 ALDH2引物序列
1.2.3外周血白细胞(WBC)、细胞总RNA提取及RT为互补脱氧核糖核酸(complementary DNA,cDNA) 根据索莱宝红细胞裂解液产品说明书裂解人外周抗凝全血红细胞,用于提取WBC总RNA。根据生工总RNA提取试剂盒说明书提取WBC和细胞总RNA用于RT为cDNA。取5 μg总RNA按照TaKaRa RT试剂盒制造说明书进行RT反应获得第一链cDNA。
1.2.4PCR扩增及测序 以WBC和细胞的cDNA为模板,用表1相应的引物进行PCR扩增分析ALDH2基因发生可变剪接的情况。PCR体系(25 μL):2×Green Taq Mix 12.5 μL,正反向引物各1 μL,模板1 μL,ddH2O 9.5 μL。PCR反应程序:94 ℃预变性4 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,共40 个循环后72 ℃延伸4 min。PCR产物经2%琼脂糖凝胶分离,根据生工DNA纯化试剂盒说明书回收目的DNA片段。目的DNA片段根据生工T载体PCR产物快速连接试剂盒说明书连接至T载体,然后进行TA克隆后送生工测序。
1.2.5生物信息学分析 使用BLAST工具进行核苷酸序列比对分析。使用DNAStar软件分析ALDH2变异体的开放阅读框(open reading frame,ORF)。
2 结果
2.1 RT-PCR检测ALDH2基因发生可变剪接情况
NCBI数据库中ALDH2基因mRNA的示意图见图2A。在外显子1设计两个正向引物,在外显子3和4各设计1个反向引物,引物示意图见图2A。用正向引物F80和反向引物R493进行PCR扩增WBC的cDNA,在琼脂糖凝胶中意外地发现3个条带,见图2B。位于顶部分子量最大的带经TA克隆测序证实为V1。最底部的带经TA克隆测序证实为一个新的变异体(命名为V1-1),与V1相比缺少191 nt。通过TA克隆测序证实中间的带为V1和V1-1形成的异二聚体(heterodimer,HD)。用正向引物F46和反向引物R441进行PCR扩增人类胃癌细胞(AGS、HGC-27、MKN45)、人胃黏膜上皮细胞GES-1和WBC的cDNA,在琼脂糖凝胶中发现4个条带,见图2C。位于顶部的带经TA克隆测序证实为V1。底部的3条带通过TA克隆测序证实为3个新的变异体(分别命名为V1-2、V1-3、V1-4),这3个新的变异体都缺少V1的部分序列,分别是226 nt、240 nt及289 nt。利用图解展示V1与新发现的变异体之间的差异。见图2D。
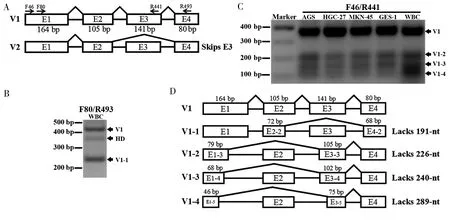
注:A为ALDH2基因mRNA及引物示意图(仅展示V1和V2的5′端的几个外显子),B为RT-PCR扩增WBC的琼脂糖凝胶结果,C为RT-PCR扩增胃癌细胞(AGS、HGC-27、MKN45)、GES-1、WBC的琼脂糖凝胶结果,D为ALDH2 mRNA变异体示意图。
2.2 ALDH2变异体生物信息学
在NCBI数据库中,V1(NM_000690.4)仅1个翻译起始密码子ATG(mRNA为AUG),位于51~53位核苷酸,V1的翻译终止密码子TAA(mRNA为UAA)位于1 602~1 604位核苷酸。使用DNAStar软件分析V1的ORF,确定了V1总共存在8个ORF,每个ORF长度都超过100个氨基酸,但是末端翻译终止密码子TAA都在1 602~1 604位核苷酸,见图3A。使用DNAStar软件分析出V1-1最长的ORF,其翻译起始密码子ATG位于外显子2。这是由于V1-1缺少的核苷酸数目非3的倍数,相当于导致移码突变。因此,V1-1的蛋白质N末端的20氨基酸与其他所有蛋白质都不同,而C末端的391氨基酸与V1是相同的,见图3B。使用DNAStar软件分析出V1-2、V1-4最长的ORF是相同的。与V1相比,V1-2和V1-4的蛋白质氨基酸缺少N端的95氨基酸,示意图见图2B。使用DNAStar软件分析出V1-3最长的ORF,其翻译起始密码子ATG与V1一致,翻译终止密码子TAA在1 362-1 364位核苷酸。因此V1-3的蛋白质氨基酸与V1相比,缺少7~86位氨基酸,见图2B。

注:A示对ALDH2变异体1的ORF进行生物信息学分析,“start nt”表示ATG的核苷酸“A”在cDNA序列中的位置(仅展示长度超过100氨基酸的ORF),B示对ALDH2变异体蛋白质氨基酸进行生物信息学分析(垂直对齐在同一位置的方框表示相同的氨基酸序列,黑色方框表示的氨基酸序列不存在于其他任何蛋白质中,方框中的数字表示蛋白质的氨基酸数目)。
3 讨论
真核生物的生命活动是一个极其复杂的过程,需要依赖机体内的各种蛋白质在正确的时间或者空间发挥正确的生理功能,如此才能保证机体生命活动的完成;真核生物复杂的生命活动最终还是靠蛋白质精细的完成[20]。组成一个哺乳动物大约需要10万个基因,而实际数字不到这个数字的四分之一[21]。现在的研究已证实,由于Pre-mRNA转录后发生可变剪接,通过这一过程,可以从单个基因产生多种不同功能的mRNA,从而翻译出功能不同的蛋白质[22-24]。本研究发现ALDH2的4个变异体都是V1通过可变剪接形成的。V1-3缺少的核苷酸数目是3的倍数,并且位于V1的翻译起始密码子ATG之后。V1-3以V1对应的翻译起始密码子ATG作为其翻译起始密码子,翻译出蛋白质的N末端会缺少V1的部分氨基酸序列。本研究认为V1-3表达出蛋白质的可能较大。相反的是,V1-1、V1-2、V1-4缺少的核苷酸数目均不是3的倍数。V1-1和V1-2缺少的核苷酸位于V1的翻译起始密码子ATG之后,V1-1和V1-2以V1对应的翻译起始密码子ATG作为其翻译起始密码子,翻译出的蛋白质除N末端很小部分与V1相同外,C末端与V1完全不一致。因为V1-1和V1-2被翻译出的蛋白质相当于移码突变,大部分氨基酸序列与V1不一致,这也许可当作一种新的蛋白质。因此,V1-1和V1-2是否真正被翻译出蛋白质,本研究并不明确,并未做进一步的研究。有趣的是,V1-4缺少的核苷酸包含了V1对应的翻译起始密码子ATG。如果V1-4翻译出蛋白质,显然,其翻译起始密码子ATG将不再是V1对应的翻译起始密码子ATG,将会是靠近3′末端的ATG。无论V1-4以3′末端的任何ATG作为翻译起始密码子,翻译出的蛋白质始终缺少V1 N末端的部分氨基酸。然而,V1编码的蛋白质N末端的17 个氨基酸是它进入线粒体基质发挥功能的信号肽[25]。V1-4翻译出的蛋白质在没有N末端信号肽存在的情况下,其是否还能进入线粒体发挥催化乙醛的功能,这是未知的。
综上,ALDH2通过可变剪接可以产生多个mRNA变异体,并很可能产生多种蛋白质。这些蛋白质的氨基酸序列可能与V1相同,也可能不相同。提示ALDH2存在复杂的蛋白表达功能,在机体内扮演非常重要的角色,也为ALDH2在不同个体酶活力不同,在可变剪接方面的研究奠定了基础。

