胎盘来源外泌体对胎盘血管内皮细胞钙敏感受体和凋亡的影响*
魏艳玲,李志强,毕胜利,王琳冬,杨娜,胡亚欣
(1.河北北方学院附属第二医院 病理科, 河北 张家口 075100; 2.顺义妇儿医院, 北京 101300;3.贵州医科大学附属医院 产前诊断中心, 贵州 贵阳 520004)
妊娠期高血压是由多种诱发因素引起的综合性疾病,主要表现高血压、蛋白尿、浮肿等临床症状,严重的威胁孕妇和胎儿的健康[1]。研究发现,妊娠期高血压主要引起胎盘组织缺血、缺氧,导致机体的炎症和血管内皮功能障[2],血管内皮损伤或功能障碍是妊娠期高血压疾病发生的重要影响因素[3]。钙超敏是指血管平滑肌细胞收缩蛋白对钙的敏感性升高,是诱发妊娠期高血压的重要原因[4]。因此,通过调控血管钙敏感性对改善妊娠期高血压具有重要的意义。钙敏感受体(calcium sensing receptor,CaSR)是属于G蛋白偶联受体C家族成员,可通过介导细胞内Ca2+释放和Ca2+内流而达到调控Ca2+浓度的目的,CaSR广泛分布于血管及血管内皮细胞中[5]。有研究证实,CaSR参与了人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)Ca2+内流和一氧化氮(NO)的合成[6]。在鼠的肠系膜动脉和猪冠状动脉内皮细胞中,采用CaSR激动剂可以激活CaSR而引起中电导系数钙敏感K+通道开放,并介导细胞膜超极化[7],证实CaSR在细胞钙敏感性中发挥重要作用。外泌体是一类直径大小为40~100 nm的细胞膜性囊泡,可通过递送源细胞中的生物学物质,如核酸,蛋白质以及微小RNA等影响周围细胞或自体细胞的功能[8-9],能够促进血管生成,是胎盘血管系统生成,胎儿合适的循环和免疫调节的关键[10]。研究表明,胎盘来源外泌体与妊娠及其并发症存在密切关联[11-12],但是有关胎盘外泌体对血管内皮细胞钙敏感性的作用尚不清楚。本研究分别采用分离得到的妊娠期高血压孕妇或正常孕妇胎盘外泌体与HUVECs共培养48 h,采用蛋白质免疫印迹(Western blot)法检测CaSR蛋白及凋亡相关蛋白Bax、Bcl-2蛋白的表达,TUNEL染色检测内皮细胞的凋亡,探讨高血压孕妇胎盘外泌体对血管钙敏感性的作用。
1 材料与方法
1.1 材料
1.1.1试验样本 选取妇产科分娩的足月妊娠孕妇及妊娠期高血压孕妇作为研究对象,于清晨采集空腹肘外周静脉血3 mL,放置于抗凝管内,静置30 min,2 000 r/min离心10 min分离血浆,放置于-80 ℃保存备用。
1.1.2实验细胞与主要试剂 HUVECs细胞由中科院上海细胞库中心提供,胎牛血清和细胞培养基购买于gibco公司,小鼠抗人Bcl-2和Bax单克隆抗体购买于Cell Signaling Technology公司,兔抗人CaSR购买于SantaCruz公司,兔抗人肿瘤易感基因101蛋白(tumor susceptibility gene 101 protein,TSG101)和溶酶体相关膜蛋白3(CD63)购买于Abcam公司,兔抗人β-actin单克隆抗体购买于Proteintech公司,TUNEL染色试剂盒购买于碧云天公司,实验涉及的耗材购买于中杉金桥公司。
1.1.3实验主要仪器和设备 细胞培养箱(Thermo Scientific公司),-80 ℃超低温冰箱(青岛海尔集团),4 ℃及-20 ℃冰箱(合肥美菱股份有限公司),高速台式冷冻离心机(湖南湘仪实验室仪器有限公司),荧光倒置显微镜(日本Olympus光学工业株式会社),PCR仪器(赛默飞ABI公司),Western Blot检测装置(美国Bio-Rad伯乐公司)。
1.2 方法
1.2.1胎盘外泌体提取 取储存在-80 ℃的血浆并按照SBI提供的ExoQuick试剂盒进行外泌体提取。首先将培养完成的细胞上清液转移至无菌培养皿,并与等体积ExoQuick Exosome precipitation solution(SBI)充分混合,将混合液4 ℃静置20 h,3 000 r/min离心20 min,丢弃上清,再1 500 r/min离心10 min,收集得到外泌体沉淀物。
1.2.2外泌体检测 (1)电镜观察Exosomes:2%戊二醛重悬并固定Exosomes,PBS清洗2次,1%的饿酸固定1 h,PBS清洗2次,乙醇脱水10 min,环氧丙烷浸泡10 min,最后将所取标本浸透、干燥、包埋、聚合、切片、染色,电镜下观察外Exosomes形态学特征;(2)Western blot检测Exosomes标志性蛋白CD63和TSG101表达:Exosomes样品定量,并将提取的Exosomes采用细胞裂解液充分裂解,蛋白SDS-PAGE凝胶电泳,转膜、孵育一抗、孵育二抗、显影,使用胶片曝光,图片扫描后用 Image J 软件计算各条带的灰度值,以各目标条带灰度值与内参β-actin条带灰度值的比值表示目标蛋白的相对表达量。
1.2.3细胞培养与处理 取复苏后的HUVECs细胞按照1×108/L接种于25 cm2塑料培养瓶中后置于37 ℃、5% CO2及饱和湿度条件下培养,24 h后可见细胞贴壁,此时首次换液,然后每2 d换液1次;约3 d细胞长满瓶底,此时进行传代培养,传代用0.25%胰蛋白酶(含 0.02%乙二胺四乙酸)消化2 min,胎牛血清终止消化,按此法反复传代培养增殖。将HUVECs细胞分为3组,正常对照组(Control组)为单独HUVECs细胞,与妊娠期高血压孕妇胎盘来源外泌体共培养的HUVECs细胞作为处理组(Exosome组),与正常孕妇胎盘来源外泌体共培养的的HUVECs细胞作为阴性对照组(negative control,NC组)。将提取得到的外泌体与HUVECs共培养48 h,检测相关指标。
1.2.4HUVECs 细胞CaSR、Bax及Bcl-2表达 采用Western blot法检测,将处理完成的HUVECs放置于1.5 mL的组织研磨管内,按照1 ∶4比例加入细胞裂解液,在已预冷后的细胞组织匀浆仪中进行研磨;4 ℃ 12 000 r/min离心10 min,收集细胞上清液,并进行蛋白质浓度定量检测;每孔上样量为40 μg进行蛋白质凝胶电泳,根据目的蛋白分子量大小以及蛋白marker指示进行切胶,湿转转膜法将蛋白转移至PVDF膜上,脱脂牛奶封闭2 h,孵育对应CaSR(1 ∶500)、Bax(1 ∶1 000)、Bcl-2(1 ∶1 000)及内参照β-actin(1 ∶5 000),4 ℃过夜,加入相应二抗(1 ∶5 000)1~2 h,于摇床摇晃洗膜,含吐温磷酸盐缓冲液(TPBS)洗涤后加入ECL,使用胶片曝光,图片扫描后用 Image J 软件计算各条带的灰度值,以各目标条带灰度值与内参β-actin条带灰度值的比值表示目标蛋白的相对表达量。
1.2.5HUVECs 细胞凋亡 采用TUNEL染色法,去除细胞培养基,PBS洗涤2次,在对应的96孔板内加入50 μL的TUNEL染色液,37 ℃避光孵育1 h,倾去细胞染色液PBS洗涤3次,DAPI染核3 min,PBS洗涤2次,荧光倒置显微镜下观察并拍照。
1.3 统计学分析

2 结果
2.1 胎盘来源外泌体提取与鉴定
如图1所示,透射电镜观察胎盘来源外泌体呈椭圆形或部分圆形形状,直径大小为40~100 nm,Western blot结果显示本研究提取的外泌体高表达CD63和TSG101。提示本研究成功提取到胎盘来源外泌体。
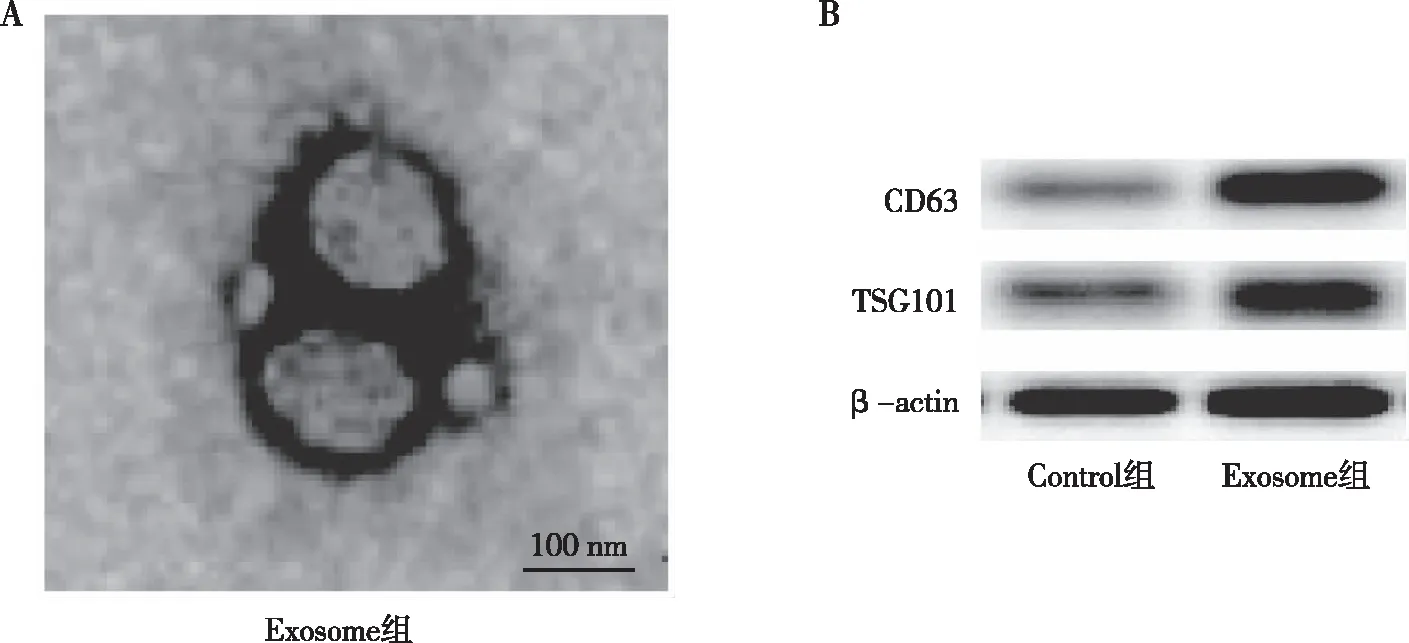
注:A为透射电镜结果,B为Western blot结果。
2.2 CaSR蛋白表达水平
Western blot结果显示,与Control组比较,Exosome组HUVECs细胞CaSR表达明显升高,差异有统计学意义(P<0.01);与NC组比较,Exosome组HUVECs细胞CaSR表达升高,差异有统计学意义(P<0.05)。见图2。
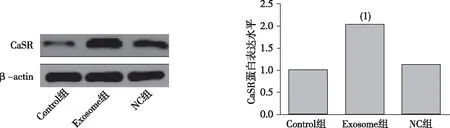
注:(1)与Control组相比,P<0.01。
2.3 HUVECs细胞的凋亡率
TUNEL染色结果显示,与Control组比较,Exosome组HUVECs细胞的凋亡率明显升高(P<0.01);与NC组比较,Exosome组HUVECs细胞凋亡率升高(P<0.05)。见图3。Western blot检测结果显示,与Control组和NC组比较,Exosome组HUVECs细胞Bcl-2表达水平明显降低、差异有统计学意义(P<0.01),Bax表达升高、差异有统计学意义(P<0.05);Control组与NC组Bax、Bcl-2表达水平比较差异无统计学意义(P>0.05)。见图4。
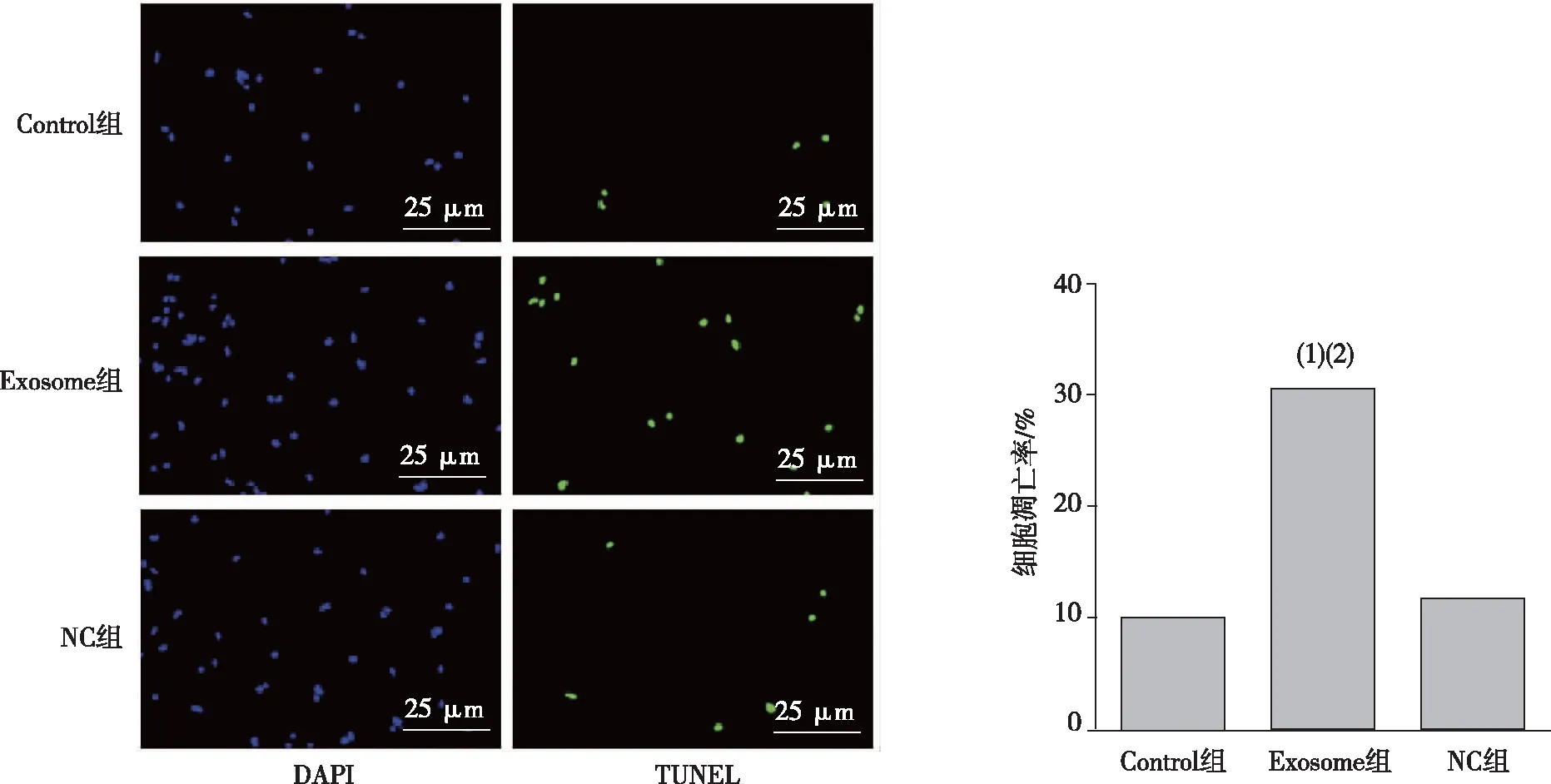
注:(1)与Control组相比,P<0.01;(2)与NC组相比,P<0.05。

注:(1)与NC组相比,P<0.05;(2)与Control组相比,P<0.01。
3 讨论
CaSR在维持全身钙稳态中发挥重要作用,研究已经证实,CaSR可以通过感受细胞外Ca2+浓度改变进而调控细胞功能[13]。CaSR包含N-端细胞外结构域、跨膜区和C-端结构域,传导细胞内各种信号,具有广泛的生物学效应[14]。其中CaSR能够通过作用NOS活性调控NO生成进而参与血管内皮细胞的功能的调节[15]。因此,通过调控CaSR表达对维持内皮细胞的钙敏感性至关重要。
妊娠期高血压是孕妇孕期中常发的一种血管性疾病。其中内皮细胞的功能异常是妊娠期高血压多种血管并发症的病理学基础[16-17]。研究已证实妊娠期高血压患者血管内皮功能会发生明显的病变,导致内皮依赖性血管舒张和收缩功能的异常[18]。胎盘血管的异常是妊娠期高血压患者的主要病变之一。胎盘血管形成有利于维持孕妇宫内胎儿的发育,在妊娠期间胎盘可以通过释放外泌体到达全身的循环系统,参与妊娠期间母胎界面的免疫调节、胎盘血管屏障的形成等重要事件调控[19]。妊娠期并发症,如子痫前期等胎盘功能紊乱相关疾病的发生,可能与胎盘来源外泌体异常密切相关[20]。但是目前有关胎盘来源外泌体与妊娠期高血压孕妇血管的关系及其对血管钙敏感性的作用尚不清楚。因此,本研究前期通过分离并提取了正常孕妇和妊娠期高血压孕妇胎盘来源外泌体并鉴定。结果显示,与对照相比,妊娠期高血压孕妇胎盘来源外泌体含量显著升高,高表达TSG101和CD63,电镜观察外泌体直径大小在40~100 nm,具有细胞膜性囊泡,提示外泌体分离成功。在成功提取得到胎盘来源外泌体后,将外泌体与HUVECs共孵育48 h检测CaSR蛋白表达情况。结果显示,与Control组相比,Exosome组内皮细胞CaSR表达明显升高,NC组对CaSR表达无显著性影响。上述结果初步证实,妊娠期高血压孕妇胎盘来源外泌体可能通过促进CaSR表达增加血管内内皮细胞的钙敏感性进而导致内皮细胞功能障碍。在大鼠急性心肌梗死模型中,大鼠心肌组织CaSRmRNA和蛋白表达均显著性升高,细胞数显著增加,表明CaSR参与心肌梗死的发展,其机制可能与促进细胞凋亡相关[21]。内皮细胞凋亡是血管内皮损伤和功能障碍的重要因素。在妊娠期高血压大鼠胎盘组织中凋亡相关蛋白如Bax,Caspase-3表达显著升高,Bcl-2表达显著降低。表明细胞凋亡与妊娠期高血压胎盘血管病变密切相关[22-23]。本研究再进一步通过TUNEL染色检测外泌体对血管内皮细胞凋亡的影响。与Control组相比,Exosome组血管内皮细胞凋亡率明显升高;NC组无显著性差异,Western blot检测Bcl-2和Bax表达的结果显示:相比Control组,Exosome组血管内皮细胞Bcl-2表达明显降低,Bax表达明显升高;NC组无显著性影响。有研究证实,活化CaSR的蛋白,通过一系列的G蛋白,能调节细胞内钙和MAPK信号途径进而激活诱导细胞凋亡[24-25]。但是本研究结果显示在妊娠期高血压患者发生发展过程中,胎盘来源外泌体能够促进HUVECs细胞CaSR表达增加,但是是否也通过MAPK信号传导途径调控细胞凋亡相关蛋白如Bax,Bcl-2的表达,从而调控血管内皮细胞凋亡的发生,将在下一步研究中进行探讨。
综上所述,胎盘来源外泌体与内皮细胞共孵育能够促进CaSR诱导血管敏感性增加,导致血管内皮细胞凋亡并最终加重妊娠期高血压孕妇胎盘血管损伤。

