钠氢交换体1在氯化锂-匹罗卡品点燃癫痫大鼠模型海马组织内的表达*
彭爽,吴旭玲,于云莉,2,董楝,2,徐祖才,叶兰,冯占辉*
(1.贵州医科大学附属医院 神经内科,贵州 贵阳 550004;2.贵州医科大学 临床医学院 神经病学教研室, 贵州 贵阳 550004;3.遵义医科大学附属医院 神经内科,贵州 遵义 563000)
癫痫是双侧大脑半球神经元异常放电所致的一组综合征,临床表现为反复痫性发作,给患者本人及家庭带来沉重的负担[1-3]。反复癫痫性发作会导致神经元凋亡、坏死及丢失,以及胶质细胞增生等病理变化,随着病程进展,上述病理变化呈逐渐加重趋势[4-6]。尽管对癫痫的相关研究较多[7-8],但其形成的病理生理机制仍不清楚,尚需进一步探索。钠氢交换体1(Na+/H+exchanger-1,NHE1)属于已知钠氢交换体(Na+/H+exchanger,NHE)7个亚型之一[9-10]。有学者对易发癫痫的沙鼠癫痫发作后立即取海马组织进行研究,发现海马中NHE1蛋白在癫痫发作3 h明显升高,6 h恢复正常,故推测NHE1蛋白表达增高与癫痫发生密切有关[11],但不能说明癫痫反复发作的长期过程中NHE1的表达特点。因此,本研究尝试应用慢性癫痫动物模型进一步探索癫痫发作过程中NHE1的表达特点。慢性癫痫动物模型主要包括点燃模型和外伤性模型,点燃模型又包括电点燃模型及化学点燃模型,其中化学点燃模型包括氯化锂-匹罗卡品和海仁酸点燃模型[12],氯化锂-匹罗卡品主要是针对海马损害的动物模型,可以很好模拟颞叶癫痫的病理学特征[13],本研究选择该模型进一步探讨NHE1在癫痫模型鼠海马的表达特点。
1 材料与方法
1.1 材料
1.1.1实验动物 清洁级Sprague-Dawley(SD)60 d雄性大鼠99只,体质量(250±30)g,购自本校实验中心。实验均遵守本校动物伦理委员会规定(NO.1900644)。
1.1.2主要药物、试剂与仪器 匹罗卡品和氯化锂(美国Sigma),4%多聚甲醛(北京雷根生物),10%水合氯醛(上海新华化工),地西泮10 mg/2 mL(成都倍特),亲和素-生物素复合液、二氨基苯并胺及山羊抗兔二抗(中杉金桥),NHE1抗体(美国GeneTex),β-actin抗体(美国Santa Cruz),RNAiso Plus和PrimeScript®逆转录试剂盒(日本Takara Bio),化学发光显色试剂(electrochemiluminescence,ECL,美国Pierce),SuperMaza动物行为视频分析系统(上海欣软信息),脑立体定向仪(成都泰盟),PM20自动显微镜(日本奥林巴斯)。
1.2 方法
1.2.1氯化锂-匹罗卡品点燃癫痫大鼠模型建立 54只大鼠按文献[14]进行建模,即在大鼠清醒状态腹腔注射氯化锂127 mg/kg,20 h后腹腔注射硫酸阿托品1 mg/kg,30 min后腹腔注射匹罗卡品50 mg/kg,用药后观察大鼠行为学改变。按Racine分级为标准[15],0级为无抽搐发作,Ⅰ级为面部和嘴抽动,Ⅱ级为点头运动,Ⅲ级为单侧前肢阵挛,Ⅳ级为发作中双侧前肢抽搐、伴或不伴身体立起,Ⅴ级为全面性强直-阵挛发作、即身体背曲强直和跌倒。大鼠持续或者间断癫痫性发作(Racine Ⅳ-Ⅴ级)1 h后,腹腔注射地西泮10 mg/kg予以终止癫痫持续发作、降低死亡率。大鼠癫痫发作在Ⅳ级及以上时视为造模成功,造模过程中死亡9只,最终获得氯化锂-匹罗卡品点燃癫痫大鼠模型45只作为模型组。另取45只大鼠作为对照组,采用腹腔注射生理盐水,实验过程同模型组。
1.2.2蛋白印迹(Western blot) 取模型组和对照组大鼠各36只,依次在自发性痫性发作开始第1、3、7、14、30及60天(每一个时间点2组各6只)予大鼠腹腔注射10%水合氯醛(300 mg/kg)麻醉后斩首处死,快速分离海马组织,并置于液氮中,-80 ℃下储存。取模型组和对照组大鼠冰冻的海马组织,磨碎脑组织,按试剂盒说明书提取大鼠脑组织中的蛋白,用BCA试剂测定所提取的蛋白浓度。从样品中提取蛋白50 μg于8%SDS-PAGE上电泳,电转到PVDF膜上;室温5%BSA孵育PVDF纤维膜1.5 h,兔抗大鼠NHE1(1 ∶4 000)和β-actin(1 ∶1 000)孵育PVDF膜4 ℃过夜;次日室温下孵育NHE1膜,加山羊抗兔二抗(1 ∶5 000)孵育2 h。暗室中加ECL显色试剂对蛋白条带进行显影。用Quantity One 4.6.2软件分析NHE1的相对含量,β-actin作为内参[16]。
1.2.3免疫组织化学 在自发性癫痫性发作开始第14天,取模型组和对照组大鼠各3只,采用免疫组化分析NHE1蛋白表达分布。海马的处理方法如下:模型组大鼠和对照组大鼠麻醉后先采用生理盐水灌流,再用4%多聚甲醛灌注,取海马组织固定于4%多聚甲醛内,蔗糖梯度脱水、液氮冷冻后冰冻切片,厚度10 μm,切片贴于预先处理好的载玻片上,-80 ℃;准备做免疫组织化学分析的标本采用石蜡包埋,切片厚度为5 μm,用于后续分析[17]。石蜡切片于二甲苯中脱蜡,98 ℃微波炉中于10 mmol/L柠檬酸钠缓冲液(pH=6)中加热10 min;37 ℃恒温浴箱内,切片置于0.3%H2O2孵育10 min,0.4%Triton X-100(Sigma)处理15 min,加山羊血清针对非特异性抗原进行封闭,于4 ℃下与兔抗大鼠NHE1抗体(1 ∶100;GeneTex)孵育过夜;PBS洗涤3次,抗兔二级抗体37 ℃孵育30 min,用亲和素-生物素复合液孵育30 min,PBS洗涤;用二氨基苯并胺检测免疫反应性,苏木精复染,在质膜上呈棕色染色的细胞被认为是NHE1表达阳性的细胞[18]。用PBS代替一抗,作为阴性对照。用PM20自动显微镜采集图像[18]。
1.2.4逆转录聚合酶链式反应(reverse transcription polymerase chain reaction,RT-PCR) 在自发性痫性发作开始第14天,取模型组和对照组大鼠各6只采用RT-PCR方法检测大鼠海马NHE1 mRNA的表达。根据试剂盒说明书,使用RNAiso Plus从组织中提取总RNA,用分光光度法260/280 nm处测定RNA的浓度和纯度。采用PrimeScript®逆转录试剂盒从1 μg总RNA合成互补DNA(cDNA)。反转录于37 ℃、15 min,85 ℃、5 s,反应混合物中加焦碳酸二乙酯80 μL,总体积达100 μL,由Takara Bio设计合成RT-PCR引物。大鼠NHE1:顺义链5′-GCGGCGAGCAGATCAATAA-3′,反义链 5′-ACAGTGACGGCATCGTTGAG-3′。选择GAPDH为管家基因:顺义链5′-CCCCCAATGTATCCGTTGTG-3′,反义链5′-TAGCCCAGGATGCCCTTTAGT-3′[18-19]。
1.3 统计学分析

2 结果
2.1 海马组织匀浆中NHE1蛋白表达
进入慢性稳定期发作后第1、3、7、14、30及60天时,相同时间点模型组大鼠海马组织NHE1蛋白表达较对照组增高,差异有统计学意义(P<0.05);模型组大鼠海马组织NHE1蛋白表达从第1天开始增高,第14天时达到高峰,第30天和第60天逐渐下降(P<0.05)。见图1。
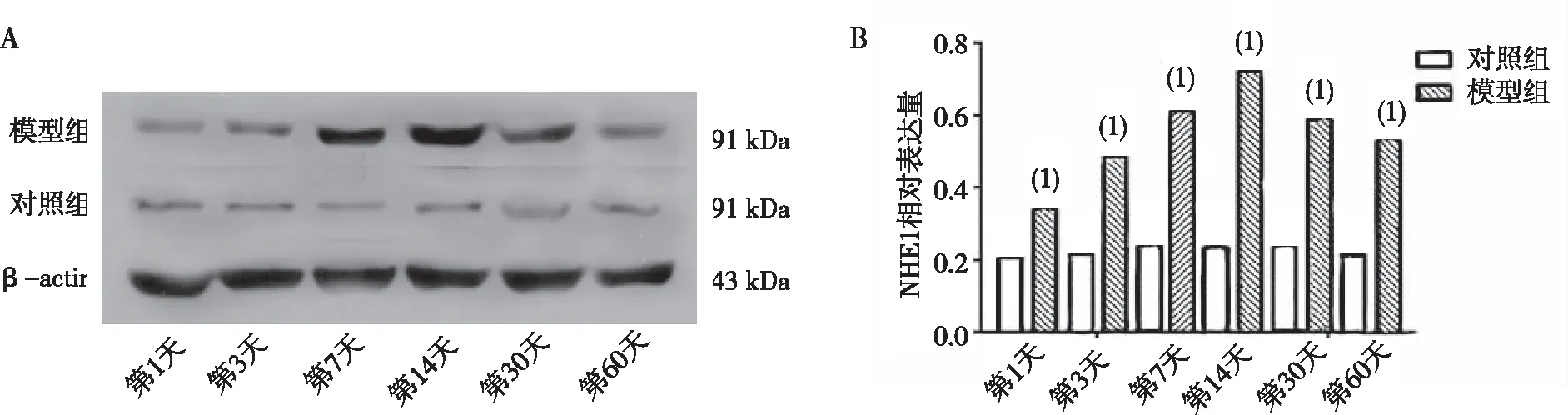
注:A为免疫印迹条带,B为条带半定量分析;(1)与同时点对照组比较,P<0.05。
2.2 海马组织NHE1表达
免疫组织化学检测结果显示,第14天时模型组大鼠海马不同亚区(CA1~CA3区)检测到强NHE1免疫反应,主要分布在神经元的胞体和树突中,但对照组相应区域的NHE1染色较轻。见图2。
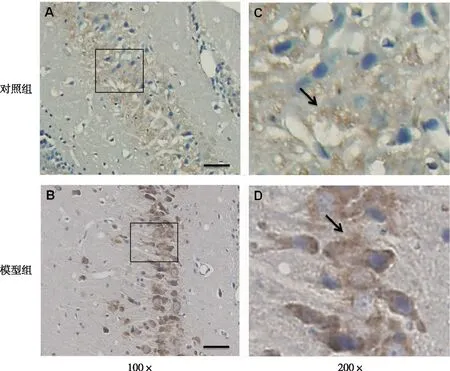
注:C、D分别为A、B内方框放大图像,箭头所示为染色阳性神经元。
2.3 NHE1 mRNA的表达
结果显示,与对照组相比,模型组大鼠海马NHE1 mRNA水平升高,差异有统计学意义(P<0.05)。见图3。
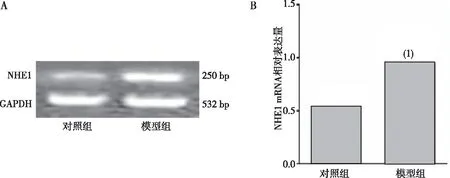
注:A为电泳条带,B为条带半定量分析;(1)与对照组比较,P<0.05。
3 讨论
NHE1主要表达在细胞膜上,在脑组织表达广泛[20]。NHE1作为细胞膜蛋白可以结合多种信号分子,结合后形成转导复合物,可以对胞内外信号做出快速而准确的反应[21-22]。本课题组开展了相关实验研究,结果表明癫痫大鼠造模成功后,NHE1蛋白表达随时间变化呈现逐渐增高趋势,于第14天达到高峰,然后逐渐下降,且高于同时点对照组;RT-PCR以及免疫组织化学等方法进一步明确NHE1表达部位及mRNA表达特点,第14天模型组大海马不同亚区(CA1~CA3区)检测到强NHE1免疫反应,主要分布在神经元的胞体和树突中;模型组大鼠海马NHE1 mRNA水平高于与对照组(P<0.05)。
Kang等[11]研究显示易发癫痫的沙鼠在癫痫发作后NHE1立即升高,并于发作后6 h恢复正常。然而,该研究没有进一步探讨沙鼠在反复发作后NHE1蛋白表达的趋势。本课题组发现随着大鼠慢性癫痫模型构建成功后,模型组大鼠NHE1表达呈逐渐增高趋势,且该趋势提示在第60天时NHE1蛋白表达仍然没有恢复到正常水平。本课题组分析,本研究采取的是氯化锂-匹罗卡品点燃诱导的慢性癫痫模型,与易发癫痫沙鼠动物模型完全不同;其次观察时间段也差距较大,故认为本课题组研究结果是之前研究结果很好的补充,二者并不矛盾。通过动态观察NHE1的动态变化,课题组发现NHE1随着慢性癫痫模型的进展,NHE1蛋白仍逐渐升高,且没有恢复正常,故提示在痫性反复发作的情况下,NHE1依然处于活跃状态。
课题组前期研究中发现与神经元凋亡、坏死等病理变化密切相关的μ-calpain和m-calpain蛋白表达增高[18,23]。m-calpain和μ-calpain属于半胱氨酸蛋白水解酶超家族成员,神经元内Ca2+离子浓度变动较大时可激活二者,促发水解酶对细胞骨架和相关蛋白质产生降解作用,从而破坏结构蛋白以及酶的功能,导致神经元凋亡或坏死[24-25]。结合本研究的实验结果,可以认为在调控酸碱平衡的过程中,NHE1可能导致Ca2+过度进入神经元促进了钙信号通路的激活,进一步激活μ-calpain和m-calpain蛋白,从而参与了神经元细胞凋亡或坏死的发生。本实验仅就NHE1蛋白表达特点进行了探讨,但机制研究尚不足,今后研究可通过细胞层面进一步干预NHE1蛋白表达,观察神经元凋亡及坏死的改变。
基于前期研究,课题组推测NHE1过度激活可能参与癫痫的进一步进展,其机制可能如下:既往研究显示NHE1的主要功能是维持胞内酸碱平衡,防止细胞内过度的酸化[9]。NHE1激活与神经元内pH值密切相关,pH值明显降低时可激活NHE1,NHE1被激活后排除H+、摄入Na+,从而提高神经元内pH值;当NHE1过度转运Na+到细胞内,造成Na+超载,胞内Na+超载可激活Na+/K+ATP酶,将细胞内排出3个Na+和同时2个K+进入细胞内,细胞内Na+超载也会刺激Na+/Ca2+交换体(NCX)活性增强,从而增加细胞内Ca2+浓度,最终调控细胞功能[22]。故有理由推测,在慢性癫痫动物模型反复痫性发作后,NHE1出现功能活跃状态,痫性发作后进入纠正酸中毒的过程中,从而导致神经元内钙超载现象。
综上所述,本研究结果表明NHE1过度激活参与了大鼠慢性癫痫的病理生理过程,NHE1表达增高可能是大鼠癫痫发生和发展的促发因素,在癫痫反复发作过程中,为了维持酸碱平衡,过度激活导致钙离子激活,促进凋亡发生可能性较大。未来针对NHE1的干预可能使得对慢性癫痫模型鼠海马神经元的凋亡及坏死的控制成为可能。

