α-硫辛酸通过mTOR通路抑制缺血再灌注诱导的PC12细胞自噬性凋亡
谢鹏 任真奎,3 吕菊 胡玉梅 官志忠 张春林 禹文峰
(贵州医科大学 1分子生物学重点实验室,贵州 贵阳 550004;2地方病与少数民族疾病教育部重点实验室;3黔西南州人民医院检验科;4贵州医科大学基础医学院)
心脑血管疾病严重影响人类生活健康、生活质量〔1〕。其中脑卒中已成为全球“第二大死亡杀手”。目前,临床的主要治疗手段是溶栓治疗〔2,3〕。机械溶栓(手术)或者化学药物溶栓都是为了实现局部缺血血管血流再通〔4〕。然而,伴随着溶栓治疗会出现再灌注损伤和继发性出血且神经细胞功能缺损加重等现象〔5,6〕。因此,寻找有效的脑卒中治疗药物或者干预治疗靶点迫在眉睫。研究显示抗氧化物质在脑卒中的病理过程具有积极保护作用〔7〕。α-硫辛酸(LA)是丙酮酸脱氢酶的辅助因子,参与三羧酸循环过程中的重要物质。α-LA被认为是生物体内的强抗氧化剂,对神经退行性疾病具有保护作用〔8~10〕。在大鼠脑中动脉栓塞(MCAO)模型和脂多糖(LPS)诱导的小胶质炎症细胞模型中,α-LA能够显著恢复MCAO大鼠的神经功能和减少白细胞介素(IL)-1β、IL-6、肿瘤坏死因子(TNF)-α 和IL-10 的表达,并能抑制炎症信号通路NF-κB的激活等〔11,12〕。大量的研究结果都证明α-LA在缺血再灌注损伤的病理过程中发挥着重要作用,但是其确切的分子机制尚不清楚,有待阐明。因此本研究拟在神经细胞PC12缺血再灌注模型上探讨α-LA发挥保护作用的潜在分子机制。
1 材料与方法
1.1细胞系与细胞培养 PC12细胞系购自中国科学院典型培养物保藏委员会细胞库,培养基配方为10%FBS+1%双抗+89%的高糖DMEM,置于37℃、5%CO2及饱和湿度的培养箱中培养。长至80%~90%汇合度进行传代培养。
1.2实验试剂 DMEM培养基(8119058,赛默飞世尔科技有限公司);胎牛血清(2045512CP,美国Gibco 公司);DMEM无糖培养基(1951286,美国Gibco 公司);磷酸盐缓冲溶液(PBS,0031019,以色列Biological Industries);蛋白酶抑制剂(#5872,CST);R-(+)-α-LA(07039,Sigma);CCK8(A311-01,Vazyme Biotech);双染细胞凋亡检测试剂盒(BB-4101,贝博生物);Hoechst 33258染色液(C1017,上海碧云天生物技术有限公司);Phospho-mTOR(Ser2448)(49F9)兔mAb(#2976,CST);mTOR(7C10)兔mAb(#2983,CST);SQSTM1/p62(D6M5X)兔mAb(#23214,CST);LC3A/B(D3U4C)XP®兔mAb(#12741,CST);重组Anti-Bax抗体(ab32503,Abcam);酶切Caspase-3(Asp175)抗体(#9661,CST)。
1.3α-LA溶解 精准电子天平秤取硫辛酸0.020 6 g,于0.5 ml DMSO中溶解后加0.5 ml磷酸盐缓冲液(PBS)稀释成母液浓度100 mmol/L储液,4℃避光保存备用。α-LA使用浓度中DMSO不超过0.1%。
1.4缺血再灌注模型建立与实验分组 PC12细胞长至80%~90%之后,吸弃培养基,用3~5 ml预冷PBS洗涤细胞1~2次,0.25%胰酶消化细胞,含FBS完全培养基终止消化,1 000 r/min离心5 min,弃上清,10%FBS完全培养基制成2×105个/ml细胞悬液并取1 ml细胞悬液加入每孔内,每孔再补加1 ml完全培养基,置37℃培养箱培养。待细胞密度至70%~80%时,进行缺氧/复氧处理。正常组细胞换完全培养基置正常培养箱培养,缺氧/复氧组用预冷PBS洗涤细胞2遍后,换无糖无血清DMEM培养基置于三气培养箱(94%N2+5%CO2+1%O2)中培养4 h,模拟缺血缺氧处理后,PBS洗细胞2次更换无血清高糖培养基置于正常培养箱中培养18 h以模拟再灌注损伤;α-LA组在复氧前给予α-LA处理共培养18 h;Baf A1组在缺氧/复氧处理12 h后给予20 nmol/L的Baf A1继续培养6 h。
1.5CCK8检测法 细胞长至合适密度后,将细胞制成5×104/ml的细胞悬液,以每孔100 μl接种于96孔板,细胞贴壁过夜生长到50%~60%密度时,吸弃旧培养基,每孔分别加入100 μl无糖DMEM培养基,置于三气培养箱(1%O2+5%CO2)中培养4 h,模拟缺血缺氧处理,正常组含完全培养基于正常氧培养箱中培养。缺氧处理后分别加入含不同浓度α-LA的高糖无血清培养基置于正常培养箱培养18 h行复氧处理。复氧18 h后,每孔加入10 μl CCK8工作液反应1 h左右,以空白孔调零,每组6个复孔,酶标测定仪测定450 nm波长下的吸光度值(OD)。细胞存活率=(OD给药-OD空白)/(OD对照-OD空白)×100%。
1.6流式细胞术 PC12接种至12孔板,待细胞长至合适密度后,分组行实验干预处理。0.25%不含乙二胺四乙酸(EDTA)胰酶消化细胞,离心收集细胞,PBS洗细胞1次,根据贝博凋亡检测试剂盒说明书要求操作后续步骤。缓冲液重悬细胞制成细胞悬液,加凋亡染色液反应5~10 min,上机检测细胞凋亡变化。
1.7Western印迹分析 弃培养基,预冷PBS洗细胞一次,每孔加500 μl PBS,用细胞刮轻轻刮下细胞,离心收集,根据细胞多少加100~200 μl含蛋白酶抑制剂的RIPA裂解液于振荡器上震摇均匀,细胞于冰上充分裂解30 mins后离心收集蛋白上清,BCA蛋白定量后加入4∶1(蛋白上清∶5倍缓冲液)比例的5倍缓冲液于恒温金属浴100℃变性蛋白10 min,120 V恒压十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),250 mA湿转转膜1.5 h,1×TBST配置的5%脱脂奶粉室温封闭1 h,4℃摇床孵育抗体过夜,室温孵育二抗2 h,ECL发光液成像检测信号。
1.8统计学分析 采用GraphPad Prism8.0.1软件进行t检验、单因素方差分析。
2 结 果
2.1α-LA抑制缺血再灌注诱导的PC12细胞存活率降低 与正常组比较,缺氧/复氧组细胞活性显著降低,存活率降低至51.06%±0.97%;当给予α-LA处理后,缺氧/复氧处理的细胞存活率显著升高,α-LA 0.010 mmol/L、0.025 mmol/L、0.050 mmol/L、0.250 mmol/L、0.500 mmol/L、1.000 mmol/L、2.000 mmol/L、2.500 mmol/L、5.000 mmol/L和10.000 mmol/L时细胞的存活率分别为52.98%±0.44%、63.91%±1.04%、66.56%±0.57%、73.68%±0.13%、85.83%±0.28%、81.10%±0.22%、78.85%±1.39%、77.08%±0.95%、69.60%±1.53%和35.66%±0.77%;α-LA在0.500 mmol/L时细胞活性升高至85.83%±0.28%,表明α-LA在0.500 mmol/L对缺氧/复氧损伤的抑制作用最强;然而,当α-LA的工作浓度在10.000 mmol/L时,PC12细胞存活率显著受到抑制,表明较高浓度的α-LA具有毒副作用;以上结果差异均具有统计学意义(P<0.05)。
2.2α-LA抑制缺血再灌注诱导的PC12细胞凋亡 正常组、缺氧/复氧组和缺氧/复氧+α-LA组细胞的凋亡率分别为2.58%±0.16%、13.23%±1.09%和8.58%±0.56%,差异均有统计学意义(P<0.05)。以上结果表明:缺氧/复氧诱导了PC12细胞的凋亡水平升高,当给予0.500 mmol/L的α-LA与缺氧复氧的PC12细胞共培养处理后能显著降低缺氧/复氧诱导的细胞凋亡水平升高,显示α-LA对缺血再灌注损伤具有抑制作用。见图1。
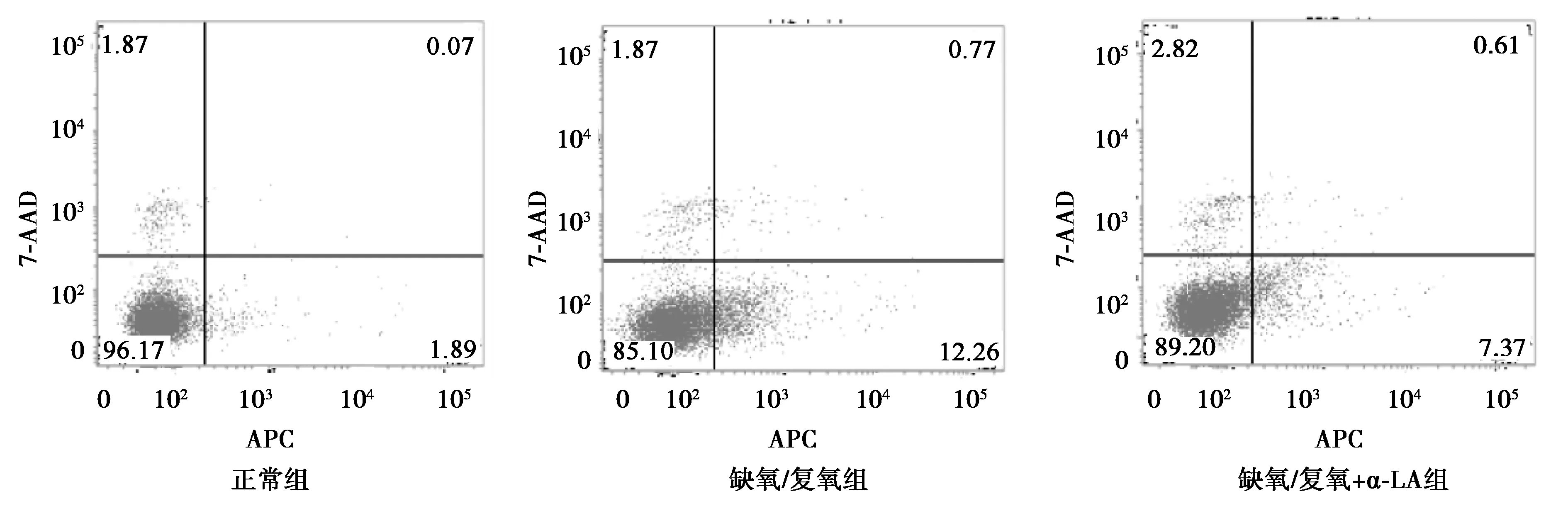
图1 各组PC12细胞凋亡
2.3Western印迹检测自噬和凋亡相关蛋白的变化 与正常组比较,缺氧/复氧组自噬标志分子LC3-Ⅱ/Ⅰ的比值增加,P62的表达减少;与此同时,凋亡相关分子酶切caspase-3和促凋亡蛋白Bax的表达水平增加。缺氧/复氧后给予α-LA处理能够显著降低LC3-Ⅱ/Ⅰ的比值,增加P62的表达,同时降低了凋亡分子酶切caspase-3和Bax的表达,差异均有统计学意义(P<0.05),见表1和图2。

表1 Western印迹检测PC12细胞凋亡及自噬标志分子的表达变化

1~3:正常组、缺氧/复氧组、缺氧/复氧+α-LA组
2.4Baf A1抑制缺血再灌注诱导的PC12细胞凋亡 正常组、缺氧/复氧组和缺氧/复氧+Baf A1组细胞的凋亡率分别为3.77%±0.47%、16.74%±0.86%、6.80%±0.04%,较缺氧/复氧组比较,给予缺氧/复氧后的PC12细胞自噬抑制剂巴弗洛霉素A1(20 nmol/L)处理后,Baf A1能够显著降低缺氧/复氧诱导的PC12细胞凋亡水平,差异有统计学意义(P<0.05)。见图3。
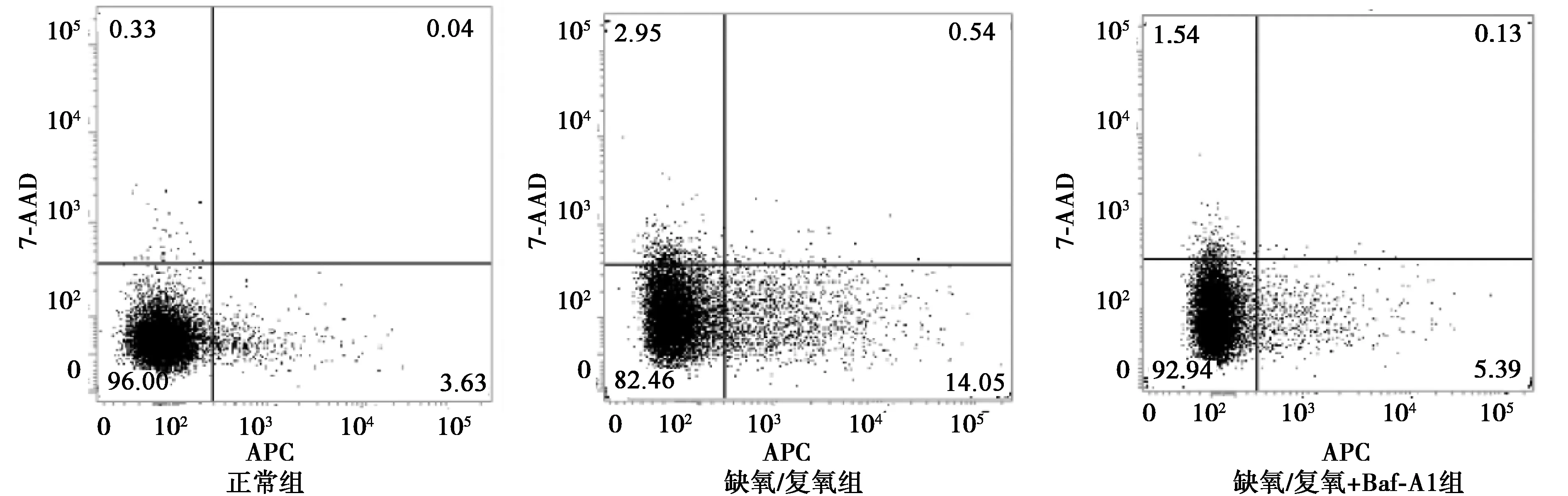
图3 流式检测Baf A1处理后各组PC12细胞凋亡变化
2.5α-LA激活mTOR通路的磷酸化水平 如图4的Western印迹结果显示:与正常组比较,缺氧/复氧组p-mTOR的水平显著降低,当给予α-LA处理后能够显著升高p-mTOR水平,差异有统计学意义(P<0.05),提示α-LA抑制缺氧/复氧诱导的异常自噬水平可能是通过激活p-mTOR水平进而达到抑制自噬的作用。见图4和表1。

1~3:正常组、缺氧/复氧组、缺氧/复氧+α-LA组
3 讨 论
缺血性脑卒中患者在溶栓治疗后经常伴随出现神经细胞缺血再灌注损伤并加剧患者病灶及病情〔13,14〕。溶栓治疗后减少再灌注损伤诱导的神经细胞凋亡或坏死具有重要意义。
自噬是真核细胞内一个高度保守的生理代谢过程〔15〕。正常生理状态下,自噬维持在低水平以维持细胞的内环境稳态,在外源性应激、饥饿等刺激条件下自噬被诱导至较高的水平〔16,17〕。细胞内自噬水平的异常调控会导致一系列疾病的发生,比如癌症、肌肉疾病、代谢疾病、感染和神经退行性疾病等〔18~20〕。研究证实自噬是一个具有双重作用的生理过程,对维持细胞内环境稳态具有积极作用,异常细胞自噬调控过程又会导致机体细胞出现“自噬性的死亡”〔21〕。但是,其在缺血再灌注损伤过程中的病理分子机制尚不清楚,有待深入研究。
本研究结果证明自噬水平的增加也伴着细胞凋亡水平的升高。α-LA具有抗氧化性,清除自由基的能力,对神经退行性疾病具有保护作用。有研究报道α-LA能有效改善急性缺血性脑卒中患者的病症,但其潜在分子机制有待阐释〔9〕。本研究结果发现α-LA能有效降低缺血再灌注诱导的PC12细胞自噬和凋亡水平。体现在自噬标志分子LC3-Ⅱ/Ⅰ的比率降低和凋亡蛋白Bax、酶切casepase-3表达减少。
综上,我们推测α-LA通过抑制缺血再灌注诱导的过度自噬进而减少过度自噬诱导的细胞凋亡。其发挥保护功能的可能分子机制是激活mTOR的磷酸化降低自噬水平进而抑制过度自噬诱导的细胞凋亡。

