MicroRNA-184调控Ras/MAPK/ERK途径与老年肾细胞癌肿瘤细胞增殖、迁移及凋亡的关系
鲁广建 狄文玉 张群妹 焦路阳
(新乡医学院第一附属医院 1检验科,河南 卫辉 453100;2病理科;3输血科)
肾细胞癌(RCC)是成人泌尿系统常见的肿瘤之一,约占肾脏恶性肿瘤的90%,发病率为2%~3%〔1〕。全球范围内,RCC约占成年男性恶性肿瘤患者的5%,为男性第7位最常见的癌症;约占女性恶性肿瘤患者的3%,女性最常见癌症第10位〔2〕。肾细胞癌的主要治疗方式包括手术、放疗、化疗、靶向治疗和生物疗法等,其中肾癌根治术是RCC首选的治疗方式〔3,4〕,然而,由于老年恶性RCC患者常常合并慢性基础疾病,导致其生理功能及耐受性明显下降,对于此类患者的治疗需考虑其特殊性〔5〕。因此,寻找RCC发生发展的相关机制具有重要意义。MicroRNA是近年来发现的非编码小分子RNA,长度为19~24个核苷酸,可与靶miRNA的3′端非翻译区互补结合,影响mRNA的翻译过程,抑制蛋白质表达,改变细胞的行为〔6〕。MicroRNA-184(miR-184)与多种肿瘤的发生发展密切相关,Fang等〔7〕的研究表明,长链非编码RNA(LncRNA)尿路上皮癌相关基因(UCA)1通过抑制miR-184表达促进口腔鳞状细胞癌的增殖和顺铂耐药;研究发现,miR-184可通过抑制斯钙素(Stanniocalcin)-2延缓胶质母细胞瘤细胞的增殖,侵袭和迁移〔8〕。Ras/丝裂原活化蛋白激酶(MAPK)/细胞外信号调节激酶(ERK)信号通路在RCC的生长过程当中起重要作用。本研究以RCC ACHN细胞为对象,通过转染miR-184,探讨其对RCC ACHN细胞增殖、迁移和凋亡的影响及相关的分子机制。
1 材料与方法
1.1材料 人RCC细胞株ACHN购自美国ATCC细胞库。miR-184 mimics、miR-NC购自广州睿博生物科技有限公司;RPMI1640、胎牛血清、双抗购自Gibco;AnnexinV-FITC细胞凋亡试剂盒购自上海贝博生物;MTT试剂、BCA试剂盒购自碧云天生物有限公司;ERK、磷酸化(p)-ERK、GAPDH抗体购自Cell Signaling Technology;逆转录试剂盒购自TaKaRa。
1.2细胞培养与转染 ACHN细胞培养于含10%胎牛血清和1%双抗的RPMI1640培养液并置于37℃、5%CO2培养箱中,每2~3 d进行细胞传代,并取对数期生长细胞实验。细胞以5×104个/孔接种于6孔板中,待细胞完全贴壁后,转染miR-184 mimics、miR-NC,48 h后检测ACHN细胞的转染情况。
1.3MTT实验检测细胞增殖 取对数期生长的ACHN细胞消化,离心后以2×103个/孔的密度接种于96孔板中,24 h后转染miR-184 mimics(miR-184 mimics组)和miR-NC(miR-NC组),对照组未做任何处理,每组设5个复孔,置于37℃、5%CO2培养箱中。24、48 h后,每孔加入10 μl MTT溶液,继续培养4 h,去除96孔板内培养液,加入150 μl二甲基亚砜(DMSO)震荡混匀,酶标仪测490 nm处吸光度(OD值)并计算细胞存活率。细胞存活率(%)=(转染组OD-对照组OD)/对照组OD×100%。
1.4划痕实验检测细胞迁移 在6孔板背后划5条平行直线后,以2×105个/孔的密度接种对数期生长的ACHN细胞,待细胞完全贴壁后分别转染miR-184 mimics和miR-NC,对照组未做任何处理。24 h后,观察ACHN细胞的生长状况,用黄枪头在6孔板内垂直于背后横线进行划痕,磷酸盐缓冲液(PBS)清洗后加入无血清的RPMI1640培养基置于37℃、5%CO2培养箱中。分别在0、24、48 h使用倒置显微镜拍照并重复3次,划痕宽度由Image J软件进行测量,计算细胞迁移率。细胞迁移率=(0 h宽度-24 h或48 h宽度)/0 h宽度×100%。
1.5流式细胞术检测细胞凋亡 将对数期生长的ACHN细胞以2×105个/孔的密度接种于6孔板中,细胞贴壁后转染miR-184 mimics和miR-NC,对照组未做任何处理。48 h后将ACHN细胞收集,PBS洗涤后,离心(1 000 r/min,5 min,4℃)。细胞重新混悬后置于流式管中,分别加入5 μl膜联蛋白(Annexin)V和10 μl碘化丙啶(PI),15 min内流式细胞仪检测。
1.6q-RT-PCR法 收集miR-184 mimics组、miR-NC组和对照组细胞,根据总RNA提取试剂盒说明书提取各组ACHN细胞总RNA,测定浓度后,反转录得cDNA,反应条件:42℃ 10 min,30℃ 20 min,99℃ 5 min,4℃ 5 min,随后进行扩增,反应条件:94℃ 5 min(94℃ 30 s,59℃ 30 s,72℃ 30 s)重复35个循环,72℃ 10 min,可得Ct值,根据公式2-△△Ct计算可得相对表达量。1%琼脂糖凝胶电泳法检测cDNA中的miR-184表达水平。
1.7Western印迹法 收集miR-184 mimics组、miR-NC组和对照组细胞,提取总蛋白,蛋白浓度由BCA法测定,十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)后转膜,洗膜后1%脱脂牛奶封闭1 h,洗膜后加入GAPDH、ERK、p-ERK抗体,4℃摇床孵育过夜,二抗室温孵育1 h后电化学发光(ECL)显像,所得图像由Image J软件分析各条带灰度值。
1.8统计学处理 采用SPSS22.0软件进行单因素方差、t检验。
2 结 果
2.1miR-184在ACHN细胞中的转染情况 与对照组(1.00±0.29)相比,miR-184 mimics组miR-184表达水平(5.97±0.45)显著升高(t=21.990,P<0.05),miR-NC组miR-184表达水平(0.98±0.05)无显著性差异(t=0.190,P>0.05)。见图1。表明miR-184在ACHN细胞中转染成功。
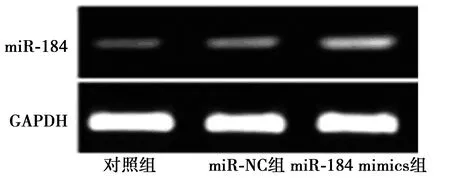
图1 凝胶电泳检测miR-184表达
2.2过表达miR-184对ACHN细胞增殖能力的影响 转染24 h后,与对照组〔(91.1±9.2)%〕和miR-NC组〔(89.2±8.0)%〕相比,miR-184 mimics组细胞存活率〔(65.5±3.1)%〕显著下降,差异有统计学意义(t=6.864,P<0.1);转染48 h后,与对照组〔(82.5±8.2)%〕和miR-NC组〔(80.4±7.9)%〕相比,miR-184 mimics组细胞存活率〔(51.9±2.5)%〕显著下降,差异有统计学意义(t=9.800,P<0.01)。过表达miR-184后,可显著抑制ACHN细胞的增殖能力。
2.3过表达miR-184对ACHN细胞凋亡的影响 与对照组〔(6.20±0.30)%〕和miR-NC组〔(6.13±0.23)%〕相比,miR-184 mimics组细胞凋亡率〔(14.01±0.98)%〕显著升高(t=17.504,P<0.05),见图2。结果显示,过表达miR-184后,促进了ACHN细胞的凋亡。
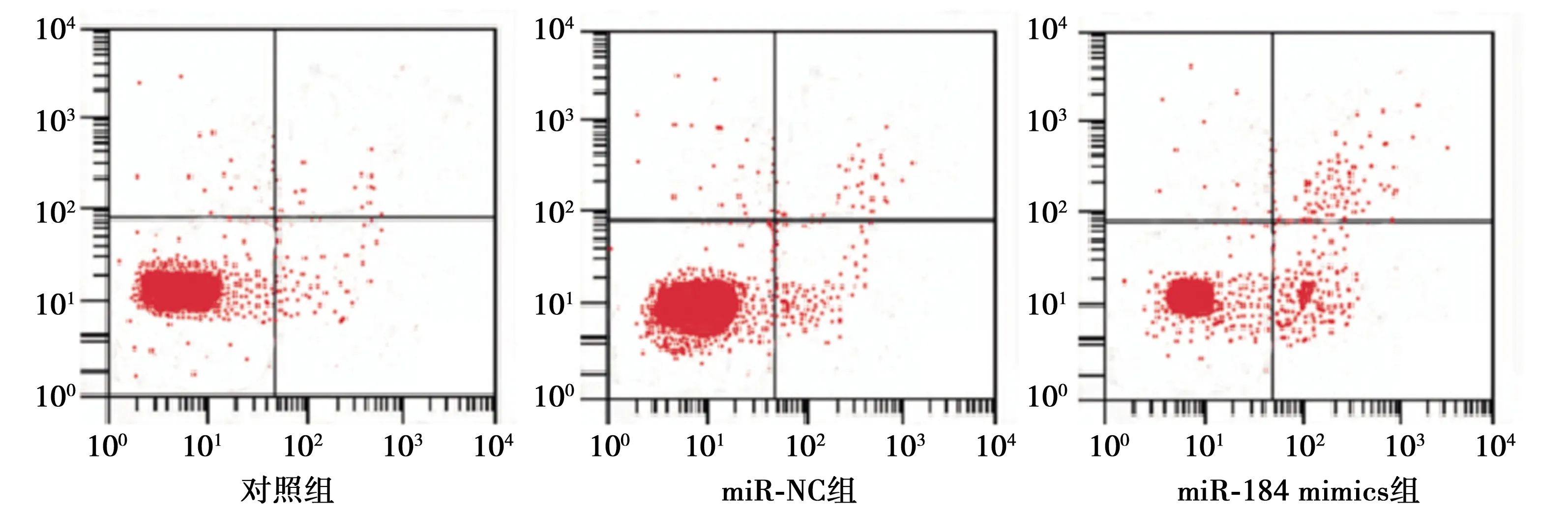
图2 过表达miR-184对各组细胞凋亡的影响
2.4过表达miR-184对ACHN细胞迁移能力的影响 见图3。

图3 转染后不同时间过表达miR-184对细胞迁移的影响
转染24 h后,与对照组〔(0.98±0.08)%〕和miR-NC组〔(0.97±0.06)%〕相比,miR-184 mimics组细胞划痕宽度变化〔(1.10±0.07)%〕明显增加(t1=2.524,t2=3.153,均P<0.05);48 h后,与对照组〔(0.76±0.05)%〕和miR-NC组〔(0.78±0.03)%〕相比,miR-184 mimics组细胞划痕宽度变化〔(0.91±0.04)%〕显著增加(t1=5.238,t2=5.814,均P<0.05)。过表达miR-184后,抑制了ACHN细胞的迁移能力。
2.5过表达miR-184对Ras/MAPK/ERK信号通路的影响 与对照组和miR-NC组相比,miR-184 mimics组p-ERK蛋白表达水平显著下降(P<0.05);与对照组和miR-NC组相比,miR-184 mimics组p-ERK/ERK相对表达量显著下降,见表1、图4,表明ERK激活受到抑制,即过表达miR-184可抑制Ras/MAPK/ERK信号通路。

表1 各组p-ERK蛋白、p-ERK/ERK比较

图4 Western印迹检测各组蛋白表达水平
3 讨 论
全球每年诊断为肾恶性肿瘤的约有20万人,且发病率逐年升高〔9〕。RCC位于我国泌尿系统肿瘤发病率的第二位,随着年龄的增长,发病率逐渐增加〔10〕。Suen等〔11〕对3 535例老人的尸检表明,RCC发病率最高的年龄段是70~75岁,男性高于女性。李东阳等〔5〕对中青年RCC和老年RCC的临床资料进行对比后发现,老年RCC患者病理组织学类型中进展型比例、术中出血量及术后住院时间均高于中青年患者高,严重影响了老年RCC患者的生存质量和预后,因此,深入了解老年肾细胞癌的发生发展具有重要意义。治疗RCC首选根治性手术治疗,但是术后仍有三分之一患者发生进展,且由于对化疗和放疗敏感性差,RCC患者的5年生存率低于10%,中位生存率仅为5年〔3,4〕。因此,从基因分子水平等方面研究RCC极其重要。
MicroRNAs是一类广泛存在于动物和植物细胞内的非编码基因,通过调控基因表达网络调节细胞的增殖、迁移、分化和凋亡等过程〔12〕。近年来,研究发现miRNA在胃癌、胶质瘤等多种肿瘤过程中起到重要作用,而不同的miRNAs各自发挥着抑癌或促癌作用〔13,14〕。秦丹丹等〔15〕的研究发现,在RCC组织中存在miR-30a低表达,与RCC患者的预后相关,且miR-30a可通过MTDH抑制RCC细胞的增殖;张欢等〔16〕采用miRNA芯片检测RCC的肿瘤组织和血清发现存在miR-106a表达升高;杨益等〔17〕发现miR-21 在RCC患者手术前高表达,术后表达水平降低,但其作用机制尚不清楚。本研究以对RCC ACHN细胞为研究对象,成功转染了miR-184,实验结果显示miR-184抑制了细胞的增殖能力和迁移能力,同时促进了细胞凋亡。Wang等〔18〕研究显示,miR-184通过下调C-MYC和BCL-2抑制人结肠癌SW480和HCT116细胞的增殖并促进其凋亡,这与本研究结果一致。
MAPK是与细胞生长、有丝分裂、发育、分化和凋亡等各种生理过程相关的信号转导通路,同时也参与调控肿瘤细胞的增殖、分化、迁移、侵袭及凋亡等过程〔19〕。Ras/MAPK/ERK信号通路,即Ras/Raf/MEK/ERK信号通路可根据MAPK三级激酶模式活化,Ras激活后为磷酸化的Raf,与RAF结合的同时磷酸化Raf,p-Raf激活MEK后,磷酸化的MEK激活ERK,磷酸化的ERK进入细胞核后启动转录。在许多肿瘤中常见MAPK信号通路的异常激活。夏迎晨等〔20〕的研究显示miR-145通过MAPK信号通路调控肺癌A549细胞的转移和侵袭;在RCC中上调ERCC6L可增强体外细胞活力,促进体内肿瘤生长,这一作用可能于调节MAPK信号通路有关〔21〕。本研究结果显示过表达miR-184抑制p-ERK/ERK相对表达量,Ras/MAPK/ERK信号通路受到了抑制。因此推测miR-184抑制ACHN细胞增殖、迁移及促进凋亡的作用可能与抑制Ras/MAPK/ERK信号通路有关。
综上所述,miR-184可能通过调控Ras/MAPK/ERK途径抑制老年肾癌ACHN细胞增殖能力和迁移能力,促进ACHN细胞的凋亡作用,为老年RCC的分子治疗提供一个新思路,也为MicroRNA的临床应用提供理论依据。miRNA-184对RCC的具体作用机制及生物学功能仍需进一步研究。

