谷氨酸诱导大鼠结肠 Cajal 间质细胞构建自噬模型
颜帅 乐音子 王晓鹏
(南京中医药大学附属苏州市中医医院,江苏 苏州 215009)
胃肠道 Cajal间质细胞(ICC)是胃肠道慢波活动的起搏细胞,在调控胃肠道的运动中扮演重要角色,研究表明ICC数量、分布、形态和结构的异常变化与慢传输型便秘(STC)发病有密切关系〔1,2〕。而ICC细胞过度自噬是慢传输型便秘大鼠模型中ICC数量减少的关键,诱发ICC功能障碍,导致STC发生〔3~6〕。既往防治便秘的药物对ICC的影响多数还停留在整体动物实验水平,尚缺乏构建结肠 ICC自噬的模型。本研究完善结肠ICC的消化分离培养技术,探讨结肠ICC自噬模型的建立,为发展 ICC的新型药物或者诊疗手段提供理论依据。
1 材料与方法
1.1实验动物 SPF级SD大鼠30只,雌雄不限,体重200 g左右,由湖南斯莱克景达实验动物有限公司提供,许可证号为SCXK(湘)2016-0002。
1.2实验仪器 超净工作台(北京亚泰YT-CJ-2NB);低速离心机(知信仪器SL02);直热式二氧化碳培养箱(上海三藤仪器DH-160I);解剖显微镜(上海光学仪器一厂XTZ-D/E);倒置显微镜(北京中显恒业DSZ2000X);无菌平皿(美国Corning);200目细胞滤网(BD);眼科剪刀、镊子(上海金粒医疗器械有限公司);摇床、旋涡混合器(江苏其林贝尔);精密PH计(雷磁E-201-C);盖玻片、载玻片(海门远泰);台式冷冻离心机(中国湖南湘仪H1650R);电子天平(美国双杰JJ224BC);电泳仪、电泳槽、转膜仪(北京六一);磁力搅拌器(雷磁JB-13);生物样品均质仪(杭州奥盛BioPrep-24)。
1.3实验试剂 M199培养基(Gbico);胰酶消化液(美国Ameresco);RIPA裂解液、青-链霉素(上海碧云天);磷酸盐缓冲液(PBS,Hyclone);胎牛血清(Gbico);Ⅱ型胶原酶(COLLAGENASE);Ⅰ型鼠尾胶原蛋白(北京索来宝);L-谷氨酸(Sigma-Aldrich);脱氧核糖核酸酶(DNase)Ⅰ(康为世纪);CCK-8 试剂盒(日本同仁化工);兔抗大鼠 c-Kit原癌基因蛋白多克隆抗体(abcam);Tween-20、4%多聚甲醛(上海国药生物);微管相关蛋白轻链(LC)3B抗体(美国proteintech);β-actin(美国proteintech);羊抗鼠IgG(美国proteintech);十二烷基硫酸钠(SDS)(中国大连美伦MB2479);超敏化学发光液(美国advansta);显影液、定影液(上海佳信);甘氨酸、甲叉双丙烯酰胺(美国Sigma)。
1.4原代培养大鼠结肠ICC 细胞分离用的眼科剪刀、镊子等器械经121℃高温高压灭菌30 min取出,160℃烘干,泡新洁尔灭液5 min再泡75%酒精5 min,放于超净工作台紫外杀菌30 min。参照文献〔7,8〕进行优化,取SD大鼠,雌雄不限,禁食12 h,脱颈处死,全身快速浸泡于75%酒精3 min,快速取出置于超净台上;纵行切口剖开腹腔,取自盲肠后2 cm起的近端结肠直至距肛门2 cm的直肠,放入直径10 cm的细胞培养皿,用含2%双抗的PBS将肠内容物冲洗干净;解剖显微镜下眼科镊仔细剥去肠系膜和血管,剪碎至1~2 mm3小块,放入15 ml离心管内,加入Ⅱ型胶原酶消化液7 ml(pH7.0,含1.3 mg/ml Ⅱ型胶原酶),37℃,充分消化3 h,间隔30 min取出吹打1次;加入等体积的完全培养基终止消化,200目筛过滤后经1 200 r/min离心3 min,弃去上清液;加入完全培养基使细胞重悬;再将细胞浓度调整至1×106/ml,接种至预先包被鼠尾胶原蛋白Ⅰ型(2.5 μg/ml)的60 mm培养皿,放入37℃、5% CO2培养箱内培养。细胞培养72 h后换液,洗去未贴壁细胞,再加入新的培养基继续培养,以后每天换液1次,期间连续用倒置显微镜下观察细胞生长情况和形态变化。
1.5结肠ICC的免疫荧光鉴定 取对数生长期细胞,经冰冻甲醇固定10 min,5%脱脂奶粉封闭10 min;加入兔抗大鼠c-Kit蛋白多克隆抗体(1∶100),4℃冰箱孵育过夜,PBST 液冲洗3遍,加入Ⅱ 抗(Dylight488结合山羊抗兔IgG,1∶200),37℃培养箱避光孵育1 h,PBST清洗3遍,最后加抗淬灭封片液封片,置荧光显微镜下观察并拍照。
1.6CCK-8法检测不同浓度和时间谷氨酸对原代结肠ICC活力的影响 取对数生长期的大鼠结肠ICC细胞,重悬计数后接种于3个96孔板,20孔/板,共60个孔,每孔100 μl细胞悬液,每孔约5×103个细胞,24 h后换液待其贴壁后加药,分别给予谷氨酸0.0、2.5、5.0、10.0 mmol/L处理大鼠结肠ICC细胞,记为空白组、谷氨酸A组、谷氨酸B组、谷氨酸C组,分别培养3、6、24 h。各组加药培养到预定时间后分别加入10 μl CCK-8,37℃,5%CO2继续孵育4 h 后,Bio-Tek酶标仪450 nm处为吸光度(OD)值检测波长。
1.7Western印迹检测不同时间点不同浓度谷氨酸对LC3蛋白表达的影响 取对数生长期的大鼠结肠ICC细胞,经胰酶消化离心后计数,并接种 2×105个细胞至 25 cm2的细胞培养瓶中,贴壁24 h后,更换新的培养基;并给不同浓度谷氨酸分别干预 3 h、6 h 和 24 h 后,分组同1.6部分。蛋白提取:用冰预冷PBS洗涤细胞1次,加入200 μl RIPA裂解液,用细胞刮刀刮下细胞,收集悬液,超声破碎1.5 min;冰上裂解10 min;4℃,12 000 r/min离心15 min。按照BCA蛋白定量试剂盒使用说明操作,测定蛋白浓度。取120 μl蛋白上清,加入30 μl 5×上样缓冲液混匀,沸水煮5 min,放入冰盒中速冷备用。根据蛋白定量的结果,第一孔点入marker 2 μl,依次上样10 μl已变性蛋白。开始电泳,电泳恒定电压75 V,时间为130 min。待溴酚蓝电泳至胶底部时终止电泳。转膜:分别切胶LC3B(16~18 kD),β-actin(42 KD)。准备6张与胶同样大小的滤纸和1张硝酸纤维素膜(NC)膜,NC膜与滤纸一起放入转膜缓冲液中,至完全浸透。盖上仪器,接通电源,转膜300 mA恒定电流,LC3B约35 min,β-actin约60 min。转膜完毕后,将膜取出放入1×磷酸盐吐温缓冲液(PBST)中洗1次。5%脱脂奶粉封闭聚偏氟乙烯(PVDF)膜,室温放置60 min,4℃过夜,次日室温放置30 min。加入抗LC3 抗体(1∶600)及抗内参照 β-actin抗体(1∶5 000),洗3次,每次15 min。加入稀释HRP标记的二抗(1∶5 000),37℃孵育1 h,洗膜3 次,每次10 min。使用ECL化学发光液与膜孵育1 min,用滤纸吸尽液体,用塑封膜将膜包裹杂交膜,在暗盒内与X胶片曝光15 min;显影冲洗。
1.8透射电镜检测谷氨酸诱导后 ICCs 的自噬体和超微结构的变化 取对数生长期的大鼠结肠ICC细胞,经胰酶消化离心后计数接种至6孔板中,每孔接种1×106的细胞量,贴壁24 h后,加入中浓度谷氨酸与ICCs作用3 h后,经预冷PBS洗涤3次,每次3 min。使用胰蛋白酶消化细胞并收集离心去上清,细胞固定到2.5%戊二醛6~12 h,把固定液弃掉,细胞放入PBS缓冲液中,入1%锇酸后固定1~2 h;乙醇逐级脱水,纯环氧树脂包埋后入40℃烤箱烘烤12 h,取出包埋块修块后超薄切片;铜网捞片,电子染色(铅、铀染色);日立7700型透射电镜观察和摄图。
1.9统计学处理 采用SPSS19.0软件进行方差齐性检验、单因素方差分析、SNK-q检验。
2 结 果
2.1免疫荧光鉴定大鼠结肠ICC细胞 如图1所示,普通显微镜和荧光显微镜下大鼠结肠ICC细胞胞体呈菱形或三角形,细胞核大,核周胞质较少,细胞胞体以 2 个以上长突起为多见,突起间相互连接并与周围细胞紧密相连(图1A);荧光显微镜下 c-Kit 蛋白呈阳性表达,胞体明显着色,呈绿色阳性显色(图1B~1D);核染信号图(图1E)显示蓝色为核染信号。
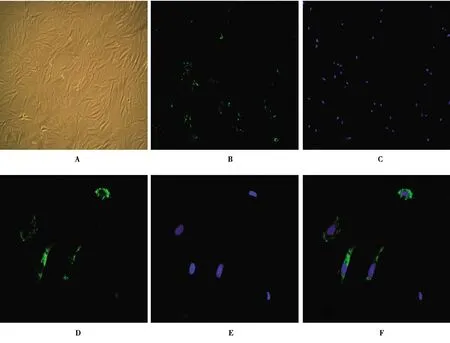
A:ICC细胞倒置显微镜下形态学表现(×40);B:ICC细胞免疫荧光下c-Kit染色(×100);C:DAPI染色(×100);D:c-Kit染色(×400);E:DAPI染色(×400);F:融合染色(×400)
2.2不同时间不同浓度谷氨酸对结肠ICC活性的影响 培养3 h时,各组ICC细胞活力差异无统计学意义(P>0.05);培养6 h时,谷氨酸B、C组ICC细胞活力显著低于空白组(P<0.05);培养6 h时,谷氨酸A、B、C组ICC细胞活力均显著低于空白组(P<0.05,P<0.01);5.0 mmol/L谷氨酸培养细胞24 h时,细胞活力最低,细胞抑制率最高。见表1。
表1 各组培养不同时间对大鼠结肠 ICC细胞活力的影响及细胞抑制率比较
2.3不同时间点不同浓度谷氨酸对ICC的LC3蛋白表达的影响 与空白组比较,培养6 h时谷氨酸B组和培养24 h时谷氨酸B、C组均可显著提高自噬蛋白LC3-Ⅱ/LC3-Ⅰ的比值(P<0.05,P<0.01);与6 h比较,24 h谷氨酸B组、C组LC3-Ⅱ/LC3-Ⅰ比值显著升高(P<0.05),提示随着作用时间的增加,细胞自噬活性相对升高,见表2、图2。
表2 各组培养不同时间点不同浓度谷氨酸LC3-Ⅱ/LC3-Ⅰ比较
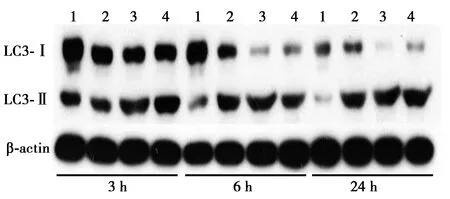
1~4:空白组、谷氨酸A组、谷氨酸B组、谷氨酸C组
2.4结肠ICC细胞内自噬体和超微结构的变化 如图3所示,空白组结肠ICC内可见丰富的线粒体和内质网等细胞器,未见明显的自噬体或自噬溶酶体;谷氨酸B组细胞器减少,内质网管腔扩张,粗面型内质网脱颗粒明显,可见明显自噬泡(红色箭头为初始自噬泡,蓝色箭头为降解自噬泡)和大量自噬体。
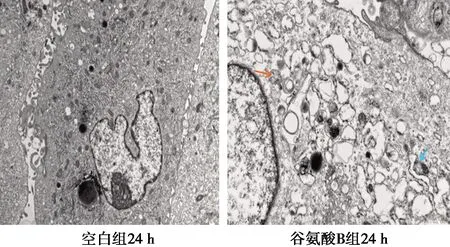
图3 透射电镜下Cajal细胞内超微结构(×400)
3 讨 论
谷氨酸在介导神经递质传递和多种蛋白质合成过程中起关键性作用,过量的谷氨酸因其毒性骤增引起氧化应激的损伤诱导神经元细胞发生程序性死亡〔9〕。研究表明间质细胞的丢失与肠道运动障碍有关,在胃肠动力障碍的结肠炎模型大鼠 ICC 中出现过度自噬现象〔10〕。基于上述依据,本研究应用过量的谷氨酸模拟外界不良应激诱导离体结肠ICCs 产生自噬从而构建大鼠结肠ICC自噬模型。
本实验以不同浓度的谷氨酸作用于体外培养的 SD 大鼠结肠ICC,CCK-8 实验结果表明不同时间点不同浓度谷氨酸均可降低结肠ICC的活力,且以24 h时5 mmol/L谷氨酸效果最优。为继续验证谷氨酸在此浓度及时间下的作用效果,通过Western印迹和透射电镜观察,显示谷氨酸C2组LC3-Ⅱ/LC3-Ⅰ比值最高,透射电镜出现明显的自噬泡,细胞质内空泡增多,细胞器减少,与周围神经突触关系网接触消失,超微结构中的线粒体受损,提示本实验成功诱导结肠ICC的自噬。自噬过程是由一系列自噬相关蛋白介导完成的,LC3是自噬体膜上的标记蛋白,其存在有两种形式即LC3-Ⅰ和LC3-Ⅱ,通过 LC3-Ⅱ/LC3-Ⅰ值可反映自噬水平,作为评估细胞自噬强弱的重要依据〔11〕。与本研究不同,谭人千等〔12〕通过LC3-Ⅱ/LC3-Ⅰ比值结合免疫荧光和透射电镜技术成功筛选到谷氨酸诱导大鼠胃 ICCs 自噬的最佳作用浓度和时间分别为5 mmol/L和 3 h。这可能由于机体不同位置的ICC有不同特性:发生应激性反应初期,产生受损的亚细胞器、错误折叠蛋白等较少,随着时间的推移ICC自噬活性逐渐增加有关。
综上,谷氨酸可以诱导大鼠结肠ICC自噬,其最佳作用浓度和刺激时间分别为 5 mmol/L 和 24 h,为进一步研究结肠ICC功能状态,在增殖、凋亡、表型转化和自噬相关通路的mRNA和蛋白研究提供可靠的细胞模型,利于今后进一步筛选肠道药物靶点。

