内蒙古部分地区草原革蜱携带斑点热群立克次体DNA 检测及其基因型分布
桂 峥, 于晶峰, 木 兰
(1. 内蒙古医科大学研究生院,内蒙古 呼和浩特 010110;2. 内蒙古医科大学基础医学院寄生虫学教研室,内蒙古 呼和浩特 010110)
立克次体(Rickettsia sp)是专性胞内革兰阴性菌,根据立克次体的系统发育,将所有的立克次体划分为4 个群: 贝氏立克次体群(Rickettsia burnetii)、 加 拿 大 立 克 次 体 群 (Rickettsia canadensis)、斑点热群(spotted fever group)和斑疹伤寒群(typhus group),其中斑点热群立克次体(spotted fever grouprickettsia,SFGR)是由蜱维持和传播的[1-2],而草原革蜱(Dermacentor nuttalli)是携带SFGR 的主要媒介[3]。草原革蜱在中国北方、俄罗斯和蒙古国等国家和地区分布广泛[4],SFGR 感染可发生在世界各地,可能会给人类带来严重疾病,中国已报道SFGR 包括黑龙江立克次体(Rickettsia heilongjiang)、劳氏立克次体(Rickettsia raoultii)、斯洛瓦卡立克次体(Rickettsia slova)、艾氏立克次体(Rickettsia ehrlich)、西伯利亚立克次体 (Rickettsia sibirica) 和 马 西 里 立 克 次 体(Rickettsia massiliae)[5]。2015 年在蒙古国的草原革 蜱 中 检 测 出1 种SFGR (劳 氏 立 克 次 体)[6],2018 年在新疆地区从草原革蜱中分离出3 种SFGR(西伯利亚立克次体、劳氏立克次体和斯洛瓦卡立克次体)[7],而2016 年在内蒙古西部的草原革蜱中只分离出劳氏立克次体[8]。对SFGR 的基因型分布情况目前鲜有报道。本研究采用PCR 法对内蒙古自治区部分地区草原革蜱进行SFGR DNA 检测,并对gltA 和ompA 基因进行立克次体同源性分析,以期阐明内蒙古自治区部分地区草原革蜱携带SFGR 的基因型分布特点。
1 材料与方法
1.1 样本采集于2019 年4 月中旬在内蒙古自治区西部的鄂尔多斯市鄂托克旗前旗成川镇、中部的呼和浩特市四子王旗牧场和东部的赤峰市阿鲁科尔沁旗天山镇巴彦温都苏木地区,通过普查从708 只绵羊体表采集蜱264 只,使用镊子和橡胶手套从绵羊体表采集蜱,每只放在一个收集瓶中,收集回来的蜱进行蜱种的鉴定并将捕获蜱保存在-80℃冰箱中。
1.2 主要试剂和仪器血液组织DNA 提取试剂盒(TIANamp Genomic DNA Kit,天根生化有限公司),Invitrogen 琼脂糖(美国Thermo Fisher Scientific 公司),2×San TaqPCRMix (Dye)[生工生物工程(上海) 股份有限公司],DL2000 DNA Marker(日本TaKaRa 公司),GoldViewⅠ型核酸染色剂(北京Solarbio 科技有限公司)。Gene Company Limited PCR 扩增仪(杭州博日科技有限公司),凝胶成像系统ChampGel5000(北京赛智创业科技有限公司)。
1.3 提取蜱虫DNA将采集的蜱标本浸泡在75%的酒精溶液中,5 min 后将浸泡标本放在无菌滤纸上,吸干后用生理盐水清洗3 遍,再用无菌滤纸充分吸干,将放至无菌的EP 管内,取EP 管内单只蜱虫于研钵中,倒入适量液氮以冷冻蜱虫,1~2 min 后将蜱虫用杵头碾碎成粉末状,之后参考血液组织DNA 提取说明书从每个粉碎的蜱粉中提取DNA,-20℃保存,以备后续检测。
1.4 PCR 扩增为了检测立克次体的存在,首先,PCR 扩增立克次体16s RNA 作为初筛试实验,并进一步检测部分阳性样本的gltA 基因和ompA 基因,3 个目的基因的引物均由Primer5 软件设计并在生工生物工程(上海) 股份有限公司合成(表1),PCR 产物用1.5%的琼脂糖凝胶电泳后在琼脂糖凝胶仪紫外灯照射下观察结果。每次实验均以无菌蒸馏水为阴性对照,以避免样本污染而造成假阳性。

表1 PCR 引物序列和扩增条件Tab.1 Sequences of PCR primers and amplification conditions
1.5 序列测定和分析将PCR 产物送至生工生物工程(上海)股份有限公司北京销售分公司进行单向测序和测通,采用Seqman 软件将所得序列进行拼接,登录美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI) 网站,利用BLAST 工具将测序结果与GenBank 中注册基因序列进行同源性比对[9];使用DNAman 7.0软件程序进行多序列比对和序列相似性计算;利用MEGA7 软件邻接法(NJ)构建系统发育树,并通过1 000 个Bootstrap 重复来评估树的稳定性[10]。
1.6 统计学分析采用SPSS 22.0 统计软件进行统计学分析。3 个采样地区所检出的SFGR 阳性率以百分率(%) 表示,组间比较采用χ2检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 蜱种的形态学鉴定邓国藩在《中国经济昆虫志》中描述的蜱标准分类特征:草原革蜱假头短,背部珐琅彩明显,基突短,盾板大,气门板椭圆形,背突短(图1)。基于上述特点对所有成蜱进行形态学鉴定,结果显示全部为草原革蜱。
2.2 SFGR 的检测结果在264 只蜱中,经过16sRNA 初筛共检出SFGR 阳性蜱218 只,阳性率为82.57%(218/264),其中鄂尔多斯地区15 只蜱中SFGR 阳性11 只,阳性率为73.33% (11/15);四子王旗地区30 只蜱中SFGR 阳性22 只,阳性率为73.33% (22/30);赤峰地区219 只蜱中SFGR阳性185 只,阳性率为84.47%(185/219)。3 个地区蜱SFGR 阳性率比较差异无统计学意义(χ2=3.221,P=0.20)。从每个地区阳性样本中随机选取10 个,共30 个阳性样本进行检测,扩增出7 个SFGR gltA 基因阳性样本和14 个SFGR ompA 基因阳性样本。见图2。

图1 草原革蜱形态学鉴定图Fig.1 Morphological identification picture of Dermacentor nuttalli
2.3 序列分析对SFGR 阳性样本进行测序,成功测序14 个SFGR ompA 阳性样本,7 个SFGR gltA 阳性样本,gltA 和ompA 在GenBank 注册的序列号均已显示在进化树上(图3 和4),本研究中检测到的物种序列由几何形状表示,然后再对测序结果进行剪切、拼接和校对处理。以DNAman 7.0 软件对处理后的序列进行比对,结果显示:实验中检测到的立克次体序列相似性较高,gltA 基因和ompA 基因的相似度分别为100.00% 及99.86%;所得序列与GenBank 中注册的劳氏立克次体相似度最高,同源性均为100%。系统发育树分析结果显示:所检出的序列与劳氏立克次体在一个分支上。gltA 的进化树结果显示内蒙古地区的立克次体与乌拉尔立克次体(Candidatus Rickettsia uralica)、帕克立克次体(Rickettsia parkeri)和西伯利亚立克次体(Rickettsia sibirica) 同属一支,亲缘较近,同 源 性 分 别 为 99.59%、 99.54% 和 99.54%(图3)。ompA 的进化树结果显示:内蒙古地区的立克次体与马赛立克次体和扇头蜱立克次体(Rickettsia rhipicephali)同属一支,亲缘接近,同源性分别为97.73%和98.15%(图4)。
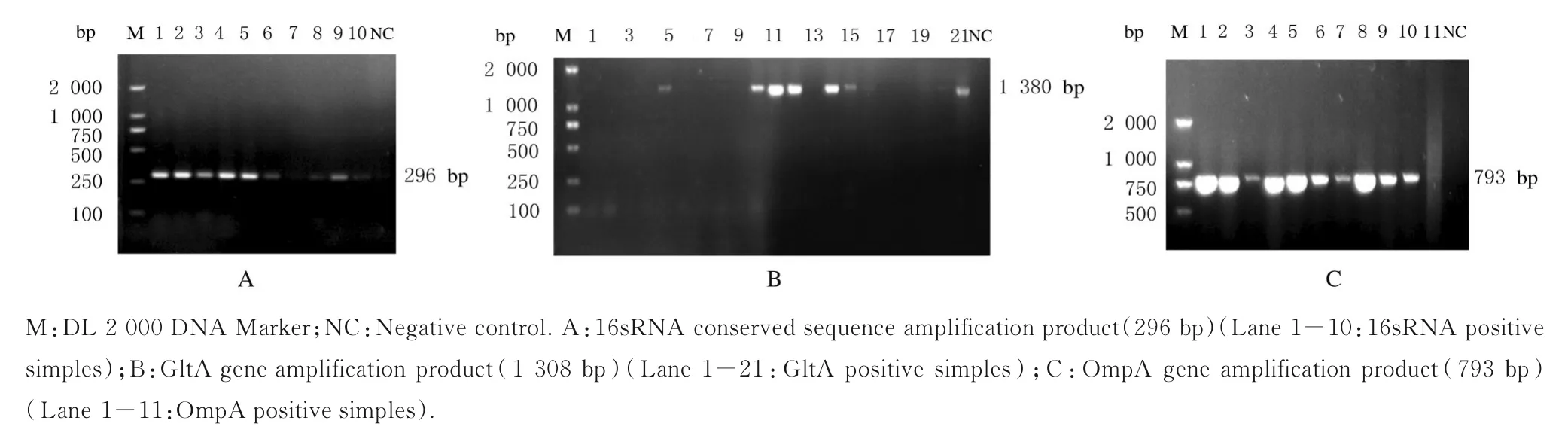
图2 部分蜱样本PCR 扩增产物电泳图Fig.2 Electrophoregram of PCR amplification products of some tick samples
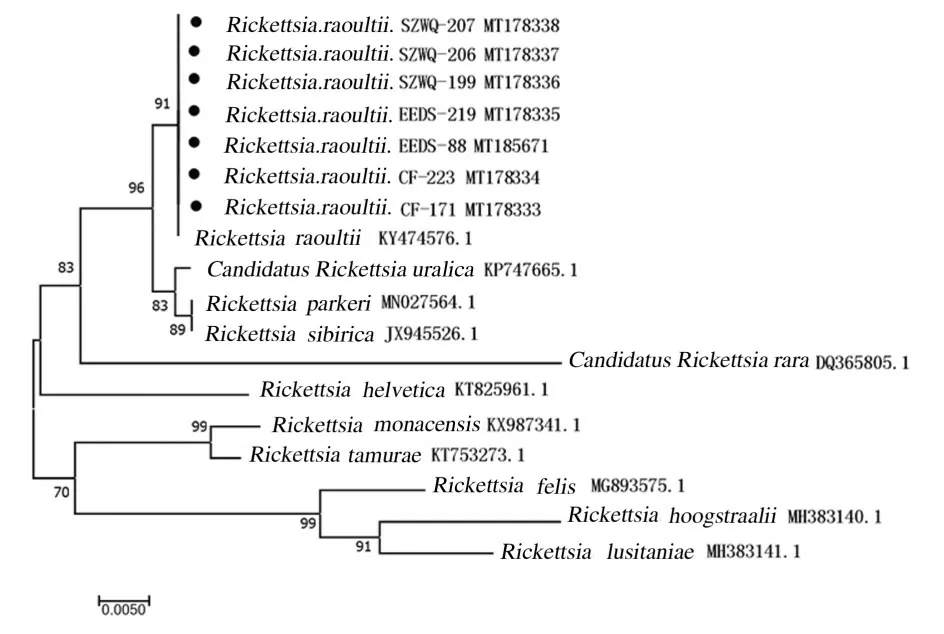
图3 立克次体gltA 测序结果构建的进化树Fig. 3 Phylogenetic tree based on sequencing results of Rickettsia gltA
3 讨 论
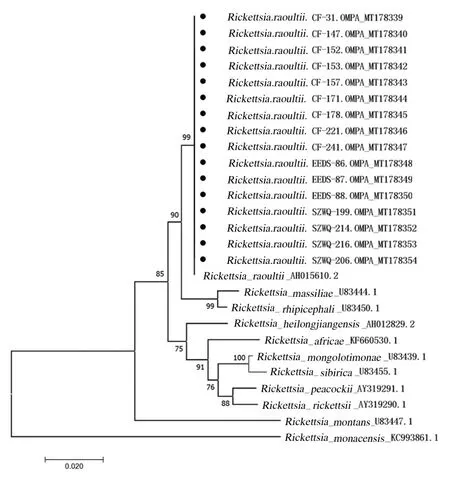
图4 立克次体ompA 测序结果构建的进化树Fig. 4 Phylogenetic tree based on sequencing results of Rickettsia ompA
分子生物学方法为物种基因型的鉴定提供了极大的帮助,特别是在细菌分类中的应用,对于SFGR 来说,16sRNA 由于存在几乎所有原核生物都相同的保守区,可以准确鉴定斑点热群立克次体的存在,但很难区分SFGR 的种属。gltA 和ompA基 因 可 以 用 于SFGR 的 种 属 鉴 定[11]:gltA 基 因 编码柠檬酸合酶,柠檬酸合酶的序列具有种属特异性,进化距离较远的立克次体之间有明显差异[12];ompA 是外膜蛋白基因,由于5′ 端具有高度特异性,因此可作为SFGR 的种属鉴定的“金标准”[11]。本研究结果显示:gltA 基因序列与中国分离出的西伯利亚立克次体亲缘关系较近,同源性为99.5%;ompA 基因序列与西伯利亚立克次体亲缘关系相对较远,同源性为95.17%。冯立等[13]基于ompA 基因序列比较,结果与劳氏立克次体同属一支,而gltA 基因序列结果显示其与劳氏立克次体亲缘关系接近但并非同一只。说明2 种基因对立克次体亚种进行鉴定的结果存在差异,原因可能是地理条件和宿主生物行为的差异,还有可能是gltA和ompA 基因的进化速度不同所致,还需进一步验证。因此为了能准确对亚种进行分类,不能单独依靠某一种基因,而是利用多种基因对物种进行鉴定和分类。
内蒙古地区地域辽阔,与周边的8 个省区有地缘连通,北与蒙古国和俄罗斯接壤,因此有利于蜱种的迁移和蜱传疾病的扩散[14]。通过对内蒙古地区草原革蜱携带SFGR 的情况来看,感染率高达82.57%,说明该地区存在蜱传立克次体的自然疫源地。同源性比较和序列分析结果表明:gltA 基因序列与劳氏立克次体(KY474576.1) 同源性达100%,ompA 基因序列与劳氏立克次体(AH015610.2)同源性达100%,两者均与蒙纳克立克次体(Rickettsia monacensis)差异较大。劳氏立克次体(KY474576.1)是从北京地区病例中检测出来的基因型,而另一种劳氏立克次体(AH015610.2)是从俄罗斯的森林革蜱中检测出的基因型,上述2 个地区与内蒙古地区均属于中国北部,有着相似的地理环境和种群分布特点,可以推测内蒙古地区的立克次体与劳氏立克次体(KY474576.1) 和劳氏立克次体(AH015610.2)属于同一个基因型。内蒙古东部(赤峰地区)、西部(鄂尔多斯地区)和中部(四子王旗地区)地区的草原革蜱携带SFGR 的基因型分布情况结果表明:内蒙古草原革蜱中分离的SFGR 只有一种,即劳氏立克次体,该种类的立克次体广泛分布于国内外很多地区,如俄罗斯[15]、哈萨克斯坦[16]及中国的江苏、江西[17]、云南[4]和黑龙江[18]等。近年来有关劳氏立克次体感染的报道也越来越多[19],2014 年在内蒙古奇乾地区的森林革蜱中检出劳氏立克次体的阳性率为50.00%,在全沟硬蜱中检测劳氏立克次体的阳性率为2.05%[20],提示革蜱中劳氏立克次体的携带率高于其他蜱。本次调查未检测出西伯利亚立克次体,与FAN 等[21]报道不一致,可能与采集地区、媒介蜱种类、样本量以及立克次体在蜱体内的遗传变异情况等有关,需要进一步扩大调查地区和增加媒介蜱的种类来完善蜱传立克次体的研究。本次研究结果丰富了内蒙古地区的草原革蜱携带SFGR 的数据,同时也完善了研究者对蜱携带SFGR 基因型的认识。
——劳氏立克次体的研究现状

