亲体肝移植患儿围术期血清中脑损伤标志物水平的变化及临床意义
于洪丽, 喻文立, 翁亦齐, 刘伟华, 孙 英, 刘云霞
(天津市第一中心医院麻醉科,天津 300192)
儿童肝移植最常见的原因为胆道闭锁,大部分患儿最终发展为终末期肝病,病死率高,药物治疗无效,肝移植术是治疗患儿终末期肝脏疾病的唯一有效手段[1]。伴随肝移植技术改进、围术期管理水平提高以及免疫抑制剂的临床应用等,肝移植术后5 年生存率已提高至70%~90%[2-3]。尽管目前肝移植技术已有很大进步,但术后仍会发生心、脑、肾和肺等重要脏器损伤,其中神经系统并发症发生率可高达46%,伴有神经系统并发症的患儿生存率明显降低。目前临床上使用的麻醉药物均有可能导致发育中的大脑神经元死亡和长期神经功能损伤[4-6]。研究[7-8]显示:血清中星形胶质源性蛋白S-100β 蛋白具有良好的表达神经星形胶质细胞功能,神经元特异性烯醇化酶(neuron specific enolase,NSE)具有良好的表达神经细胞功能,术后高水平NSE 和S-100β 蛋白与手术患儿脑损伤有关。目前胆道闭锁行亲体肝移植患儿围术期NSE和S-100β 蛋白水平的变化尚不清楚。本研究旨在探讨胆道闭锁行亲体肝移植患儿围术期血清中NSE 和S-100β 蛋白水平的变化,并探讨其临床意义。
1 资料与方法
1.1 研究对象本研究纳入2017 年1 月—2018 年1 月在天津市第一中心医院择期行亲体肝移植手术的胆道闭锁患儿40 例(胆道闭锁的诊断标准:新生儿黄疸原因不明时B 型超声检查是有效的检查手段,术中胆道造影是诊断胆道闭锁的金标准),其中男性21 例,女性19 例,4~12 个月龄,体质量3.0~10.0 kg,美 国 麻 醉 医 师 协 会(American Society of Anesthesiologists,ASA) 分 级Ⅲ或Ⅳ级。供者平均年龄为33 岁(22~55 岁),供、受者血型相合。入选标准:ASA 分级Ⅲ或Ⅳ级(由同一麻醉医生进行术前分级评估),肝功能Child-Pugh 分级为B 或C 级,病例资料完整,按时完成随访。排除标准:二次肝移植及术前并发严重心脏病或多脏器衰竭等并发症。本研究获得本院医学伦理委员会批准(伦理号:2016N0039KY),并在美国临床试验注册中心(Clinical Trials)进行临床试验注册(注册号:NCT030248404),且与患儿监护人签署知情同意书。
1.2 麻醉及术中管理术前常规禁食、禁饮(术前6 h 禁食配方奶和牛奶,术前4 h 禁食母乳,术前2 h 禁饮)。 麻醉前30 min 肌肉注射阿托品0.01 mg·kg-1。入室后常规监测脉搏、血氧饱和度(SPO2)和心电图,开放外周静脉通路,应用甲基强的松龙1 mg·kg-1、咪达唑仑0.05 mg·kg-1、依托咪酯0.2 mg·kg-1、芬太尼2 μg·kg-1和维库溴铵0.08 mg·kg-1进行快速麻醉诱导,经口气管插管后双肺听诊,双肺呼吸音清,连接呼吸机机械通气,观察呼吸末二氧化碳波形正常,吸入氧浓度50%~60% (无肝期为100%),潮气量8~10 mL·kg-1,呼吸频率20~26 min-1,吸呼比1.0 (1.5~2.0),维持呼吸末二氧化碳分压(PETCO2) 30~35 mmHg、气道压力18~25 cmH2O (1 cmH2O=0.098 kPa)。麻醉诱导平稳后,监测脑电图双频谱指数(bispectral index,BIS),在B 超引导下行桡动脉穿刺置管有创血压监测,右侧颈内静脉置入三腔中心静脉导管监测中心静脉压(central venous pressure ,CVP)。麻醉维持:持续静脉输注1%丙泊 酚 9~15 mg·kg-1·h-1、 瑞 芬 太 尼 0.1~0.2 μ g·kg-1·min-1和 顺 苯 磺 酸 阿 曲 库 铵0.12 mg·kg-1·h-1。麻醉维持,间断追加芬太尼1~3 μg·kg-1,维持麻醉深度。术中液体输注进行加温处理,静脉输注乳酸钠葡萄糖氏液及白蛋白溶液,体温维持在36.0 ℃~37.5 ℃,根据术中血气分析及凝血功能监测结果输注适量浓缩红细胞及新鲜冰冻血浆。通过调节输血输液速度及持续静脉泵注小剂量多巴胺,维持平均动脉压(mean artery pressure,MAP)40~65 mmHg,CVP 6~8 mmHg,心 率 (heart rate,HR) 110~170 min-1,SpO295%~100%,体 温35.5 ℃~37.5 ℃,BIS 40~60,PETCO235~45 mmHg,血 红 蛋 白(hemoglobin,Hb)>80 g·L-1,尿量>1 mL·kg-1·h-1。根据动脉血气分析结果及时调整呼吸参数,术中采用加温毯和输液加温设备维持体温恒定在一定范围内。
1.3 资料收集分别于麻醉后切皮即刻(T1)、无肝期30 min(T2)、新肝期1 h(T3)和新肝期24 h(T4)时采集患儿右颈内静脉血样,即时行血气分析,余静脉血室温下3 000 r·min-1离心10 min,取上清液,置于-80 ℃冰箱冻存待测。于各时间点记录患儿HR、MAP 、CVP 和外周血pH 值,采用酶联免疫吸附测定(ELISA)试剂盒(上海拜沃生物科技有限公司)检测血清中NSE 和S-100β 蛋白水平。
1.4 统计学分析采用SPSS 20.0 统计软件进行统计学分析。各个时间点患儿HR、MAP、CVP、外周血pH 值及血清中NSE 和S-100β 蛋白水平符合正态分布,以表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD 检验。患儿性别比、ASA 分级比和供肝受体质量比(GRWR)等计数资料以百分率表示。以P<0.05为差异有统计学意义。
2 结 果
2.1 患儿一般情况及术中情况肝移植手术患儿手术方式均采取亲属活体背驮式肝移植,切取供肝左外叶用于肝移植。本组胆道闭锁患儿40 例,4~12 月龄,身高56~73 cm,体质量3.0~10.0 kg,移植物与受体质量比(graft and recipient weight ratio,GRWR) 0.83%~5.16%,手 术 时 间 为240~560 min,无肝期时间为25~100 min,冷缺血时间为155~165 min,红细胞输注量为0~4 U,血浆输注量为200~400 mL。
2.2 肝移植术中不同时间点患儿HR、MAP、CVP和外周血pH值术中无肝期和新肝再灌注期血流动力学发生明显变化。下腔静脉阻断后,MAP、CVP、肺动脉压和心排出量明显下降,新肝再灌注期上述指标逐渐恢复。与T1时比较,T2时患儿HR 增加(P<0.05),MAP、CVP 和外周血pH 值降低(P<0.05);与T2时比较,T3和T4时患儿HR 降 低(P<0.05),MAP、 CVP 和 外 周 血pH 值升高(P<0.05);与T3时比较,T4时患儿HR 降低(P<0.05),MAP、CVP 和外周血pH 值升高(P<0.05);术毕各项指标均降至术前水平。围术期患儿血流动力学指标和外周血pH 值见表1。
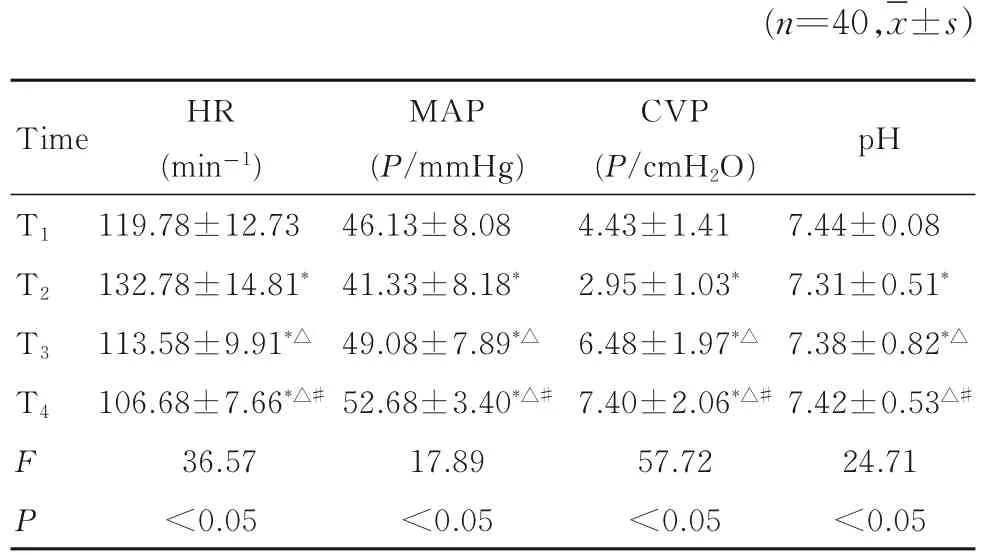
表1 围术期各时间点患儿血流动力学指标和外周血pH 值Tab.1 Hemodynamic indexes and pH values of blood during perioperative period of infants at different time points
2.3 肝移植术中不同时间点患儿血清中NSE 和S-100β 蛋白水平与T1时比较,T2~T4时患儿血清中NSE 和S-100β 蛋白水平均明显升高(P<0.01);与T2时 比 较,T3时 患 儿 血 清 中NSE 和S-100β 蛋白水平均明显升高(P<0.05),T4时 患儿血清中NSE 和S-100β 蛋白水平均明显降低(P<0.05);与T3时比较,T4时患儿血清中NSE和S-100β 蛋白水平明显降低(P<0.05)。见表2。
3 讨 论
本研究从围术期血流动力学波动、血清学脑损伤标记物NSE 和S-100β 蛋白水平等方面评价肝移植患儿围术期大脑的变化。本研究结果显示:在无肝期及缺血再灌注期患儿血流动力学波动较大,脑损伤标记物NSE 和S-100β 蛋白水平升高,缺血再灌注期达到高峰,表明缺血再灌注可能会对患儿大脑造成一定程度影响。同时胆道闭锁患儿发病年龄小,病情进展迅速,接受移植时的年龄普遍小于1 岁[9]。此阶段大脑发育正处于敏感高峰期,婴幼儿的脑组织发育经历神经细胞增殖分化、迁移、突触生长和神经元凋亡等一系列复杂过程,发育期的脑组织极易受到外界因素的干扰,引起脑组织发育异常[10-11]。短时间内神经轴突和树突快速生长并形成复杂的神经系统网络,50%~70%神经细胞参与了这一过程,胆道闭锁患儿术后3 个月神经系统患病率为13.8%,术后3 个月~3 年神经系统的患病率为16.9%[12];术后长期随访,30.7%的患儿术后出现包括癫痫、脑病和头痛在内的神经系统并发症[13]。

表2 围术期各时间点患儿血清中NSE 和S-100β 蛋白水平Tab. 2 Levels of NSE and S-100 β in serum during perioperative period of infants at different time points
肝移植围术期脑损伤与多种因素有关,目前主要观点为术中肝脏缺血再灌注导致脑损伤,新肝开放时血流动力学的剧烈波动,炎症因子释放,产生大量氧自由基,导致脑细胞水肿以及迟发性神经元坏死等严重损害[14-15]。此外,行肝移植手术患儿伴有肝功能异常、胆红素升高、肝性脑病、低蛋白血症、食管胃底静脉曲张、消化道出血和肠道淤血等,使肠道菌群蛋白质分解代谢产氨增加,由肠道进入血液中的氨浓度升高。生长发育期患儿血脑屏障功能薄弱,胆红素可能降低细胞表面张力及脑毛细血管内皮细胞壁的毒性作用,使血脑屏障通透性增加[16]。同时肝移植患儿术前较高的血氨及胆红素易通过血脑屏障进入脑内,破坏神经系统平衡,使脑内线粒体氧化磷酸化脱偶联影响脑细胞代谢,导致中枢神经系统紊乱甚至是肝性脑病及黄疸等严重中枢神经系统疾病。本课题组前期研究[17-18]显示:通过贝利婴幼儿发展量表评估肝移植手术患儿术后2 周认知功能,其智力发展指数和运动发展指数较术前有所下降。
测定患儿脑损伤标记物NSE 和S-100β 蛋白水平可以反映行肝移植手术患儿围术期的脑损伤情况[19-22]。本研究结果显示:患儿血清中NSE 和S-100β 蛋白水平从无肝期开始升高,并于新肝期1 h 达高峰,术后24 h 逐渐恢复但仍高于基础水平,证实肝移植围术期患儿短时间内并发脑损伤。NSE 主要存在于神经元和神经分泌细胞中,是特异地存在于神经细胞及神经内分泌细胞胞浆的一种糖酵解酶,脑损伤事件导致神经细胞膜破坏时,伴随着血脑屏障的损害,脑细胞中的NSE 可经血脑屏障进入血流,使其血清水平升高,成为脑损伤监测的途径之一[23]。S-100β 蛋白具有中枢神经系统特异性,广泛表达于组织细胞中,以星形胶质细胞和施万细胞中水平最高,通过受损的血脑屏障和脑脊液循环进入血液[24]。在儿科,测定体液中S-100β 蛋白水平已用来监测围产期窒息的婴儿,指导临床治疗。缺血再灌注综合征是影响神经系统并发症形成的重要原因,供肝血管吻合完毕,接受血流再灌注后MAP 明显降低,持续性低血压,组织低灌注及缺氧代谢产生大量酸性代谢产物,NSE 和S-100β 蛋白高水平表达,并在肝移植再灌注后1 h 达到峰值,新肝期早期心排量不但未迅速恢复,反而进一步下降,且早期大量的酸性代谢产物、内毒素、血管活性物质及炎性因子均可造成神经系统的伤害,随着肝脏移植成功,在受者体内发挥作用,患儿由肝衰竭引起的肝性脑病和电解质紊乱等逐渐恢复。本研究结果表明:亲体肝移植手术围术期患儿存在脑损伤,以新肝灌注期最为明显,术后有逐渐减轻的趋势。本研究尚有不足之处,由于本研究样本量较少,围术期多种因素与患儿脑损伤有关联,仍需进一步的临床研究加以证实。
综上所述,亲体肝移植患儿围术期存在脑损伤,从无肝期开始,新肝期达到顶峰,术后逐渐恢复。围术期脑损伤标记物的检测可判断脑损伤及其严重程度,进而指导临床采取脑保护措施,为围术期脑保护的实施及时机选择提供参考,且对亲体肝移植患儿术后神经系统并发症的预防具有重要意义。

