siRNA 靶向沉默TAK1 基因对甲状腺癌细胞增殖、迁移和p38 MAPK 信号通路的抑制作用
张春英, 阴广维, 尤鸣达,陈 红,胡耀杰,李岩冰, 陈春悠
(河北医科大学附属唐山工人医院头颈外科,河北 唐山 063000)
转化生长因子β 激活激酶1(TGF-β activated kinase 1,TAK1) 为p38 丝 裂 原 活 化 蛋 白 激 酶(mitogen-activated protein kinase,MAPK) 家族成员,在免疫反应、炎症反应和纤维化等疾病中发挥重要作用,其可通过p38 等多种信号通路发挥生物学作用[1-2]。TAK1 参与多种恶性肿瘤的发生发展过程:TAK1 可影响肺癌细胞增殖和侵袭过程[3];食管癌组织中TAK1 呈高表达,其表达水平与食管癌的TNM 分期、浸润深度和淋巴结转移有密切关联,TAK1 可能成为食管癌的预后评估指标和治疗靶 点[4]。LIN 等[5]研 究 发 现:TAK1 在 甲 状 腺 癌组织中呈高表达,其表达水平与患者的临床分期和淋巴结转移关系密切。p38 MAPK 是甲状腺癌增殖和迁移的重要调控因子,p38 MAPK 信号通路激活可促进甲状腺癌细胞增殖和迁移,抑制p38 MAPK信号通路激活可抑制甲状腺癌细胞增殖和迁移。增殖细胞核抗原(proliferating cell nuclear antigen,PCNA) 为细胞增殖的指标,可反映细胞增殖状态[6]; 基 质 金 属 蛋 白 酶 2 (matrix metalloproteinase-2,MMP-2) 和 基 质 金 属 蛋 白 酶9(matrix metalloproteinase-9,MMP-9) 可有效降解细胞外基质,在细胞的侵袭迁移中发挥重要作用,MMP-2 和MMP-9 表达是细胞侵袭和迁移的关键,抑制其表达可抑制细胞侵袭和迁移过程[7-8]。本研究旨在通过小干扰RNA (small interfering RNA,siRNA)靶向沉默甲状腺癌细胞中TAK1 表达,探讨其对甲状腺癌细胞增殖、侵袭和迁移以及p38 MAPK 信号通路的影响,阐明TAK1 在甲状腺癌增殖和迁移中的可能作用机制。
1 材料与方法
1.1 细胞、主要试剂和仪器正常甲状腺上皮Nthyori3-1 细 胞 和 甲 状 腺 癌 8505C、 NPA、BCPAP、KMH-2 细胞(中国科学院上海细胞库)。siRNA-TAK1 和 阴 性 对 照siRNA (TAK1 siRNA正 义 链: 5′-GGACAUUGCUUCUACAAAU-3′,反 义 链:5′-GAGUGAAUCUGG ACGUUUA-3′)(上海吉玛公司设计合成),RPMI-1640 培养基、实时荧光定量聚合酶链式反应(qRT-PCR)试剂盒、Trizol 试剂、RIPA 裂解液、BCA 蛋白浓度测定试剂盒、LipofectamineTM2000 转染试剂盒和MTT 试剂盒(美国Sigma 公司),兔抗鼠PCNA 多克隆抗体、兔抗人TAK1 单克隆抗体、兔抗鼠MMP-2 多克隆抗体、兔抗鼠MMP-9 多克隆抗体和兔抗鼠p38 多克隆抗体和兔抗鼠磷酸化p38(p-p38)多克隆抗体(美国Cell Signaling 公司)。凝胶成像分析仪(上海Bio-Rad 公司),Transwell 小室(美国Corning 公司)。
1.2 细胞培养及传代将正常甲状腺上皮Nthyori3-1 细 胞 和 甲 状 腺 癌 8505C、 NPA、BCPAP、KMH-2 细胞置于含胎牛血清的RPMI-1640 培养基中培养,根据细胞生长情况,每2~3 d换液2 次,待细胞达80% 以上融合时进行传代培养。取生长状态良好的第3 代细胞进行后续研究。
1.3 qRT-PCR 法检测细胞中TAK1 mRNA 水平收集第3 代正常甲状腺上皮Nthyori3-1 细胞和甲状腺癌8505C、NPA、BCPAP、KMH-2 细胞,加入Trizol 裂解液,提取总RNA,以RNA 为模板逆转录合成cDNA。进行PCR 扩增,PCR 反应条件:95 ℃、 5 min;95 ℃、45 s,58 ℃、 30 s,72 ℃、50 s,72 ℃、5 min,共40 个循环,以GAPDH 为内 参。 TAK1 引 物 序 列: 上 游 引 物 5′-ATTCCACAGATACAATGGCTC-3′,下 游 引 物5′-TGTAGTAACAATGCGATTTGCC-3′。 每 组7个复孔。细胞中TAK1 mRNA表达水平以2-ΔΔCt表示。
1.4 Western blotting 法检测细胞中TAK1 蛋白表达水平收集第3 代正常甲状腺上皮Nthyori3-1 细胞和甲状腺癌8505C、NPA、BCPAP、KMH-2 细胞,加入RIPA 裂解液孵育30 min,提取总蛋白,BCA 法进行蛋白定量测定,将蛋白和loading buffer煮沸变性,取30 μg 蛋白样品加入上样孔中,电泳2 h;从玻璃板中取出凝胶,将PVDF 膜放甲醇中孵育10 s,在4℃中转膜,脱脂奶粉封闭2 h,加入一抗兔抗人TAK1 单克隆抗体(1∶300),过夜孵育;加入二抗(1∶2 000) 孵育2 h,ECL 发光,扫描图像,Image J 分析条带灰度值。以β-actin 为内参,每组7 个复孔。TAK1 蛋白表达水平=TAK1 蛋白条带灰度值/β-actin 蛋白条带灰度值。选择TAK1 mRNA 和蛋白表达水平最高的甲状腺癌细胞(KMH-2 细胞)进行后续研究。
1.5 细胞分组和处理将第3 代KMH-2 细胞随机分为空白对照组、阴性对照组和siRNA-TAK1 组。将各组KMH-2 细胞置于含胎牛血清的RPMI-1640培养基中培养,转染前1 d 将细胞接种到6 孔细胞培养板中,每孔5×105个细胞,细胞达80%贴壁生长时,按照LipogectamineTM2000 转染试剂盒说明书进行转染,阴性对照组细胞转染阴性对照siRNA,siRNA-TAK1 组细胞转染TAK1 siRNA,空白对照组细胞不转染。转染48 h 时,采用qRTPCR 和Western blotting 法检测细胞转染效率(测定细胞中TAK1 mRNA 和蛋白表达水平),方法同“1.3”和“1.4”。
1.6 MTT 法检测各组细胞增殖活性将转染48 h各组KMH-2 细胞接种到24 孔细胞培养板中,每孔1×104个细胞,分别培养24、48 和72 h,每孔加入10 μL MTT 溶液,置于培养箱中继续培养4 h 后取出,酶标仪测定各孔波长570 nm 处的吸光度(A)值,代表细胞增殖活性。
1.7 Transwell 小室实验检测各组细胞中侵袭和迁移细胞数侵袭细胞数:将Matrigel 基质胶移到4℃冰箱中过夜融化,将Mateigel 基质胶覆盖在Transwell 小室上室中,放置1 h。将各组细胞浓度调整为1×104个/100 μL,加入到小室上室,每组设7 个复孔,下室加入RPMI-1640 培养基,置于培养箱中继续培养,24 h 后取出小室,去掉基质胶,甲醛固定1 h,HE 染色,200 倍显微镜下观察并计数穿膜细胞数,即侵袭细胞数。迁移细胞数:小室上室不用基质胶包被,其余步骤同侵袭细胞数测定。
1.8 Western blotting 法检测各组细胞中PCNA、MMP-2、MMP-9、p38 和p-p38 蛋白表达水平取各组转染48 h 细胞,分别以兔抗鼠PCNA 多克隆抗体、兔抗鼠MMP-2 多克隆抗体、兔抗鼠MMP-9多克隆抗体、兔抗鼠p38 多克隆抗体和兔抗鼠p-p38 多克隆抗体,检测各组细胞中PCNA、MMP-2、MMP-9、p38 和p-p38 蛋白表达水平,方法同“1.4”。
1.9 统计学分析采用SPSS 20.0 统计软件进行统计学分析。细胞中TAK1 mRNA 和蛋白表达水平,细胞增殖活性,侵袭细胞数和迁移细胞数,各组细胞中PCNA、MMP-2、MMP-9、p38 和p-p38蛋白表达水平经检验均符合正态分布,均以表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 甲状腺癌细胞中TAK1 mRNA 和蛋白表达水平与正常甲状腺上皮Nthyori3-1 细胞比较,甲状腺 癌8505C、 NPA、 BCPAP 和KMH-2 细 胞 中TAK1 mRNA 和蛋白表达水平均明显升高(P<0.05)。见 表1 和 图1。取TAK1 mRNA 和 蛋 白 表达水平最高的KMH-2 细胞进行后续研究。
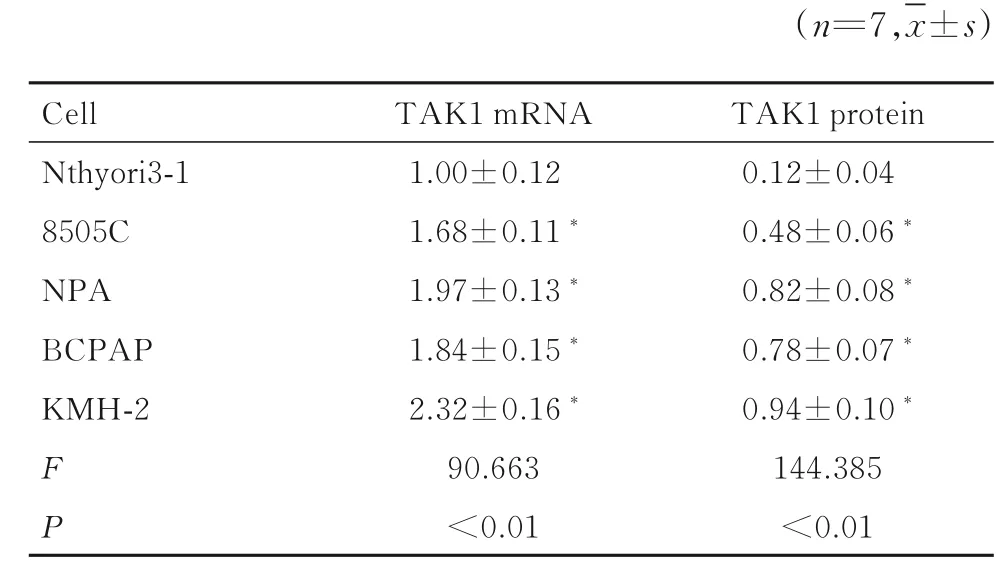
表1 正常甲状腺上皮细胞和甲状腺癌细胞中TAK1 mRNA和蛋白表达水平Tab. 1 Expression levels of TAK1 mRNA and protein in normal thyroid epithelial cells and thyroid cancer cells
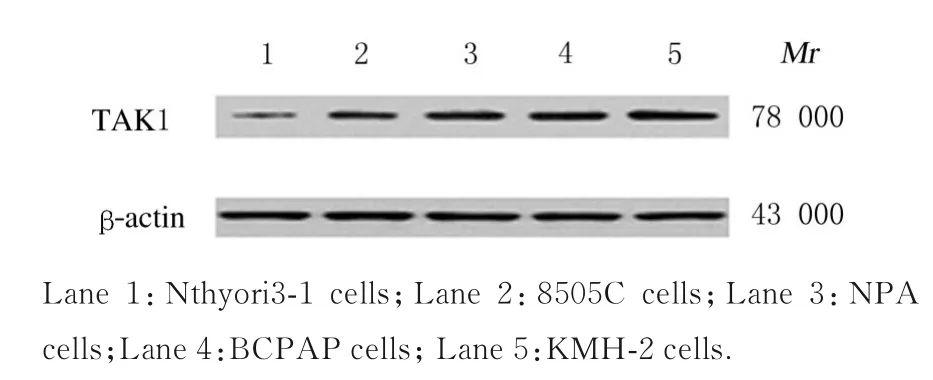
图1 Western blotting 法检测正常甲状腺上皮细胞和甲状腺癌细胞中TAK1 蛋白表达电泳图Fig.1 ElectrophoregramofexpressionsofTAK1protein in normal thyroid epithelial cells and thyroid cancer cells detected by Western blotting method
2.2 siRNA-TAK1 的转染效率与空白对照组和阴性对照组比较,siRNA-TAK1 组KMH-2 细胞中TAK1 mRNA 和蛋白表达水平明显降低(P<0.05);与空白对照组比较,阴性对照组KMH-2 细胞中TAK1 mRNA 和蛋白表达水平差异无统计学意义(P>0.05)。见表2 和图2。
2.3 各组KMH-2 细胞增殖活性与空白对照组和阴性对照组比较,不同时间点siRNA-TAK1 组KMH-2 细胞增殖活性均明显降低(P<0.05);与空白对照组比较,不同时间点阴性对照组KMH-2细胞增殖活性差异均无统计学意义(P>0.05)。见表3。
表2 各组KMH-2 细胞中TAK1 mRNA 和蛋白表达水平Tab. 2 Expression levels of TAK1 mRNA and protein in KMH-2 cells in various groups
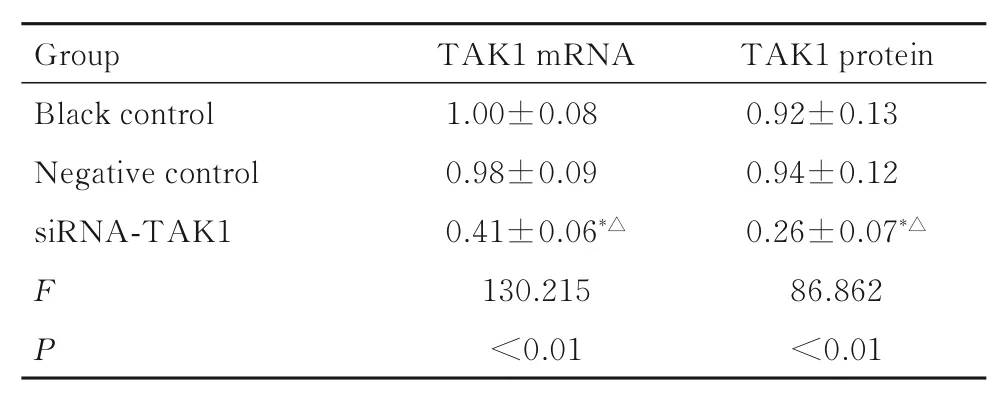
表2 各组KMH-2 细胞中TAK1 mRNA 和蛋白表达水平Tab. 2 Expression levels of TAK1 mRNA and protein in KMH-2 cells in various groups
*P<0.05 compared with black control group;△P<0.05 with negative control group.
Group Black control Negative control siRNA-TAK1 FP TAK1 mRNA 1.00±0.08 0.98±0.09 0.41±0.06*△130.215<0.01 TAK1 protein 0.92±0.13 0.94±0.12 0.26±0.07*△86.862<0.01
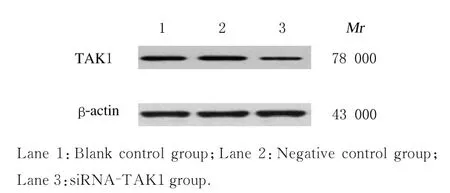
图2 Western blotting 法检测各组KMH-2 细胞中TAK1 蛋白表达电泳图Fig.2 Electrophoregram of expressions of TAK1 protein in KMH-2 cells in various groups detected by Western blotting method
表3 不同时间点各组KMH-2 细胞增殖活性Tab. 3 Proliferation activities of KMH-2 cells in various groups at different time points
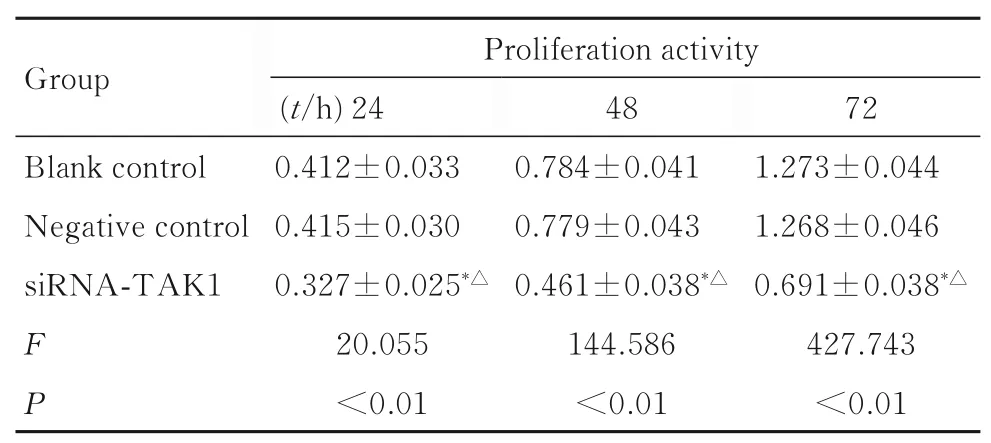
表3 不同时间点各组KMH-2 细胞增殖活性Tab. 3 Proliferation activities of KMH-2 cells in various groups at different time points
*P<0.05 compared with blank control group; △P<0.05 compared with negative control group.
Group Blank control Negative control siRNA-TAK1 FP Proliferation activity(t/h)24 0.412±0.033 0.415±0.030 0.327±0.025*△20.055<0.01 48 0.784±0.041 0.779±0.043 0.461±0.038*△144.586<0.01 72 1.273±0.044 1.268±0.046 0.691±0.038*△427.743<0.01
2.4 各组KMH-2 细胞中侵袭和迁移细胞数与空白对照组和阴性对照组比较,siRNA-TAK1 组KMH-2 细胞中侵袭细胞数和迁移细胞数均明显降低(P<0.05);与空白对照组比较,阴性对照组KMH-2 细胞中侵袭细胞数和迁移细胞数差异均无统计学意义(P>0.05)。见表4、图3 和图4。
表4 各组KMH-2 细胞中侵袭细胞数和迁移细胞数Tab. 4 Number of invasion and migration cells of KMH-2 cells in various groups
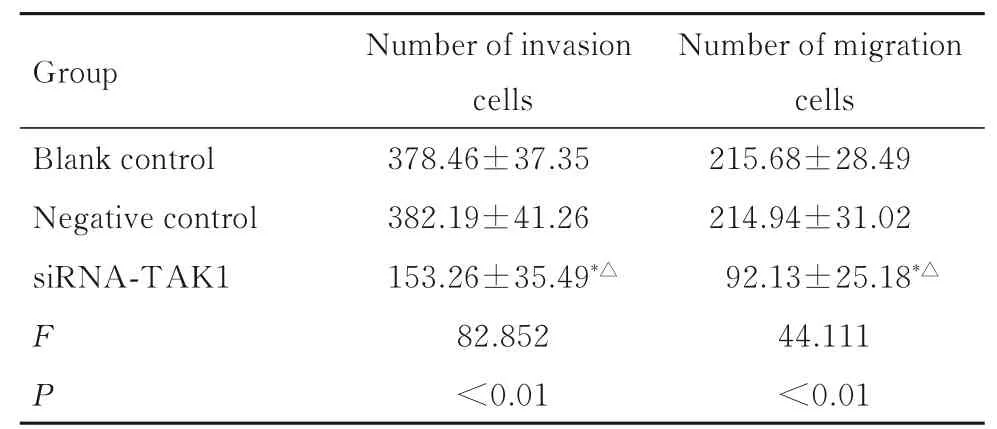
表4 各组KMH-2 细胞中侵袭细胞数和迁移细胞数Tab. 4 Number of invasion and migration cells of KMH-2 cells in various groups
*P<0.05 compared with blank control group; △P<0.05 compared with negative control group.
Group Blank control Negative control siRNA-TAK1 FP Number of invasion cells 378.46±37.35 382.19±41.26 153.26±35.49*△82.852<0.01 Number of migration cells 215.68±28.49 214.94±31.02 92.13±25.18*△44.111<0.01
2.5 各组KMH-2 细胞中PCNA、MMP-2 和MMP-9蛋白表达水平与空白对照组和阴性对照组比较,siRNA-TAK1 组KMH-2 细胞中PCNA、MMP-2 和MMP-9 蛋白表达水平明显降低(P<0.05);与空白对照组比较,阴性对照组KMH-2 细胞中PCNA、MMP-2 和MMP-9 蛋白表达水平差异均无统计学意义(P>0.05)。见图5 和表5。
2.6 各组KMH-2 细胞中p38 和p-p38 蛋白表达水平各组KMH-2 细胞p38 蛋白表达水平比较差异均无统计学意义(P>0.05)。与空白对照组和阴性对照组比较,siRNA-TAK1 组KMH-2 细胞中p-p38 蛋白表达水平明显降低(P<0.05);与空白对照组比较,阴性对照组KMH-2 细胞中p-p38 蛋白表达水平差异无统计学意义(P>0.05)。见表6和图6。
3 讨 论

图3 Transwell 小室实验检测各组KMH-2 细胞侵袭能力(结晶紫,×200)Fig.3 Invasion abilities of KMH-2 cells in various groups detected by Transwell chamber assay(Crystal violet,×200)

图4 Transwell 小室实验检测各组KMH-2 细胞迁移能力(结晶紫,×200)Fig.4 Migration abilities of KMH-2 cells in various groups detected by Transwell chamber assay(Crystal violet,×200)
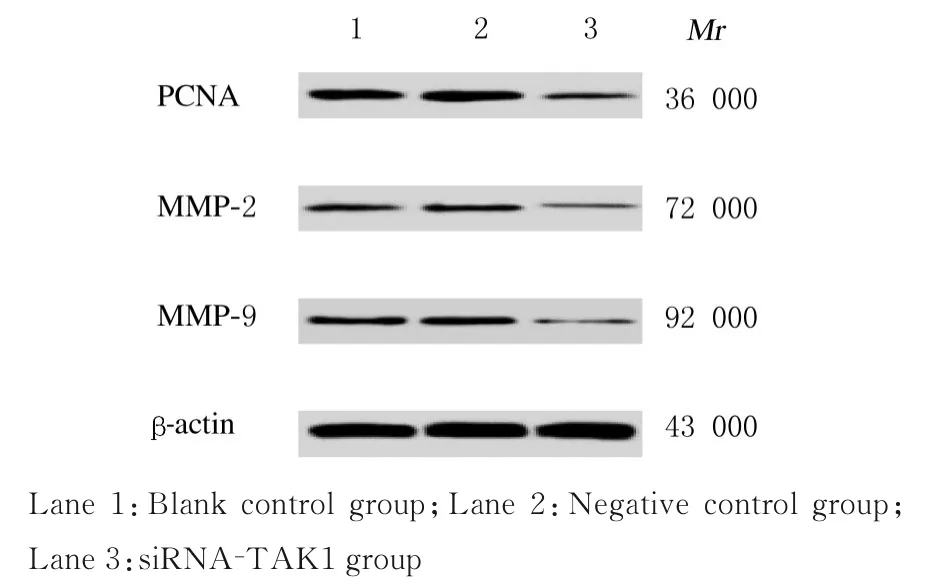
图5 Western blotting 法检测各组KMH-2 细胞中PCNA、MMP-2 和MMP-9 蛋白表达电泳图Fig. 5 Electrophoregram of expressions of PCNA,MMP-2, and MMP-9 proteins in KMH-2 cells in various groups detected by Western blotting method
表5 各组KMH-2 细胞中PCNA、MMP-2 和MMP-9 蛋白表达水平Tab. 5 Expression levels of PCNA, MMP-2 and MMP-9 proteins in KMH-2 cells in various groups
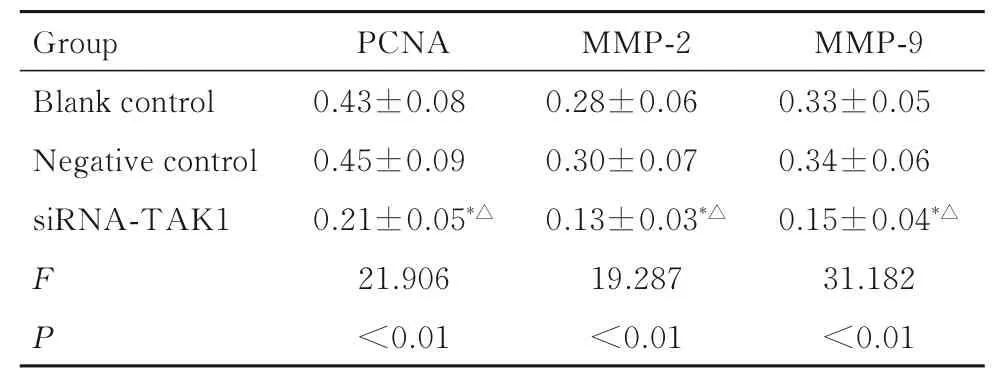
表5 各组KMH-2 细胞中PCNA、MMP-2 和MMP-9 蛋白表达水平Tab. 5 Expression levels of PCNA, MMP-2 and MMP-9 proteins in KMH-2 cells in various groups
*P<0.05 compared with blank control group; △P<0.05 compared with negative control group.
Group Blank control Negative control siRNA-TAK1 FP PCNA 0.43±0.08 0.45±0.09 0.21±0.05*△21.906<0.01 MMP-2 0.28±0.06 0.30±0.07 0.13±0.03*△19.287<0.01 MMP-9 0.33±0.05 0.34±0.06 0.15±0.04*△31.182<0.01
表6 各组KMH-2 细胞中p38 和p-p38 蛋白表达水平Tab.6 Expression levels of p38 and p-p38 proteins in KMH-2 cells in various groups
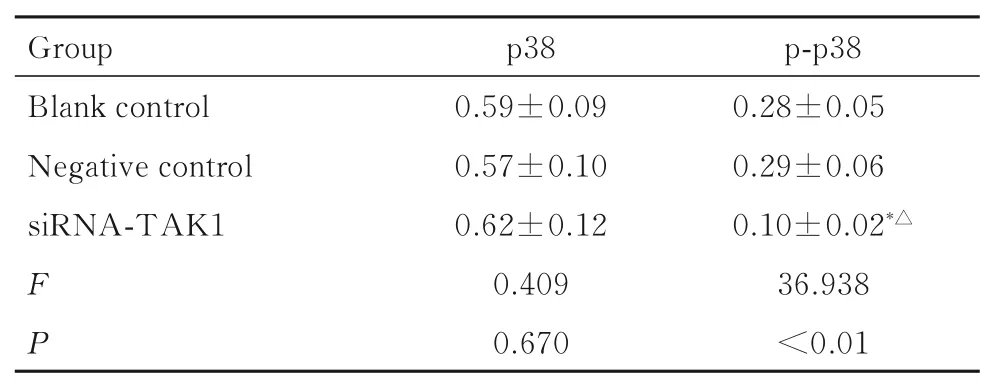
表6 各组KMH-2 细胞中p38 和p-p38 蛋白表达水平Tab.6 Expression levels of p38 and p-p38 proteins in KMH-2 cells in various groups
*P<0.05 compared with blank control group; △P<0.05 compared with negative control group.
Group Blank control Negative control siRNA-TAK1 FP p38 0.59±0.09 0.57±0.10 0.62±0.12 0.409 0.670 p-p38 0.28±0.05 0.29±0.06 0.10±0.02*△36.938<0.01
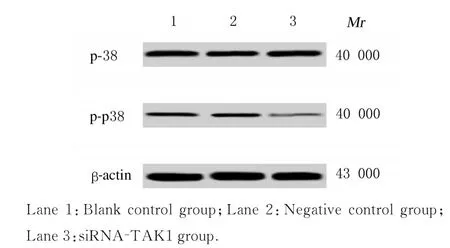
图6 Western blotting 法检测各组KMH-2 细胞中p38 和p-p38 蛋白表达电泳图Fig. 6 Electrophoregram of expressions of p38 and p-p38 proteins in KMH-2 cells in various groups detected by Western blotting method
RNA 干扰是利用激活siRNA,对靶基因产生特异性抑制作用[9],siRNA 通过“短发夹”形式整合到慢病毒载体,通过慢病毒载体感染细胞将siRNA 整合到细胞染色体中,发挥沉默目的基因的作用[10-11]。本研究采用siRNA 沉默甲状腺癌细胞中TAK1 表达,探讨下调TAK1 水平对甲状腺癌细胞的影响,结果显示:多种甲状腺癌细胞中TAK1呈高表达,siRNA 沉默可有效降低甲状腺癌细胞中TAK1 水平,抑制甲状腺癌细胞增殖和侵袭迁移,降低PCNA、MMP-2 和MMP-9 蛋白表达水平。TAK1 是在MAPK 信号通路研究中发现的苏氨酸/丝氨酸蛋白激酶,为MAP3K 家族成员之一,其可被转化生长因子β1 等细胞因子激活而得名。TAK1与炎症、应激和纤维化关系密切,在多种疾病中发挥重要作用。TAK1 在多种恶性肿瘤存在异常表达,在恶性肿瘤的发病中也发挥重要作用[12],TAK1 参 与 卵 巢 癌[13]、膀 胱 癌[14]和 结 直 肠 癌[15]等的发生发展过程。给予TAK1 抑制剂治疗对癌症具有治疗作用[16-17]。TAK1 抑制剂可抑制TAK1 表达,siRNA 干扰具有沉默TAK1 基因的作用,也可抑制TAK1 表达。本研究中通过沉默TAK1 抑制甲状腺癌细胞中TAK1 表达,进而抑制甲状腺癌细胞增殖和迁移。PCNA 水平升高表明细胞增殖能力增强。癌细胞的侵袭迁移与细胞外基质的降解关系密切,细胞外基质包括各种胶原、层黏连蛋白和明胶,细胞外基质降解主要依赖蛋白酶的水解作用,MMPs 家族中的MMP-2 和MMP-9 可以有效降解细胞外基质,在细胞的侵袭迁移中发挥重要作用,MMP-2 和MMP-9 表达是细胞侵袭迁移的关键,MMP-2 和MMP-9 水平降低表明细胞侵袭和迁移能力下降。本研究中下调甲状腺癌细胞中TAK1 表达水平也可抑制细胞中PCNA、MMP-2 和MMP-9 表达,进一步表明抑制TAK1 表达可抑制甲状腺癌细胞的增殖和迁移过程。由此可见,TAK1 在甲状腺癌细胞的增殖和侵袭迁移过程中具有重要作用,TAK1 有望成为甲状腺癌治疗的新靶点。
甲状腺癌细胞的增殖和迁移过程受多种信号通路的影响,多种信号通路的激活可促进甲状腺癌细胞的增殖和迁移过程。本研究结果显示:siRNA 沉默甲状腺癌细胞中TAK1 表达可抑制细胞p38 MAPK 信号通路的激活。p38 MAPK 信号通路是参与恶性肿瘤细胞增殖和迁移的主要信号通路之一,在恶性肿瘤中,抑制p38 MAPK 信号通路激活可抑制恶性肿瘤的增殖和迁移过程。p38 MAPK 信号通路在甲状腺癌的增殖、侵袭和迁移中也发挥重要作用,在甲状腺癌发生发展中,p38 MAPK 信号通路激活,抑制p38 MAPK 信号通路激活可抑制甲状腺癌细胞的增殖、侵袭和迁移[18-19]。TAK1 可通过多种信号通路发挥作用,TAK1 为MAPK 通路的上游调控分子,可通过激活p38 MAPK 信号通路参与炎症反应及恶性肿瘤的发生发展等过程[20],在乳腺癌细胞中,TAK1 可通过p38 MAPK 途径抑制乳腺癌细胞的迁移和侵袭能力[21];在肝癌细胞中,TAK1 可通过MAPK 信号通路增加肝癌细胞的放射敏感性[22]。结合上述研究,本研究结果表明:TAK1 通过p38 MAPK 信号通路参与甲状腺癌细胞的增殖、侵袭和迁移过程。本研究中,抑制甲状腺癌细胞中TAK1 表达可抑制p38 MAPK 信号通路的激活,表明TAK1 在甲状腺癌细胞中也可通过调控p38 MAPK 信号通路的活性发挥作用。
综上所述,TAK1 在甲状腺癌细胞中高表达,siRNA 沉默甲状腺癌细胞中TAK1 表达可能通过p38 MAPK 信号通路抑制甲状腺癌细胞的增殖、侵袭和迁移过程,TAK1 有望成为甲状腺癌治疗的新靶点。

