痰热清注射液对阻塞性睡眠呼吸暂停低通气综合征大鼠外周血T 淋巴细胞亚群的影响
薛 静, 刘志明, 吴永锋,董凯峰,王庆丰,祖金美,张海静,骆 彬,孔祥苓
(河北医科大学第一医院耳鼻咽喉头颈外科,河北 石家庄 050031)
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea-hypopnea syndrome,OSAHS)是一种常伴有睡眠结构紊乱、打鼾、频繁发生血氧饱和度下降和白天嗜睡等症状的疾病,由睡眠上气道塌陷阻塞引起呼吸暂停和通气不足[1]。OSAHS 容易引起组织器官缺血和缺氧,甚至导致多器官和系统功能不全或障碍,其发病机制复杂,至今尚未完全明确[2-3]。研究[4-5]表明:特征性的慢性间歇性低氧(chronic intermittent hypoxia,CIH)引起的氧化应激反应和机体炎症反应是OSAHS 的重要致病机制之一。OSAHS 属于中医学“嗜卧”范畴,证见脾虚湿困,常以燥湿化痰、开窍醒神为治疗原则[6]。痰热清注射液由黄芩、熊胆粉、山羊角、金银花和连翘组成,具有化痰、清热和扶正功效,目前临床常用于心肺疾病的治疗[7-8]。 目前国内外尚无痰热清注射液对OSAHS 患者T 淋巴细胞亚群影响方面的研究。本研究采用间歇低氧方法建立OSAHS 大鼠模型,观察痰热清注射液对OSAHS 模型大鼠T 淋巴细胞亚群和细胞炎症因子的影响,为阐明痰热清注射液治疗OSAHS 的作用机制提供依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器SPF 级雄性SD大鼠40 只,3 月龄,体质量(230±30)g,由河北医科大学实验动物中心提供,动物使用许可证号:SYXK(冀)2013-0023。大鼠适应性饲养1 周,饲养条件:室温26 ℃±2 ℃,相对湿度45%~55%,自由进水和摄食。 小鼠抗大鼠CD3+FITC、CD4+R-PE 和CD8+R-PE(美国Caltag 公司)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和白细胞介素6(interleukin- 6,IL-6)酶联免疫吸附实验(ELISA)检测试剂盒(美国TPI 公司)。痰热清注射液由上海凯宝药业股份有限公司提供,主要成分为黄芩、熊胆粉、山羊角、金银花和连翘,规 格 10 mL/支 ,国 药 准 字 Z20030054。FACSCanto Ⅱ流式细胞仪购自美国BD 公司,MR-96A 全自动酶标仪购自深圳迈瑞生物医疗电子股份有限公司。
1.2 OSAHS 动物模型的建立[9]造模大鼠置于间歇性低氧舱,循环给予氮气和氧气,每循环120 s充入氮气使舱内最低氧浓度为6%~8%,维持40 s(OSAHS 呼吸暂停所规定为10 s),缓慢充入氧气至21%,维持80 s,每天8 h。实验过程中舱内温度为19 ℃~22 ℃,湿度为38%~52%,产生的CO2和H2O 分别用钠石灰和无水氯化钙吸收。对照组大鼠同时置于相同规格的有机玻璃仓内,无缺氧处理过程。采集大鼠动脉血进行血气分析,作为模型建立成功的判断标准,模型大鼠最低血氧分压为37.5 mmHg,血氧饱和度为59.3%,符合人类OSAHS 的诊断标准。
1.3 实验动物分组及给药50 只雄性SD 大鼠随机分为对照组,模型组,低、中和高剂量痰热清注射液组,每组10 只。模型组,低、中和高剂量痰热清注射液组大鼠进行造模处理,造模第1 天开始,低、中和高剂量痰热清注射液组大鼠分别静脉注射给予0.9、1.8 和3.6 mL·kg-1痰热清注射液,大鼠给药剂量根据成人给药剂量按体表面积换算,大鼠每日等效剂量(g·kg-1) =6.3×成人每日剂量(g·kg-1)。对照组和模型组大鼠给予等量生理盐水灌胃。连续给药14 d。
1.4 大鼠胸腺指数和脾脏指数的测定大鼠取血后颈椎脱臼处死,无菌条件下取胸腺和脾脏,洗涤后用滤纸吸干,称质量,计算脏器指数:脏器指数=脏器质量(mg)/体质量(g)。
1.5 MTT 法检测大鼠脾脏T 淋巴细胞增殖活性取大鼠脾脏,制备脾细胞悬液,用含10%胎牛血清的RPMI 1640 完全培养液调整细胞浓度为1×108L-1的单细胞悬液,将细胞接种于24 孔细胞培养板内,加入经RPMI 1640 完全培养液配制的ConA(终浓度为5 mg·L-1),每个样品设3 复孔,5%CO2、37 ℃培养72 h,加入MTT,培养结束时弃上清加入二甲基亚砜(DMSO),振荡10 min,490 nm 处测定吸光度(A)值,以A 值表示大鼠脾脏T 淋巴细胞增殖活性。
1.6 流式细胞术检测大鼠外周血中不同T淋巴细胞亚群百分率各组大鼠于实验第15 天经腹主动脉收集肝素抗凝血液,4℃、3 000 r·min-1离心15 min 分离淋巴细胞,制备成密度为1×107mL-1的细胞悬液,分别取细胞悬液100 μL(含1×106个细胞),分别加入CD3、CD4 和CD8 抗体,4 ℃避光孵育15 min,加入PBS 缓冲液1 mL 洗涤5 min,置于2 500 r·min-1离心5 min,弃去上清液,于沉淀细胞内加入100 μL PBS 缓冲液,混匀,1 h 内采用流式细胞仪检测不同T 淋巴细胞亚群百分率。
1.7 ELISA 法 检 测 大 鼠 血 清 中TNF-α 和IL-6 水平大鼠腹主动脉采血后,分离血清,采用ELISA 法检测大鼠血清中TNF-α 和IL-6 水平,操作方法按照试剂盒说明书进行。
1.8 统计学分析采用SPSS 19.0 统计软件进行统计学分析。各组大鼠脾脏指数和胸腺指数,脾脏T 淋巴细胞增殖活性,外周血中CD4+T 淋巴细胞百分率、 CD8+T 淋巴细胞百分率和 CD4+/CD8+T 淋 巴 细 胞 比 值,血 清 中TNF-α 和IL-6 水平,均符合正态分布,均以表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD 检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组大鼠脾脏指数和胸腺指数与对照组比较,模型组大鼠脾脏指数和胸腺指数明显降低(P<0.05);与模型组比较,低、中和高剂量痰热清注射液组大鼠脾脏指数和胸腺指数明显升高(P<0.05);低、中和高剂量痰热清注射液组大鼠脾脏指数和胸腺指数组间比较差异无统计学意义(P>0.05)。见表1。
2.2 各组大鼠脾脏T 淋巴细胞增殖活性与对照组比较,模型组大鼠脾脏T 淋巴细胞增殖活性明显降低(P<0.05);与模型组比较,低、中和高剂量痰热清注射液组大鼠脾脏T 淋巴细胞增殖活性明显升高(P<0.05);与低剂量痰热清注射液组比较,高剂量痰热清注射液组大鼠脾脏T 淋巴细胞增殖活性明显升高(P<0.05)。见表2。
表1 各组大鼠脾脏指数和胸腺指数Tab. 1 Spleen indexes and thymus indexes of rats in various groups (n=10,)
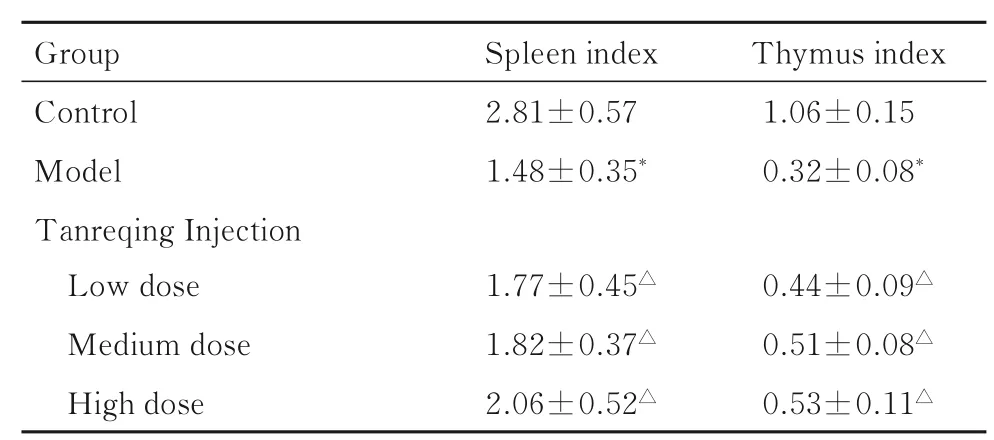
表1 各组大鼠脾脏指数和胸腺指数Tab. 1 Spleen indexes and thymus indexes of rats in various groups (n=10,)
*P<0.05 compared with control group;△P<0.05 compared with model group.
Group Control Model Tanreqing Injection Low dose Medium dose High dose Spleen index 2.81±0.57 1.48±0.35*Thymus index 1.06±0.15 0.32±0.08*0.44±0.09△0.51±0.08△0.53±0.11△1.77±0.45△1.82±0.37△2.06±0.52△
表2 各组大鼠脾脏T 淋巴细胞增殖活性Tab. 2 Proliferation activities of T lymphocytes of rats in various groups (n=10,)
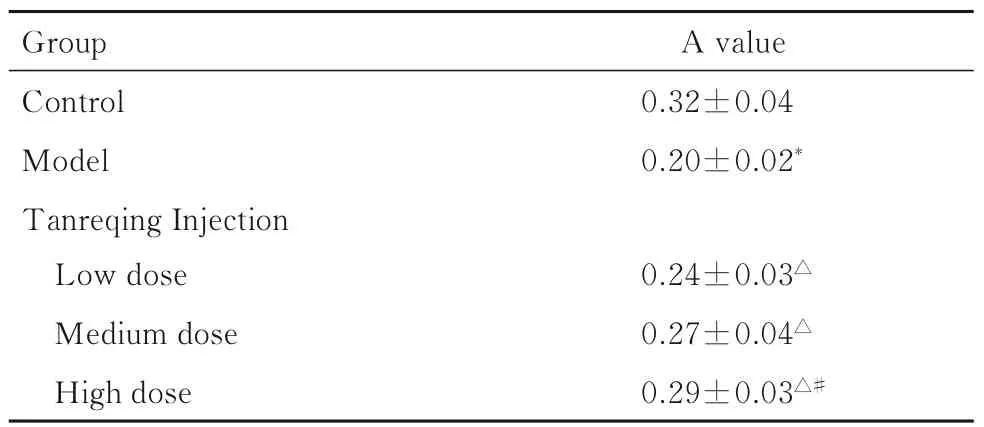
表2 各组大鼠脾脏T 淋巴细胞增殖活性Tab. 2 Proliferation activities of T lymphocytes of rats in various groups (n=10,)
*P<0.05 compared with control group;△P<0.05 compared with model group;#P<0.05 compared with low dose of Tanreqing Injection group.
Group Control Model Tanreqing Injection Low dose Medium dose High dose A value 0.32±0.04 0.20±0.02*0.24±0.03△0.27±0.04△0.29±0.03△#
2.3 各组大鼠外周血中不同T 淋巴细胞亚群百分率与对照组比较,模型组大鼠外周血中CD4+T 淋巴细胞百分率和CD4+/CD8+T 淋巴细胞比值明显降低(P<0.05),CD8+T 淋巴细胞百分率明显升高(P<0.05);与模型组比较,低、中和高剂量痰热清注射液组大鼠外周血中CD4+T 淋巴细胞百分率和CD4+/CD8+T 淋巴细胞比值明显升高(P<0.05),CD8+T 淋巴细胞百分率明显降低(P<0.05);低、中和高剂量痰热清注射液组大鼠外周血中不同T 淋巴细胞亚群百分率和CD4+/CD8+T 淋巴细胞比值组间比较差异无统计学意义(P>0.05)。见图1 和表3。
2.4 各组大鼠血清中TNF-α 和IL-6 水平与对照组比较,模型组大鼠血清中TNF-α 和IL-6 水平明显升高(P<0.05);与模型组比较,低、中和高剂量痰热清注射液组大鼠血清中TNF-α 和IL-6 水平明显降低(P<0.05);与低剂量痰热清注射液组比较,中和高剂量痰热清注射液组大鼠血清中TNF-α 和IL-6 水平明显降低(P<0.05)。见表4。
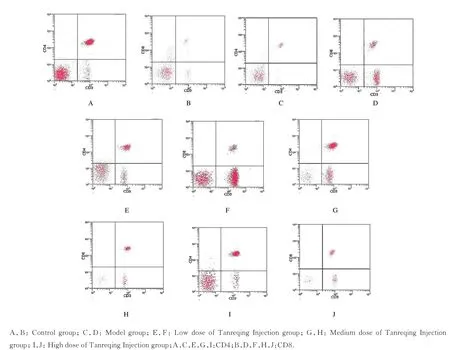
图1 各组大鼠不同T 淋巴细胞亚群流式散点图Fig.1 Flow scatter diagram of T lymphocyte subsets of rats in various groups

表3 各组大鼠外周血中不同T 淋巴细胞亚群百分率和CD4+/CD8+T 淋巴细胞比值Tab. 3 Percentages of different T lymphocyte subsets in peripheral blood and CD4+/CD8+T lymphocyte ratios of rats in various groups (n=10,x±s)
表4 各组大鼠血清中TNF-α 和IL-6 水平Tab.4 Levels of TNF-α and IL-6 in serum of rats in various groups [n=10,,ρB/(ng·L-1)]
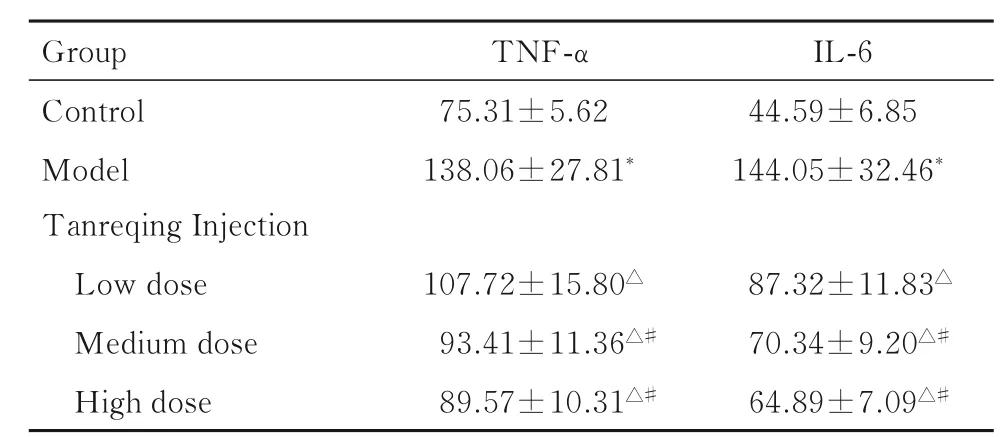
表4 各组大鼠血清中TNF-α 和IL-6 水平Tab.4 Levels of TNF-α and IL-6 in serum of rats in various groups [n=10,,ρB/(ng·L-1)]
*P<0.05 compared with control group;△P<0.05 compared with model group;#P<0.05 compared with low dose of Tanreqing Injection group.
Group Control Model Tanreqing Injection Low dose Medium dose High dose TNF-α 75.31±5.62 138.06±27.81*IL-6 44.59±6.85 144.05±32.46*87.32±11.83△70.34±9.20△#64.89±7.09△#107.72±15.80△93.41±11.36△#89.57±10.31△#
3 讨 论
OSAHS 最主要的3 个病理特征为间歇性低氧血症或高碳酸血症、上气道阻塞引起的胸腹式反常呼吸及缺氧时睡眠觉醒引起的睡眠结构的紊乱[10]。目前OSAHS 动物模型主要以上述特征为依据构建。本研究主要通过给予大鼠间歇低氧模拟OSAHS 睡眠中发生慢性低氧病理生理过程。本研究结果显示:模型组大鼠脾脏指数和胸腺指数降低,CD4+/CD8+比值降低,血清中TNF-α 和IL-6水平升高,说明间歇低氧可影响大鼠外周血T 淋巴细胞亚群,导致免疫功能异常,促进细胞炎性因子大量释放,严重损伤内皮细胞功能,与有关研究报道[11]结果一致。另有研究[12]表明:低氧低压处理14 d 对大鼠免疫功能的影响最为明显,同时14 d为痰热清注射液1 个疗程,因此本次实验采用连续14 d 给药。
胸腺是机体的中枢免疫器官,是淋巴细胞增殖的重要场所,而脾脏是机体的外周免疫器官,是T 淋巴细胞发挥免疫作用的场所。本研究结果显示:间歇性低氧处理导致大鼠胸腺和脾脏指数明显降低,表明其对机体造成免疫损伤;低、中和高剂量痰热清注射液组大鼠胸腺指数和脾脏指数升高,表明痰热清注射液对低氧所致的大鼠免疫功能异常有一定保护作用。T 淋巴细胞维持机体免疫功能,CD3 为T 淋巴细胞的标志,分为CD4+T 淋巴细胞亚群和CD8+T 淋巴细胞亚群,二者间互相协调[13-14],CD4+/CD8+T 淋 巴 细 胞 比 值 通 常 作 为 机体 免 疫 平 衡 的 评 价 指 标[15]。研 究[16-17]表 明:OSAHS 患者体内存在系统性炎症反应,与健康人比较,OSAHS 患者血清中TNF-α 和IL-6 水平明显升高。另有研究[18]显示:TNF-α 和IL-6 是介导患者白天嗜睡的细胞炎性因子。TNF-α 和IL-6 由单核-巨噬细胞、血管内皮细胞和平滑肌细胞等多种细胞产生,在炎症、宿主防御和组织损伤中有着广泛的体液和细胞免疫作用,两者均有促进动脉粥样硬化、引发胰岛素抵抗的作用,进而导致OSAHS患者机体各器官组织功能损害,发生OSAHS 相关性全身疾病[19-20]。
痰热清注射液是一种具有清热祛痰、驱邪扶正作用的中药制剂,目前临床上主要用于呼吸道疾病的治疗。研究[21]表明:痰热清注射液具有改善缺氧及二氧化碳潴留、降低慢性阻塞性肺疾病患者外周血炎症因子的作用。本研究结果显示:低、中和高剂量痰热清注射液组大鼠外周血中CD4+T 细胞百分率和CD4+/CD8+T 淋巴细胞比值升高,CD8+T 细 胞 百 分 率 降 低,血 清 中TNF-α 和IL-6 水平降低,表明痰热清注射液能够有效调节T 淋巴细胞亚群平衡,抑制细胞炎性因子分泌,与有关研究报道[22]一致。
综上所述,痰热清注射液治疗OSAHS 具有一定疗效,可通过调节T 淋巴细胞亚群平衡、抑制细胞炎性因子,进而改善大鼠的免疫功能。

