基于二氧化锰纳米片实现let-7a向癌细胞的可视化递送及其体外抗癌研究
杨强强,张广智,吴芳芳,范书华,于淑娴,洪 敏
(聊城大学 化学化工学院,山东 聊城 252059)
0 引言
目前,癌症成为导致人类死亡的主要疾病之一。迄今为止,尚未发现特别有效的治疗和预防方法。传统的癌症治疗主要以外科手术、放射性治疗及化学疗法为主,但存在不良反应,疗效不彰,无法根治等缺点。目前,对于攻克癌症,其治疗关键是早期诊断和精准化个性治疗。随着不少“癌基因”和“抑癌基因”的相继发现,肿瘤基因治疗前景乐观。基因检测(即分子靶标检测)是以研究疾病发生、发展过程中细胞分子生物学上的差异为基础,筛选和鉴定与疾病密切相关的蛋白质、核酸等生物大分子作为药物作用的靶点,通过靶向给药实现有效的靶向治疗及个体化精准医疗。肿瘤分子靶标的出现使得靶标基因药物能够针对癌细胞本身进行治疗,不会对正常细胞产生重大伤害,缓解患者病痛的同时更带给他们生的希望。自肿瘤基因治疗技术应用以来,治疗效果十分显著,得到了越来越多的癌症患者的认可,成为非常有前途的个体化治疗方法[1]。
MicroRNA是一类由内源基因编码的长度约为20-24个核苷酸的非编码单链小RNA,其参与多种重要细胞活动的调控,如细胞增殖、分化、凋亡等[2]。研究发现,miRNA的表达与多种癌症的发生、发展有关,其既可以充当抑癌基因(如microRNA-21)[3,4],又可以充当癌基因(如let-7a)[5,6]。通过基因技术,下调癌细胞内过表达的癌基因,或上调低表达的抑癌基因,都被证明能有效诱导癌细胞凋亡[7,8],因此,被认为是非常有潜在价值的癌症治疗方法。
目前制约基因疗法的主要问题是核酸序列的高效输送问题,传统方法主要是以病毒为载体进行输送,但由于病毒本身的毒副作用及潜在的免疫原性和致瘤性等问题,限制了其在该领域的应用。例如,以病毒为载体包裹 microRNA转染进入癌细胞,进行功能性缺失或恢复,研究上调或下调microRNA的表达对癌症的治疗作用[9]。该方法的优势是可以长期稳定恢复或降低 microRNA 的表达水平,沉默肿瘤中活化的靶向癌基因,从而起到治疗肿瘤的作用。但是该方法在杀伤肿瘤细胞的同时也会感染正常的细胞。同时,病毒载体转染进细胞时会随机插入正常宿主细胞 DNA,破坏一些基因信号通路,从而导致原癌基因活化。另外,因为外源病毒引入,还会诱发机体免疫反应,进而对机体的安全性产生较大影响[10]。因此,输送核酸药物的非病毒载体,主要包括脂质体、阳离子多聚体、碳纳米材料、以及金属纳米颗粒等,成为基因药物递送的更好选择[11]。为了促进该领域的发展,研究者们试图利用一些新颖材料来解决当前药物载体的一些不足,比如制备复杂、载药量低、容易泄露等问题。近年来,新开发的一种制备简单、低成本、低毒性的二维纳米材料——二氧化锰纳米片(MnO2nanosheets,MnO2NSs)[12],被人们广泛使用。一方面,其对单链 DNA或RNA具有很强的吸附能力;另一方面,吸附单链核酸的MnO2NSs能以胞吞的形式进入癌细胞,随后会被癌细胞中高表达的谷胱甘肽(GSH)降解为锰离子(Mn2+),将其表面吸附的DNA或RNA释放到细胞质中,从而实现对单链核酸的跨膜运输。除此之外,MnO2NSs还具有强的荧光淬灭能力,会使吸附到MnO2NSs上的核酸上修饰的荧光基团发生淬灭,而当MnO2NSs被GSH降解,核酸被释放出来后,荧光信号会重新恢复[13]。基于这种荧光信号从“关”到“开”的转变,可以实时监测负载核酸的MnO2NS探针的跨膜情况及核酸在细胞中的分布,而这些性质都为MnO2NSs用于疾病诊断和治疗提供了新的契机。
基于以上表述,本实验中,我们试图以MnO2NSs为载体,负载上5’端有荧光素(FAM)修饰的microRNA let-7a(FAM-let-7a),制备得到FAM-let-7a/MnO2NS探针,该探针以胞吞的形式进入癌细胞后,在癌细胞内高表达的GSH的作用下MnO2NSs降解为Mn2+,从而将其表面吸附的FAM-let-7a释放到细胞质中,同时探针上被淬灭的FAM的荧光会重新恢复。利用激光共聚焦荧光显微成像,根据实时观察到的荧光信号的变化,判断FAM-let-7a进细胞的情况。另外,作为抑癌基因,当癌细胞内的let-7a的表达被上调时,希望实现诱导癌细胞凋亡的目的。
1 实验部分
1.1 试剂与仪器
氯化锰四水合物(MnCl2·4H2O),四甲基氢氧化铵(TMA·OH),还原型谷胱甘肽(GSH),二甲基亚砜(DMSO),氯化钙溶液(1 M),氯化镁溶液(1 M),过氧化氢(H2O2,3 wt%),Tris-盐酸(Sigma-Aldrich购得),Tris-HCl 缓冲液(100 mM,25 mM MgCl ,5 mM CaCl2,pH 7.5),磷酸盐缓冲液(PBS,pH 7.4,136.7 mM NaCl,2.7 mM KCl,8.72 mM Na2HPO4,1.41 mM KH2PO4),细胞培养试剂和3-(4,5-二甲基-噻唑-2-基)-2,5-二苯基四唑溴化物(MTT)(定国生物科技有限公司),用超纯水制备所有水溶液,王水由体积比3:1的盐酸和硝酸混合而成。其它试剂均为市售分析纯试剂。
FAM-let-7a的序列:5’-FAM-UGAGGUAGUAGGUUGUAUAGUU-3’;
let-7a-RNA的序列:5’-UGAGGUAGUAGGUUGUAUAGUU-3’;
control-RNA的序列:5’-AUAAAUAGGAGGGGGUAGAAGG-3’.
JEM-2100 透射电子显微镜(JEOL有限公司、日本),90 Plus/BI-MAS 设备(美国),Zetasizer(莫尔文 Nano-Z,英国),Lambda750 紫外可见分光光度计(PerkinElmer,英国),F-7000 荧光光谱仪(日立,日本),LSM880 激光扫描共聚焦显微镜(蔡司,德国),ELX808 酶标仪(BioTek,美国)。
1.2 实验方法
1.2.1 合成MnO2NSs并进行表征。在 15 s内使 TMA·OH(0.6 M)和 H2O2(3 wt%)的混合物(20 mL)与 MnCl2·4H2O(10 mL,0.3 M)溶液反应,形成深棕色悬浮液后,将所得混合物在室温下搅拌约24 h,以2000 rpm离心10 min,用去离子水和甲醇洗涤,然后在-60 ℃下干燥。随后取10 mg干燥的粗产物,分散在20 mL去离子水中并超声处理10 h,最后将分散体系在2000 rpm下离心30 min,并将上清液用于实验中[13]。
1.2.2 荧光淬灭和恢复。将不同量的MnO2NSs溶液(最终浓度分别为0、14、28、35、42、48 μg/mL)与let-7a RNA溶液(最终浓度为100 mM)混合,最后加入 Tris-HCl 缓冲液配置成200 μL的试样。30 min后,记录样品的荧光强度。对于荧光恢复实验,不同浓度的GSH(0、2、4、6、8、10、15 mM)与FAM-let-7a/MnO2NS探针(MnO2NSs:48 μg/mL;FAM-let-7a:100 nM)混合,最后加入 Tris-HCl 缓冲液配置成200 μL的样品,静置5 min,然后测定各体系的荧光强度(激发波长:488 nm)。
1.2.3 纳米探针的制备。FAM-let-7a/MnO2NS探针:取220 μL DEPC水加入到FAM-let-7a(1 OD) 中,溶解混匀。之后,将FAM-let-7a(最终浓度为200 nM)加入到包含MnO2NSs(最终浓度为84 μg/mL)的Tris-HCl 缓冲溶液中,放置30 min后,即得 FAM-let-7a/MnO2NS探针母液,将其储存在4 ℃条件下备用。let-7a-RNA/MnO2NS或control-RNA/MnO2NS探针:方法同上,得到的探针母液中RNA的最终浓度为200 nM,MnO2NSs最终浓度为84 μg/mL。
1.2.4 细胞培养。人宫颈癌细胞(HeLa),人肝癌细胞(HepG2)、人乳腺癌细胞(MCF-7)用Dulbecco’s modified Eagle 的培养基(DMEM GIBCO)在培养瓶中培养,并加入 10% 胎牛血清、青霉素(100 μg/mL)和链霉素(100 μg/mL),在含5%二氧化碳、37 ℃湿润的环境中培养。用细胞计数器测定细胞数量。
1.2.5 HeLa、HepG2、MCF-7细胞中进行 FAM-let-7a/MnO2NS探针的原位成像。 将癌细胞(0.4 mL,1×106细胞/mL) 接种在20 mm共聚焦培养皿中培养 24 h,然后将一定量的FAM-let-7a/MnO2NS探针母液加入到每个培养皿中,使探针中MnO2NS的浓度保持在30 μg/mL。之后,细胞在 37 °C 条件下继续孵育 4 h后,除去培养基,用PBS溶液冲洗两遍后,再加入一定量的PBS,随后用激光共聚焦显微镜进行检测成像,激发波长为488 nm。
1.2.6 细胞的存活率研究。将三种不同的细胞(包括HepG2、MCF-7以及HeLa 细胞)分别接种在 96 孔板(1×105细胞/孔)中培养24 h,然后将细胞与相同浓度的纳米探针一起孵育不同时间(24、36、48 和 72 h)或与不同浓度的纳米探针孵育72 h。处理后,除去培养基,并将制备的 MTT(0.5 mg/mL)加入孔中.在 37 ℃下孵育 4 h后,除去培养基,并向每个孔中加入 100 μL 二甲基亚砜。然后,在室温下振荡细胞板 10 min,以溶解由活细胞形成的晶体,之后使用酶标仪在 490 nm 处测量每个孔的吸光度。 通过(ATest/AControl)× 100 计算相对细胞存活率。
2 结果与讨论
2.1 实验原理
5’端有荧光分子FAM修饰的 FAM-let-7a会通过物理吸附直接结合到 MnO2NSs的表面,此时FAM的荧光信号会被淬灭,体系处于“turn-off”的状态,形成的FAM-let-7a/MnO2NS探针,随后利用MnO2NSs能够以胞吞的形式进入细胞,而将 FAM-let-7a输送入细胞中。进入肿瘤细胞后,在 GSH的作用下,MnO2NSs降解成Mn2+,同时结合在MnO2NSs上的FAM-let-7a被释放出来,之前被淬灭的FAM荧光信号恢复(turn-on),利用激光共聚焦荧光显微镜观察该荧光信号,可以实现对细胞内这一过程的原位监测及荧光成像分析(如图1所示)。由于FAM-let-7a在大多数癌细胞中都扮演抑癌基因的角色,而我们这里的设计就相当于上调了癌细胞中的这种抑癌基因,从而进一步诱导癌细胞走向凋。
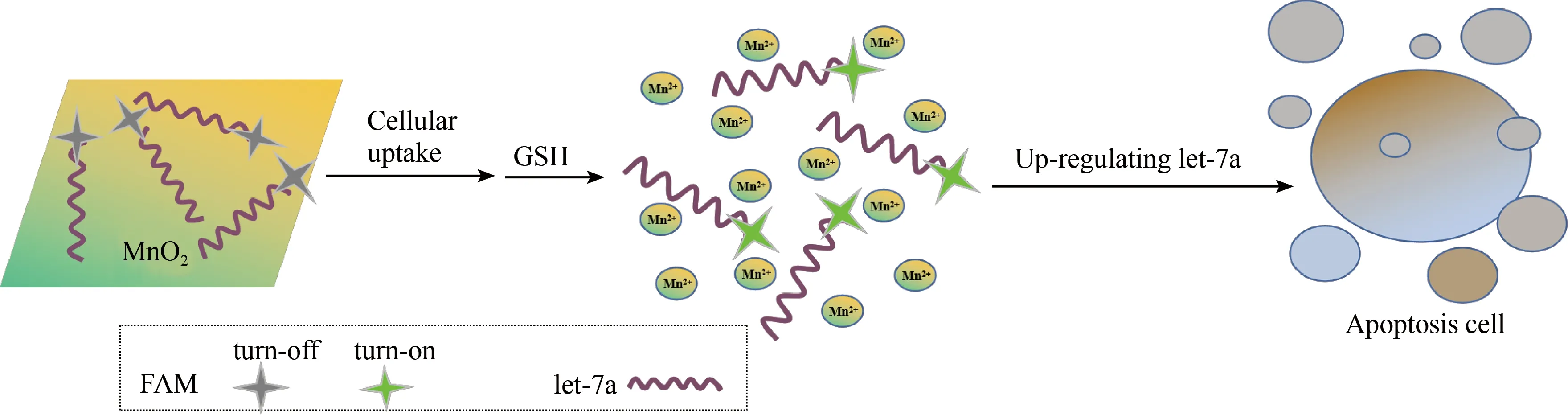
图1 FAM-let-7a/MnO2 NS探针进细胞,释放 FAM-let-7a及上调癌细胞内let-7a表达诱导癌细胞凋亡示意图
2.2 二氧化锰纳米片表征
TEM测试结果表明,MnO2NSs显示二维片状薄纱样结构(如图 2(a) 所示),但在其用于载体制备FAM-let-7a/MnO2NS探针前,会利用超声对MnO2NSs进行充分破碎,以利于其进入细胞。此外,MnO2NSs的 UV-vis 光谱约在 370 nm 处显示出最大吸收峰(如图 2(b)所示),这些实验结果均与文献报道一致[14],进而表明MnO2NSs被成功地制备出来。
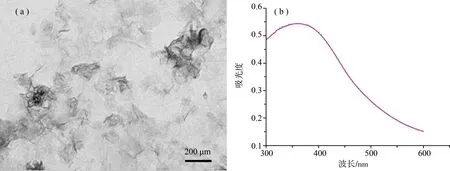
图2 (a) 二氧化锰纳米片透视电子显微镜图像;(b) 二氧化锰纳米片UV-vis光谱图
2.3 荧光淬灭和恢复
向FAM-let-7a溶液中各加入不同量的MnO2NSs,FAM-let-7a的浓度固定在100 nM,而MnO2NS的浓度依次增加(0、14、28、35、42、48 μg/mL),混合30 min,依据荧光淬灭强度来评估制备的MnO2NSs对FAM-let-7a的吸附效果。在不存在MnO2NSs的时候,如果以488 nm为激发波长,FAM-let-7a上修饰的FAM会在525 nm处有特征荧光发射,结果表明,随着MnO2NSs浓度的增加,FAM的荧光强度逐渐降低,当MnO2NSs在42 μg/mL 浓度下完全淬灭FAM的荧光(如图3(a)),我们认为,在此MnO2NSs浓度下能够完全有效吸附FAM-let-7a,因此,为保证探针溶液中,FAM-let-7a被有效吸附到MnO2NSs上,后续制备成的FAM-let-7a/MnO2NS探针母液中,FAM-let-7a和MnO2NSs的比例为100 nM:42 μg/mL。
另外,当向完全淬灭的FAM-let-7a/MnO2NS探针中添加不同浓度的GSH(0、2、4、6、8、10、15 mM)时,随着GSH浓度的增大,更多的MnO2NSs被降解,FAM标记的FAM-let-7a被释放出来,FAM的荧光逐步恢复,体系中的荧光强度逐渐增强(如图3(b)所示),从而证实MnO2NSs可以被 GSH 有效降解.但与没有被MnO2NSs吸附的相同浓度FAM-let-7a的荧光强度相比,FAM的荧光并没有完全恢复,这可能是由于MnO2NSs的吸附会影响FAM的荧光效率造成的[13]。
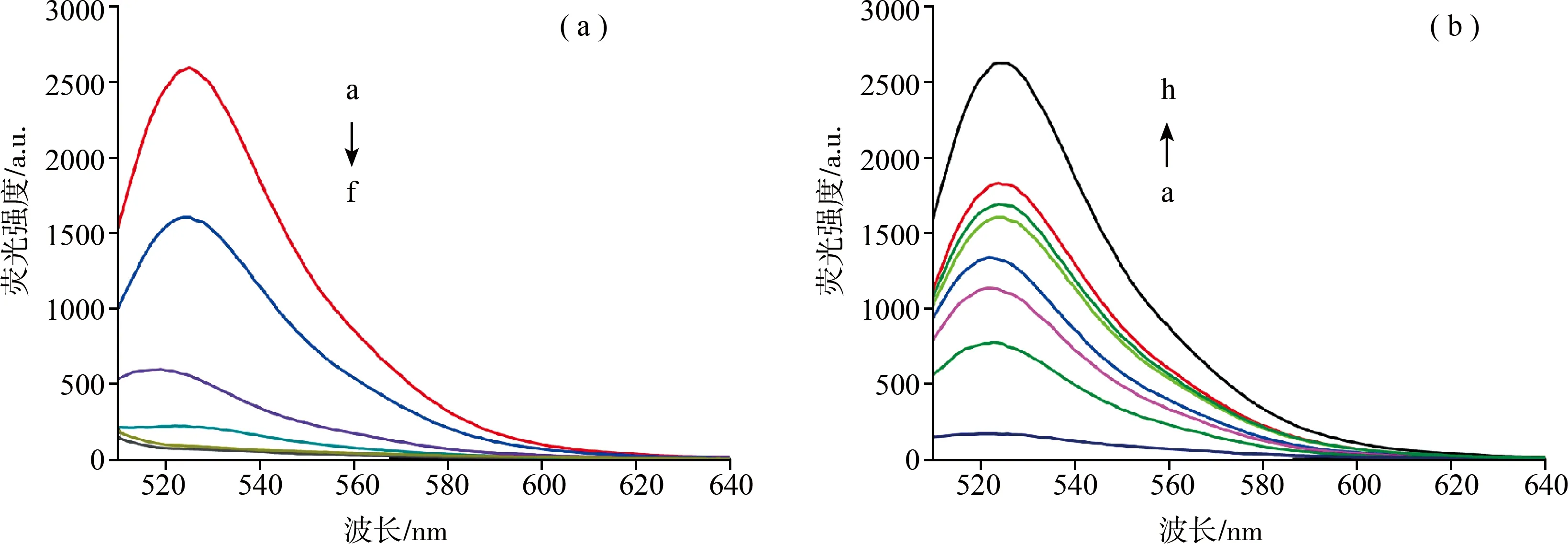
图3 (a) MnO2 NSs吸附FAM-let-7a荧光淬灭图(a-f MnO2 NSs浓度逐渐增加);(b) 在GSH作用下FAM-let-7a/MnO2 NS探针的荧光恢复图(a-g GSH浓度逐渐增加,h100 mM单纯的FAM-let-7a)
2.4 细胞内荧光成像
接下来我们希望实现FAM-let-7a/MnO2NS探针在癌细胞内原位成像,选择了人宫颈癌细胞HeLa、人肝癌细胞HepG2、及人乳腺癌细胞MCF-7作为研究对象。FAM-let-7a/MnO2NS 纳米探针通过内吞作用进入细胞,细胞内所含的 GSH 会使 MnO2NSs 降解,FAM标记的FAM-let-7a 将从 MnO2NSs上释放,因此荧光恢复。为了获得最佳成像效果,将细胞与探针一起孵育4 h后观察细胞。在 HeLa、HepG2、MCF-7细胞中可以清楚地观察到荧光信号(如图4),从而证明在这里研究的三种癌细胞中的GSH能有效的将MnO2NSs 降解,使得被负载的FAM-let-7a释放到细胞质中。其中HeLa细胞给出的荧光图清楚表明这种荧光体系在细胞质中的分布,而对于不同的细胞类型,荧光信号分布则有一些差异(如MCF-7),但整体显示,运送的FAM-let-7a都进入了细胞质中。
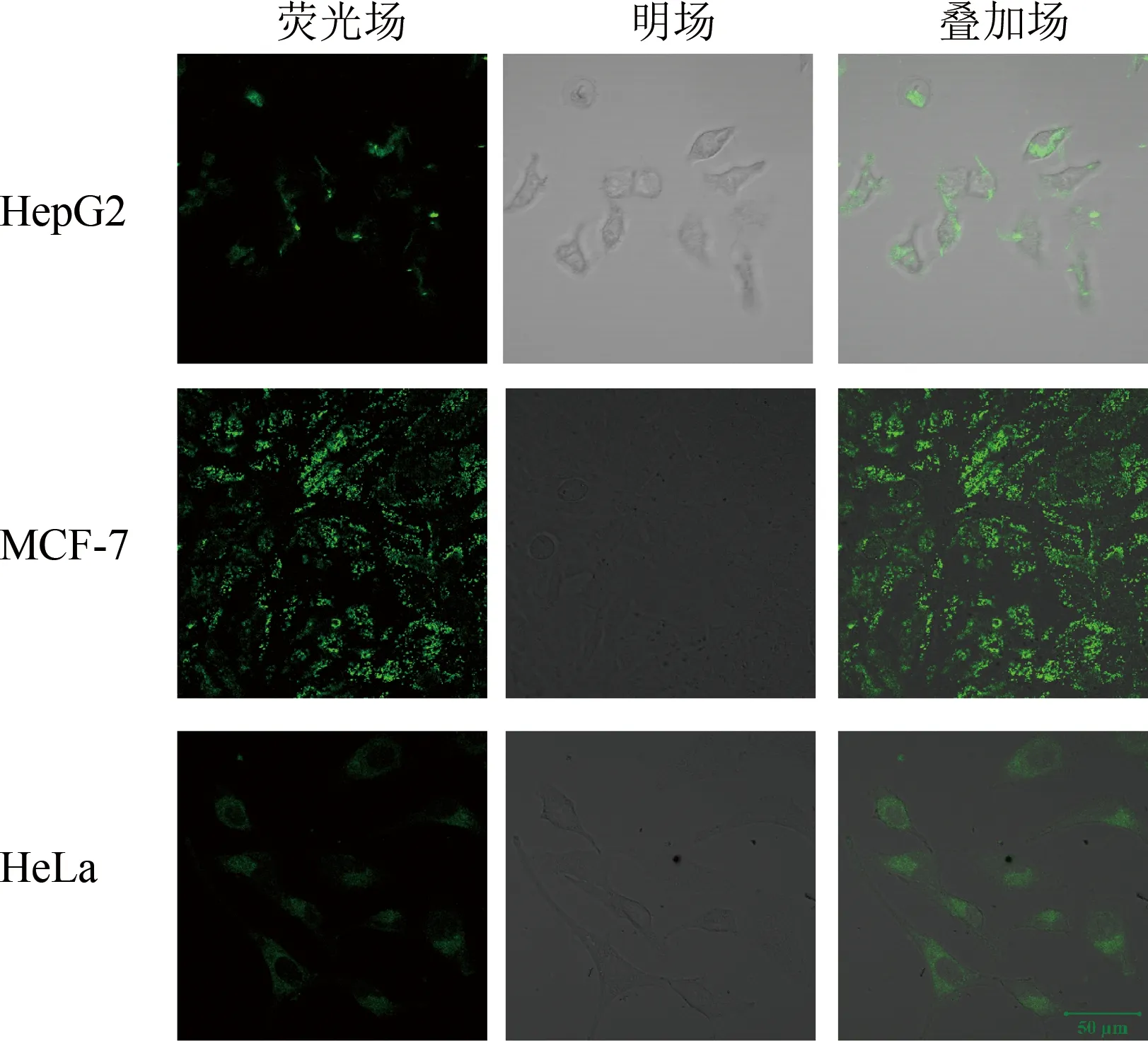
图4 与 FAM-let-7a/MnO2NS探针一起孵育后HepG2、MCF-7、HeLa细胞的共聚焦图像
2.5 细胞的存活率
microRNA let-7a在癌细胞中起到抑制其增殖的作用,在之前的很多工作中都得到了证实[15-17]。相对于正常细胞而言,在大部分癌细胞中,let-7a都是低表达的[4],而通过基因转染的方法往癌细胞中人为输送进一定量的let-7a,也就相当于上调let-7a在癌细胞中的表达,应该能够达到诱导癌细胞凋亡的目的[18]。例如陈杰课题组[19]报道了一个胆固醇包裹let-7a模拟物转染进细胞的工作,以人肝癌细胞为研究对象,结果表明,通过该方法上调let-7a的表达后有效抑制了癌细胞的增殖,体内实验证明胆固醇包裹let-7a模拟物可以明显抑制肝癌移植瘤的生长和转移。
鉴于此,我们希望这里用到的FAM-let-7a/MnO2NS探针可通过上调抑癌基因let-7a的表达来达到诱导癌细胞凋亡的目的。为了评估这种效应,一定浓度的let-7a-RNA/MnO2NS探针与三种癌细胞作用不同时间(24、36、48、72 h),然后使用MTT 法测定癌细胞的存活率。研究表明,let-7a/MnO2NS复合物对不同癌细胞的存活率具有明显的时间依赖性影响。作用时间越久,细胞的存活率越低(如图5A、B、C),72 h后,三种癌细胞的存活率都降到60%以下,HepG2细胞的存活率甚至降到50%左右.这些结果与之前的报道吻合,例如,陈杰等人研究了胆固醇包裹let-7a对肝癌细胞的抑制作用,与HepG2细胞作用5 D后,细胞存活率下降到了37.7%[19]。另外,Takahashi等人进行的体外细胞实验也证明,提高A549细胞中let-7a的含量可以有效抑制其增殖[20]。
作为对照,我们将与let-7a有相同长度的任意序列的Control-RNA结合到MnO2NSs上,得到了Control-RNA/MnO2NS探针。按照同样的实验操作,测定结果表明相同浓度的Control-RNA/MnO2NS探针对癌细胞增殖的影响明显小于let-7a-RNA/MnO2NS探针。
另外,我们还测定了不同浓度的MnO2NSs及Control-RNA/MnO2NS探针与HeLa细胞作用72 h后对HeLa细胞存活率的影响。MTT实验结果表明,当MnO2NSs的浓度低于40 μg/mL时,HeLa细胞与其作用72 h后其生存率仍能保持在90%以上,而我们这里用到的MnO2NSs(20 μg/mL)的浓度处在这个范围内。这些结果都充分证明let-7a-RNA/MnO2NS探针通过上调癌细胞中let-7a的含量,对癌细胞的增殖起抑制作用,而非由于MnO2NSs自身的细胞毒活性。
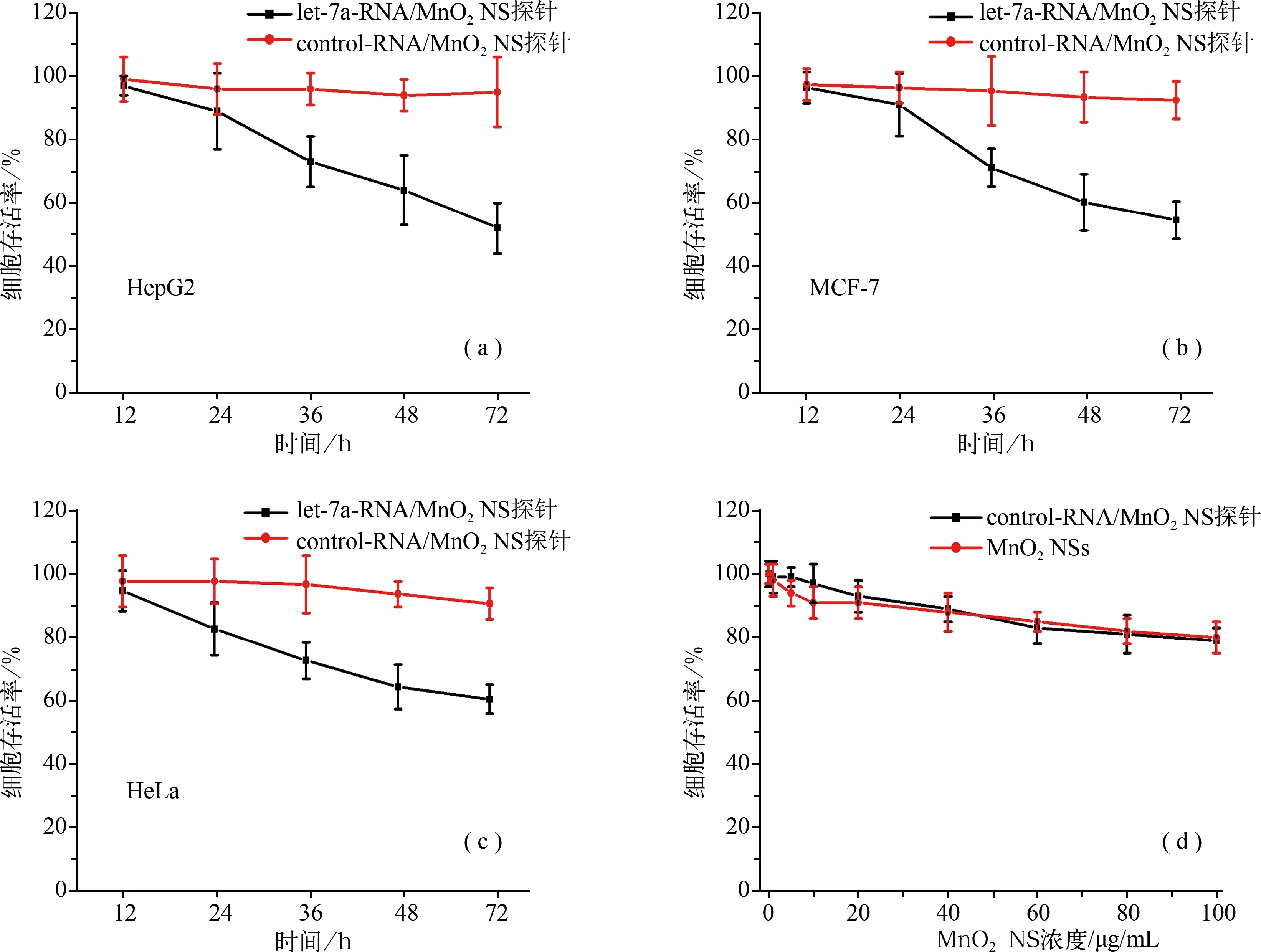
图5 let-7a-RNA/MnO2 NS探针与不同细胞作用不同时间后细胞的存活率(MnO2 NSs的浓度为20 μg/mL)(a)HepG2细胞;(b) MCF-7细胞;(c) HeLa细胞;(d)不同浓度的MnO2 NSs及control-RNA/MnO2NS探针与HeLa细胞孵育72 h后的的细胞存活率
3 结论
本实验中,通过MnO2NSs负载着 FAM-let-7a 进入癌细胞,在癌细胞内高表达的GSH的作用下,MnO2NSs发生降解,FAM-let-7a 被释放到细胞质中。根据细胞内FAM荧光信号的恢复情况通过激光共聚焦荧光成像实现了对这一过程的原位监测。同时,通过上调抑癌基因let-7a的方式实现了有效诱导癌细胞凋亡的目的。

