南海北部潮间带自由生活线虫的生物量及生物多样性初步研究
乔春艳,郝映东,陆 洋,黄 勇
(聊城大学 生命科学学院,山东 聊城 252059)
0 引言
南海,国际上称南中国海,是位于中国大陆南部与菲律宾群岛、加里曼丹岛、苏门答腊岛、马来半岛和中南半岛之间的太平洋边缘海,由广东南澳岛至台湾岛南端鹅銮鼻的连线使其与东海分界。南海为世界第三大陆缘海,仅次于南太平洋的珊瑚海和印度洋的阿拉伯海,面积约356万km2,约等于渤海、黄海和东海总面积的3倍,其中属于中国管辖范围的是九段线之内的210万km2左右的海域。地处热带和亚热带地区,海域广阔,生物多样性丰富。小型底栖动物是海洋碎屑食物链中重要的中间环节,不仅是幼年鱼、虾和蟹的饵料[1],调节着微生物的生产过程,同时还是有机碎屑和初级生产力以及水底-耦合的重要环节。近年来小型底栖动物作为海洋生态环境监测和生态系统健康评价的一个重要指标,已被普遍运用于海洋环境监测中[2]。
自由生活海洋线虫是海洋中种类多、数量大、分布广,分类较为困难的小型底栖动物中最优势的类群。世界上估计的海洋线虫超过 2 万余种,目前报道的种类只有 7000 种,而我国海域鉴定到种的只有500种。自由生活海洋线虫耐污染、耐低氧、适应性强,在大多数生境,它们是底栖环境中数量最丰富的类群,占后生动物数量的 70%-90%,在某些生境中可达到 90%以上[3]。通常每平方米的软底沉积物中含有上百万条的线虫,有时高达四百多万条。它们以其特有的生殖对策,在水层-底栖生态系统的能量转换中,在摄食和刺激微生物的生产方面具有全球性的效应[4];是国际底栖生态学家重点研究的对象之一,也是当今世界深海和极端环境生命过程研究的热点类群。其多样性指数和群落分布格局可作为监测底栖环境的工具[5]。由于种种原因,我国有关海洋线虫方面的研究相对滞后,至今还缺乏我国海洋线虫的基本数据,不清楚我国海洋线虫的种类资源和多样性情况,特别是有关南海线虫的分类学研究更是薄弱。同时对南海北部潮间带小型底栖动物多样性和自由生活海洋线虫的分类鉴定缺少系统整体的研究。
本研究选取南海北部潮间带4个典型站位作为研究样点,初步分析了南海潮间带自由生活线虫的种类组成和多样性特征。随着海洋强国和二十一世纪海上丝绸之路战略的实施,海洋战略地位更加突出,海洋经济地位加速提升。加强海洋科学研究,查清海洋生物资源底数,提高保护开发和利用海洋的能力,对建设海洋强国具有重大的战略意义和现实意义。
1 材料与方法
1.1 调查海域
2019年1月在南海北部沿岸潮间带(北纬22°2′至22°23′,东经113°24′至113°59′)选取4个典型站位(泥质、砂质、泥沙质、红树林),采集未受扰动的沉积物样品(图1)。使用改造后的内径为2.6 cm的注射器取样,取样深度为8 cm,每个样芯按0-2 cm、2-5 cm、5-8 cm(或0-2 cm、2-8 cm)分层装入100 mL已编号的采样瓶,加入等量的10%海水福尔马林溶液以固定样品[6-9],在每一个站位采集3-5个平行样品。另外,刮取表层沉积物,标记后装瓶存放,作为该站位的补充。
1.2 研究方法
在实验室,将样品用0.1% 虎红溶液染色24 h,倒入500 μm和42 μm叠加放置的网筛内,用自来水反复冲洗。用比重为1.15的Ludox-TM对截留的沉积物样品进行离心[10]。将上清液冲去Ludox-TM后转移到培养皿上,重复操作三次,解剖镜下分选[11,12],将小型底栖生物各类群分别保存在盛有5%福尔马林溶液的青霉素瓶中。将线虫置于盛有5%甘油,5%纯乙醇,90%纯水[13]的细胞培养皿中放在干燥箱两周,制成永久装片,观察、测量和绘图在微分干涉显微镜下进行[14]。根据 Lorenzen(1981)[15]建立的线虫的分类系统和相关文献,进行线虫的分类鉴定至分类实体或种的水平[5,16,17]。
1.3 数据分析
通过分选获得4个典型站位小型底栖动物各类群的个体数量,利用Excel对这些数据进行计算分析,得出小型底栖动物各类群的丰度、生物量、生产量等,并作图示意。使用PRIMER 6.0进行海洋线虫丰度的CLUSTER等级聚类分析和MDS分析,并对其进行多样性分析,如物种丰富度指数(d)、香农-威纳多样性指数(H′)、均匀度指数(J′)和优势度指数(D)[18]。
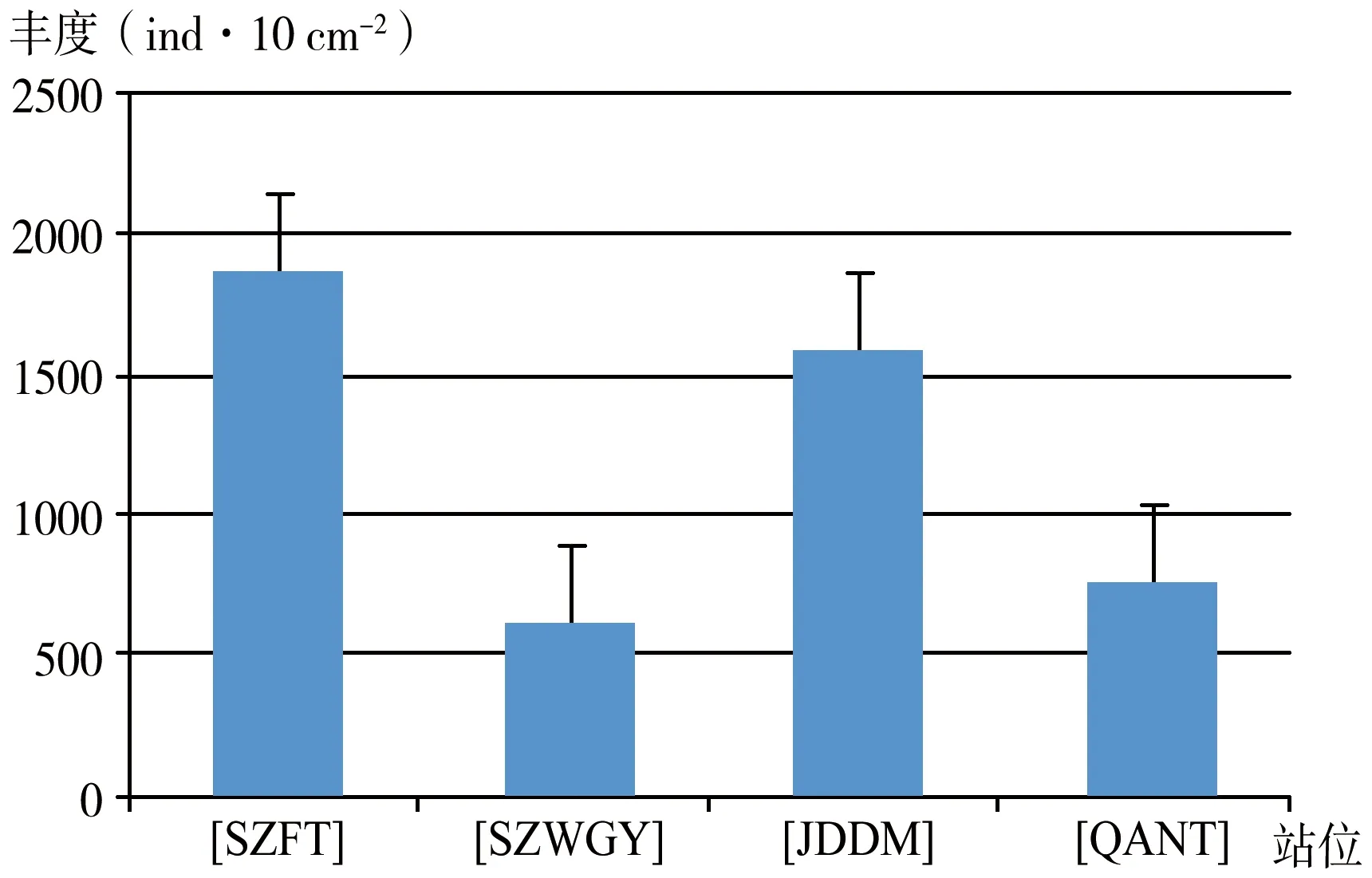
图2 南海北部潮间带4个站位自由生活线虫丰度的柱状图
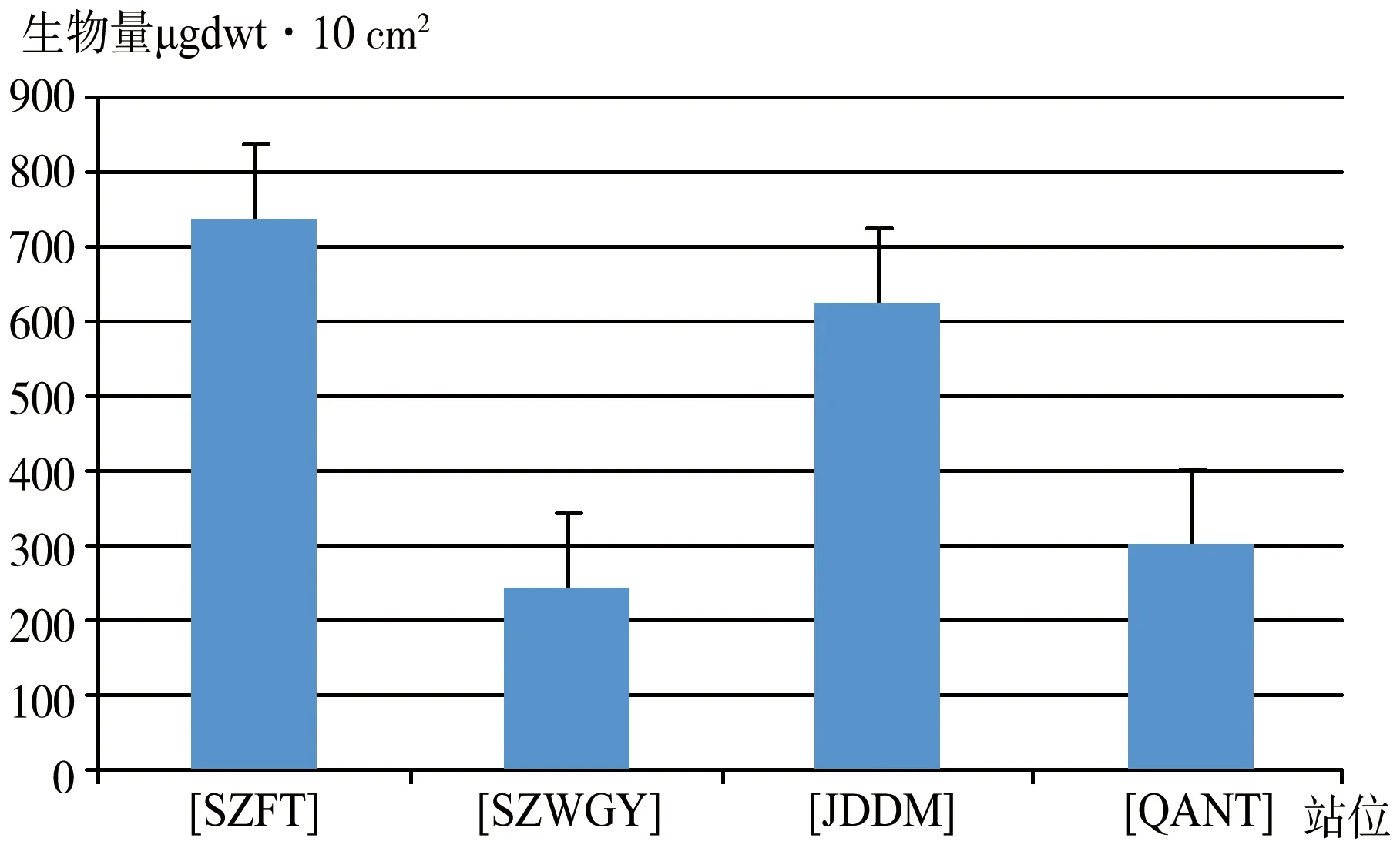
图3 南海北部潮间带4个站位自由生活线虫生物量的柱状图
2 研究结果
2.1 自由生活线虫的丰度、生物量和生产量
2019年1月南海北部潮间带4个站位的线虫的平均丰度为1217±479(ind·10 cm-2),占小型底栖动物总丰度的96.6%。自由生活线虫的丰度在小型底栖动物中占绝对优势,故其分布趋势与小型底栖动物丰度的分布趋势一致[9]。线虫丰度最高值为SZFT站,为1871±1079(ind·10 cm-2);丰度最低值在SZWGY站,为624±17(ind·10 cm-2),JDDM站和QANT站的平均丰度居中,分别为1595.7±726.7(ind·10 cm-2)和775.4±235(ind·10 cm-2)(图2)。4个站位线虫的平均生物量为487±192(μgdwt·10 cm-2),自由生活线虫的生物量是由其丰度乘以经验系数0.4 g·ind所得,因而其分布趋势与丰度完全相同(图3)。
4个站位线虫的平均生产量为4379.6 ±1725.2(μg·10 cm-2·a-1)。
2.2 线虫群落的营养结构
Wieser(1953)[19]将线虫分为四种功能类群,不同的口腔结构代表了不同的摄食机制(图4)。1A型代表选择性沉积食性者,1B型代表非选择性沉积食性者,2A型代表为刮食者,2B型代表捕食者。本研究中,以1B型优势度最高,有31种,占总物种数的54.4%;2A型优势度次之,有18种,占31.6%;1A型6种,2B型2种,分别占10.5%和3.5%(图5)。按个体数量统计,1B型优势度仍最高,占线虫总数的63%;2A型优势度次之,占34.1%;1A型和2B型最低,分别占1.8%和1.1%。
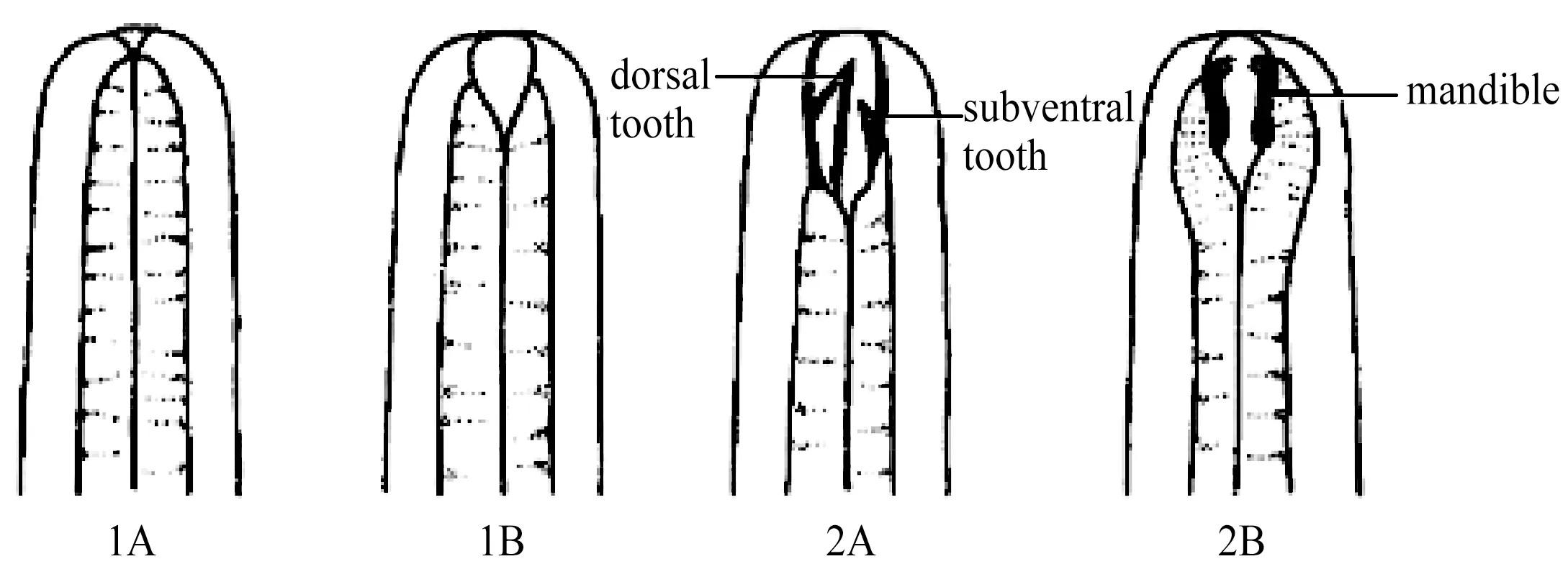
图4 常见海洋线虫四种摄食类型口腔结构示意图(引自Warwick et al.1998)
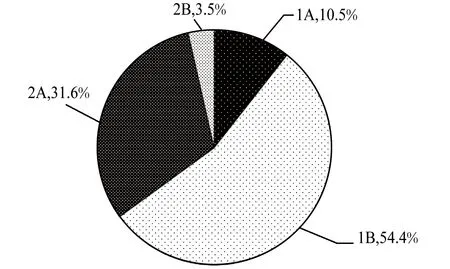
图5 南海北部潮间带4个站位线虫四种摄食类型种类数目百分比
2.3 线虫群落的年龄结构和性别比例
成熟雌体具有卵细胞或发育良好的卵巢且雌孔可见,成熟雄体具有交接刺,幼体指无明显雌性和雄性特征的个体。本研究对线虫群落中成熟雌体、成熟雄体和幼体的数目进行统计,得到线虫群落的年龄结构和性别比例。4个典型站位线虫群落中雌雄比平均为1.42:1,幼体所占比为13.3%-30.7%,平均值为20.2%(表1)。另外统计了雌体、雄体以及幼体所占比(图6)。

表1 南海北部潮间带4个站位线虫性别比例表
2.4 种类组成
对4个站位沉积物样品进行分析,共鉴定出了自由生活线虫57种,隶属于34个属,19科,3目,其中包括2个新种(LeptolaimusholovachoviQiao,Jia & Huang,2020[20],Daptonemabrevicaudatussp.Nov.[21])。4个站位中排名前8位的优势种依次为SteineriaampullaceaWieser & Hopper,1967、TheristuspertenuisBresslau & Schuurmans Stekhoven,1935、PseudolellamajorWang & Huang,2016、Parodontophorasp2、Daptonemaalternum(Wieser,1956) Lorenzen,1977、Paragnomoxyalamacrostoma(Huang & Xu,2013) Sun & Huang,2017、Parodontophorasp1、Pseudolellasp3、Theristussp3。
属水平上的统计显示,Steineria属是本研究海域最为优势的属,个体数量占4个站位线虫总数的18.18%,其次为Daptonema属,占线虫总数的17.33%,其它优势属(个体数量大于线虫总数的2%)依次为属Theristus、Parodontophora、Pseudolella、Paragnomoxyala、Oncholaimus、Leptolaimus、Pseudochromadora。Xyalidae和Axonolaimidae为第一和第二大科,分别占线虫总数的57.48%和25.71%,其他优势科(个体数量大于线虫总数的1%)依次为Oncholaimidae、Leptolaimidae和Desmodoridae等(表2)。
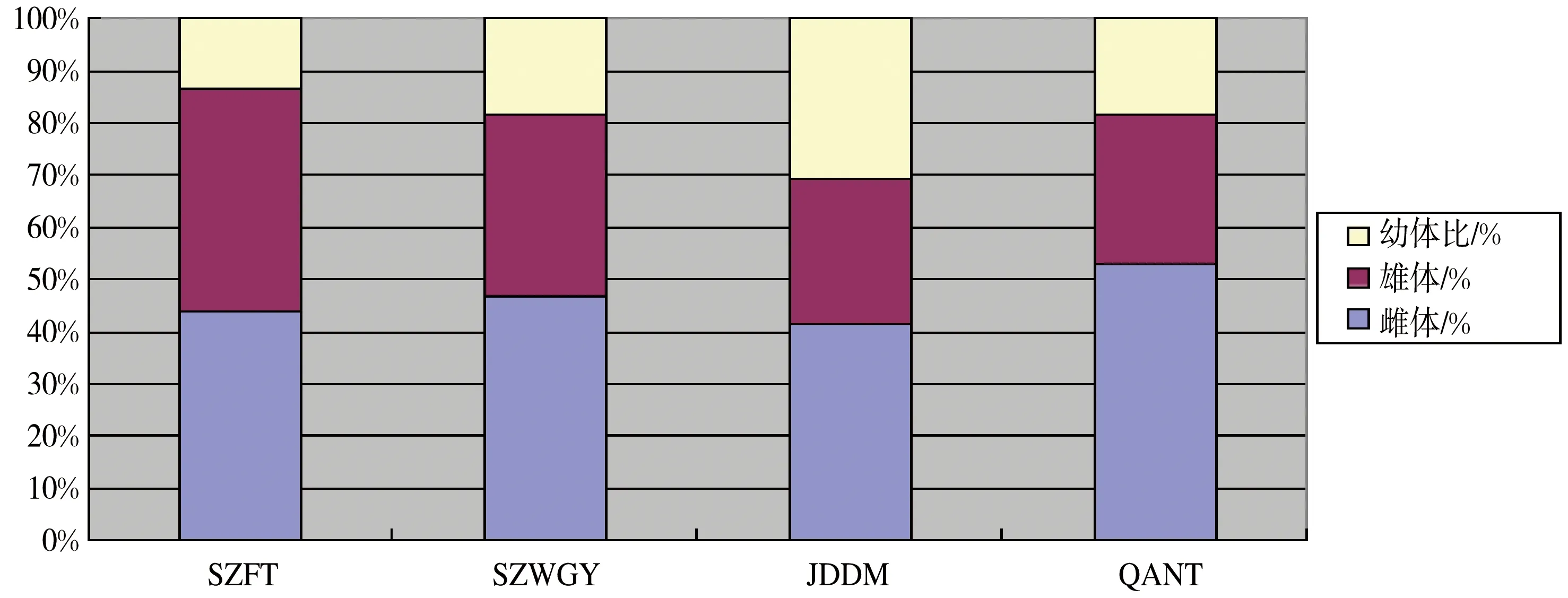
图6 南海北部潮间带4个站位线虫雌雄比和幼体比柱状图
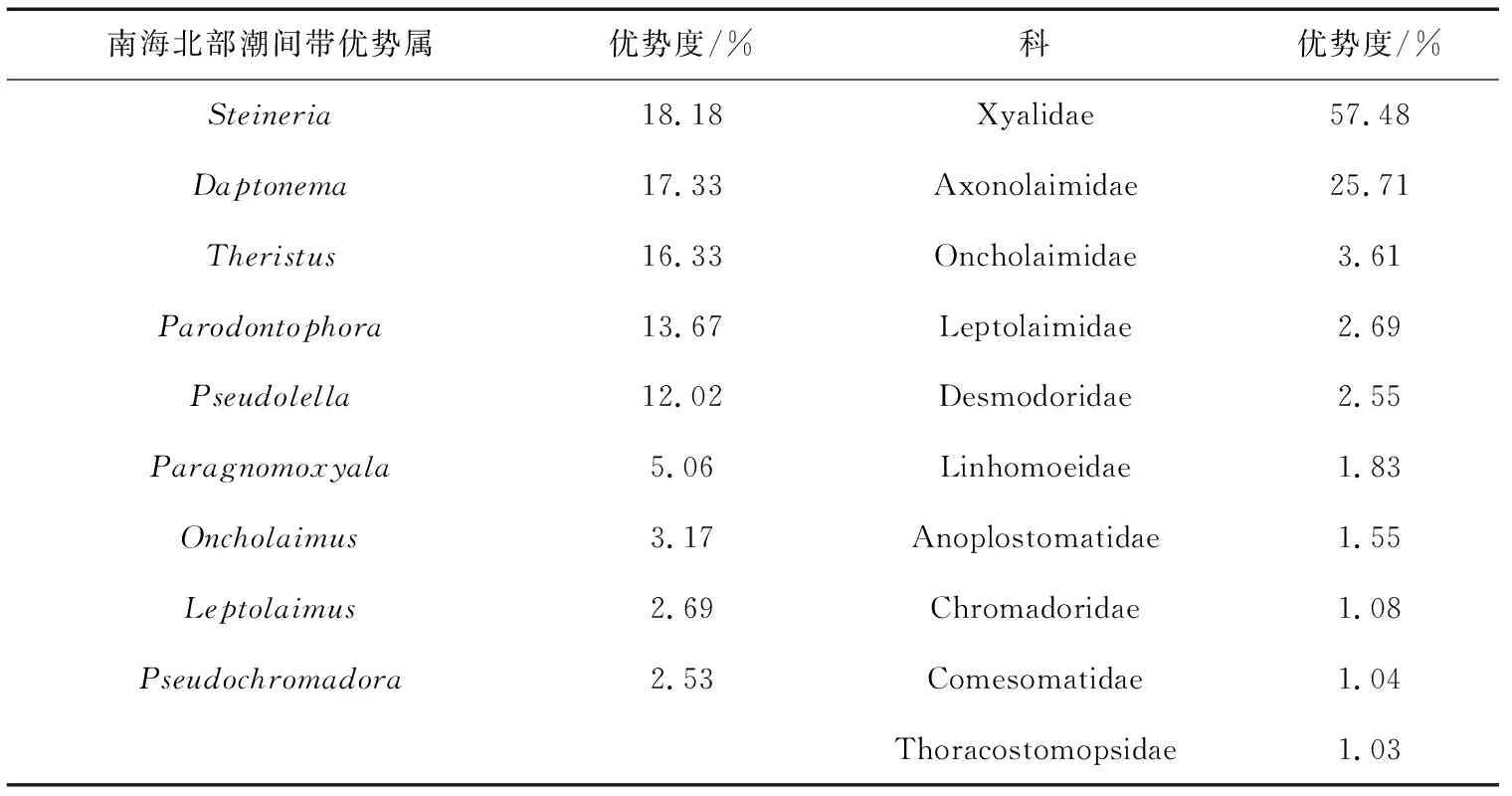
表2 南海北部潮间带优势属和优势科及其优势度
2.5 自由生活线虫丰度的CLUSTER等级聚类分析
利用PRIMER 6.0对南海北部潮间带4个典型站位进行自由生活线虫丰度的CLUSTER等级聚类分析(图7)。在40%相似水平上,主要分为三组,组1包括JDDM站,JDDM站属于砂质的沉积物类型;组2包括SZWGY站位于深圳湾公园观鸟亭附近,沉积物类型为泥质;组3包括SZFT站和QANT站,SZFT站位于深圳福田红树林保护区,红树林生长于陆地与海洋交界滩涂浅滩,是陆地向海洋过度的一种特殊的生态系统,QANT站位于淇澳岛,属于泥沙质的沉积物类型,且人类活动频繁,有机质污染程度较高。
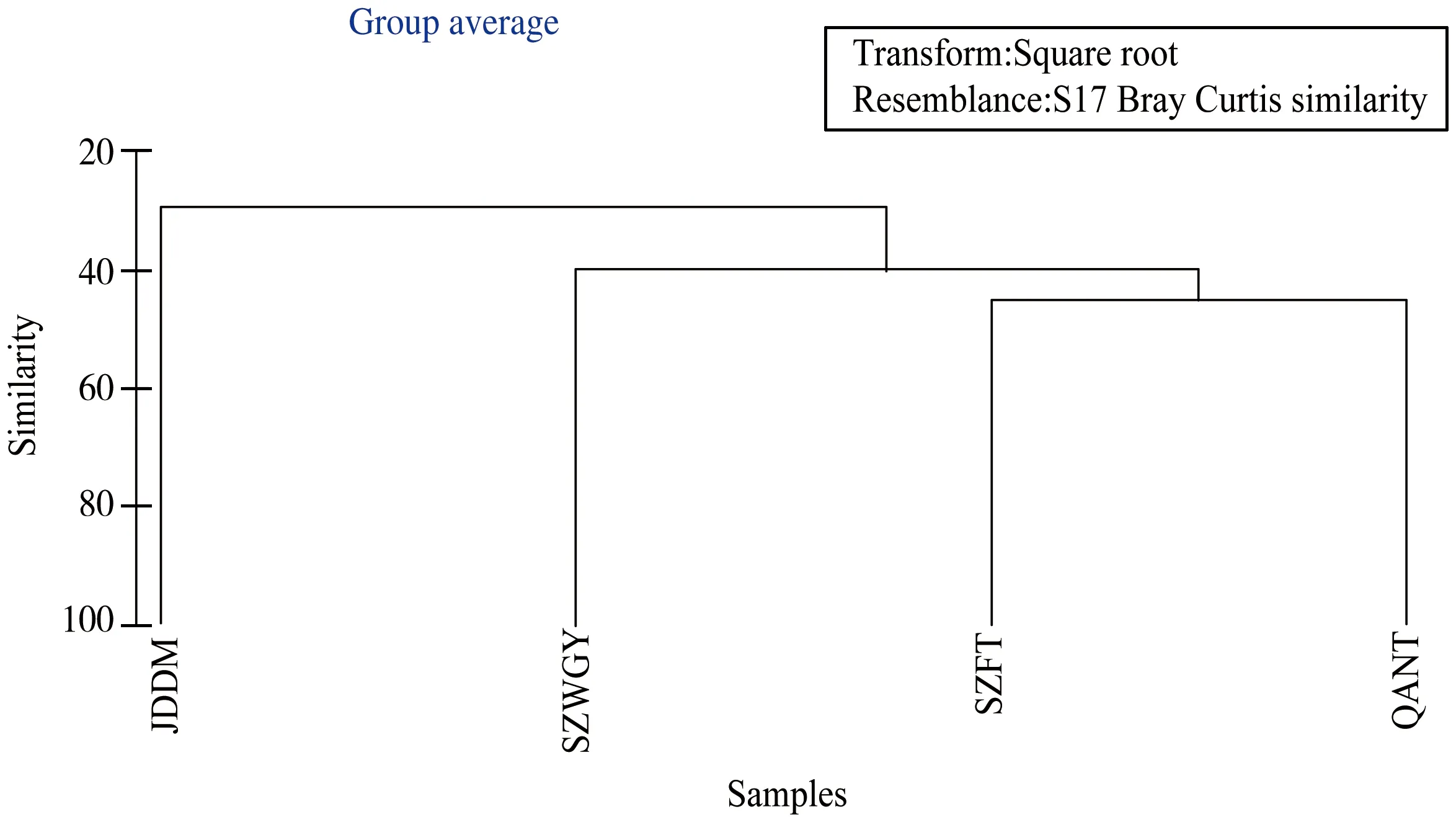
图7 南海北部潮间带线虫丰度的CLUSTER等级聚类分析
2.6 线虫的非度量多维标度(non-metric Multi-Dimensional Scaling,MDS)分析
对线虫进行了丰度的CLUSTER等级聚类分析后,接着进行了线虫的非度量多维标度(MDS)分析(图8),结果与CLUSTER等级聚类分析结果一致,由图8可知,SZFT站和QANT站更相似,SZWGY站和JDDM站与以上两个站位的相似性较低。
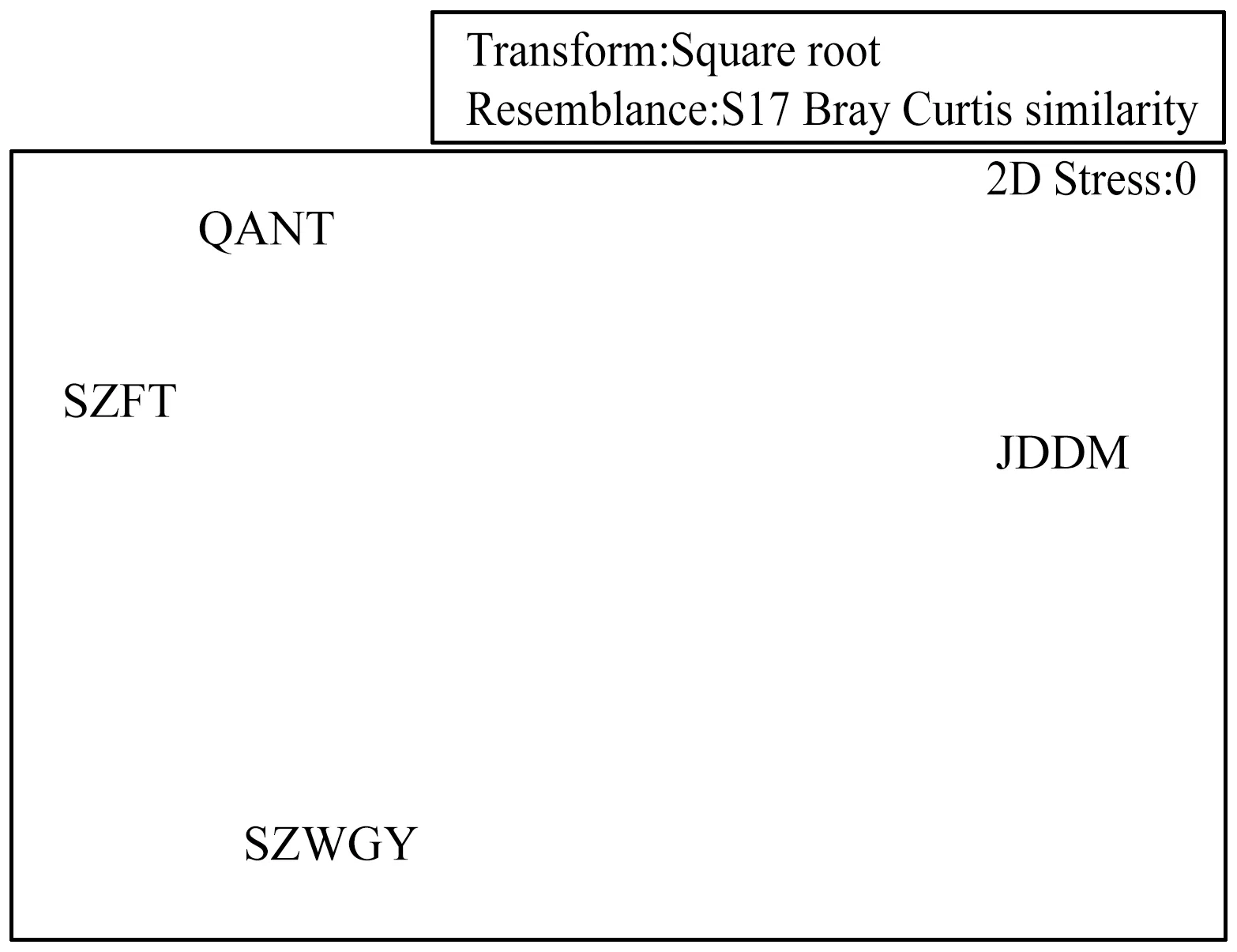
图8 南海北部潮间带线虫的非度量多维标度(MDS)分析
2.7 自由生活线虫群落多样性分析
通过PRIMER 6.0对4个站位自由生活线虫群落多样性进行了分析(表3),结果表明,物种丰富度指数与线虫种类数基本一致,QANT站物种丰富度指数最高,为6.819,JDDM站最低,为4.529,但SZFT站和SZWGY站相反,SZFT站种类数多,物种丰富度指数较低。香农-威纳指数从高到低依次为QANT站(3.279)、SZWGY站(2.981)、JDDM站(2.966)和SZFT站(2.899)。均匀度指数介于0.8443-0.9103之间,物种分布均匀,说明南海北部潮间带自由生活线虫稳定性强。该海域自由生活线虫群落优势度指数较低,介于0.0485-0.0766之间,物种丰富度指数较高,在4.529-6.819之间,具有低优势度和较高多样性的特点。
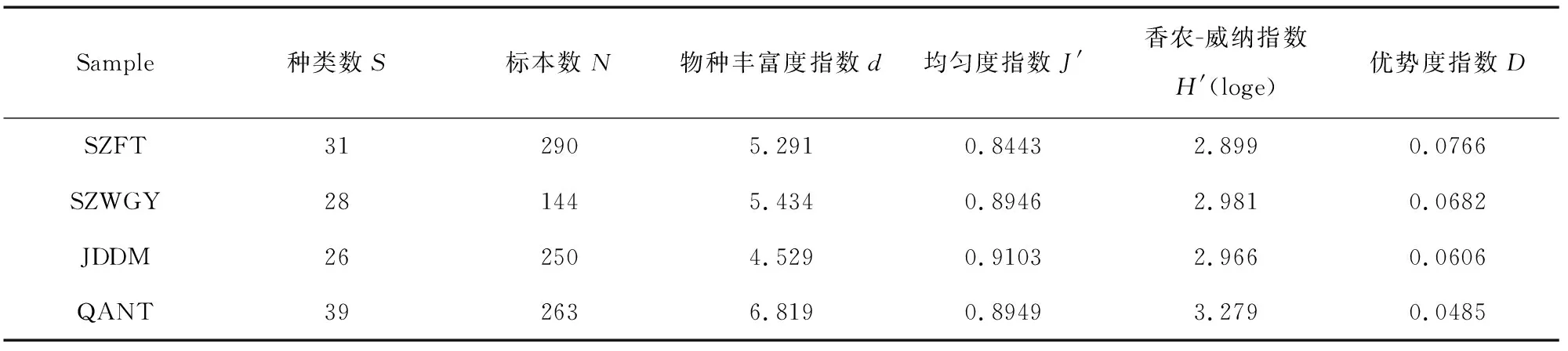
表3 南海北部潮间带线虫群落多样性指数
3 结论与分析
在丰度上自由生活线虫是小型底栖生物中最优势的类群,与王家栋等[24]中国近海秋季开展的研究结果一致。SZFT站和SZWGY站均位于深圳湾,与2017年谭文娟等[25]和2020年郭玉清等[30]深圳湾福田红树林区研究相比,所选采样区域相同,站位相近,从丰度上分析,SZFT站和SZWGY站海洋线虫的平均丰度百分比为97.4%,谭文娟等研究为97.26%,郭玉清等研究为97.28%;从生物量上分析,SZFT站和SZWGY站线虫的平均生物量百分比为65.6%,谭文娟等研究为71.58%,这与谭文娟等结果相近,郭玉清等研究未涉及线虫生物量的分析。
与2014年刘晓收等[23]南海北部深海自由生活线虫的研究比较(表4),本研究中潮间带海洋线虫的平均丰度要远高于南海北部深海,且高于南海其他有关研究[22,24,26-30],这可能与采样季节、站位和网筛孔径有关。自由生活线虫始终在小型底栖动物中占据最优势地位。
本研究对海洋线虫物种数和个体数进行了统计,根据物种数或是个体数,4种食物类型的线虫比例的顺序都是一致的:1B型最多,2A型次之,1A型和2B型最少。
综上,沉积食性者(1A+1B)无论是在物种数(64.9%)还是个体数(64.8%)上均最占优势。线虫群落的营养结构与食物类型密切相关,本研究中沉积食性者最占优势且以有机碎屑为食,故推测有机碎屑是南海北部潮间带冬季的主要食物来源。
蔡立哲等[28]、王家栋等[24]、郭玉清等[30-32]和唐玲等[26,27]对南海近海和浅海的小型底栖动物生态学进行了研究,另外,刘晓收等[23]对南海北部深海小型底栖动物丰度和生物量等进行了分析,而分类方面尤其是海洋线虫分类鉴定的研究相对较少。本研究对南海北部潮间带冬季沉积物样品进行分析,4个站位共鉴定出了57个种或分类实体,由于自由生活线虫分类难度较大,加之分类资料缺乏,分类经验不足,目前真正鉴定到种的只有十余种。因此,自由生活海洋线虫的分类鉴定仍然是我国小型底栖生物研究的重要基础性工作。
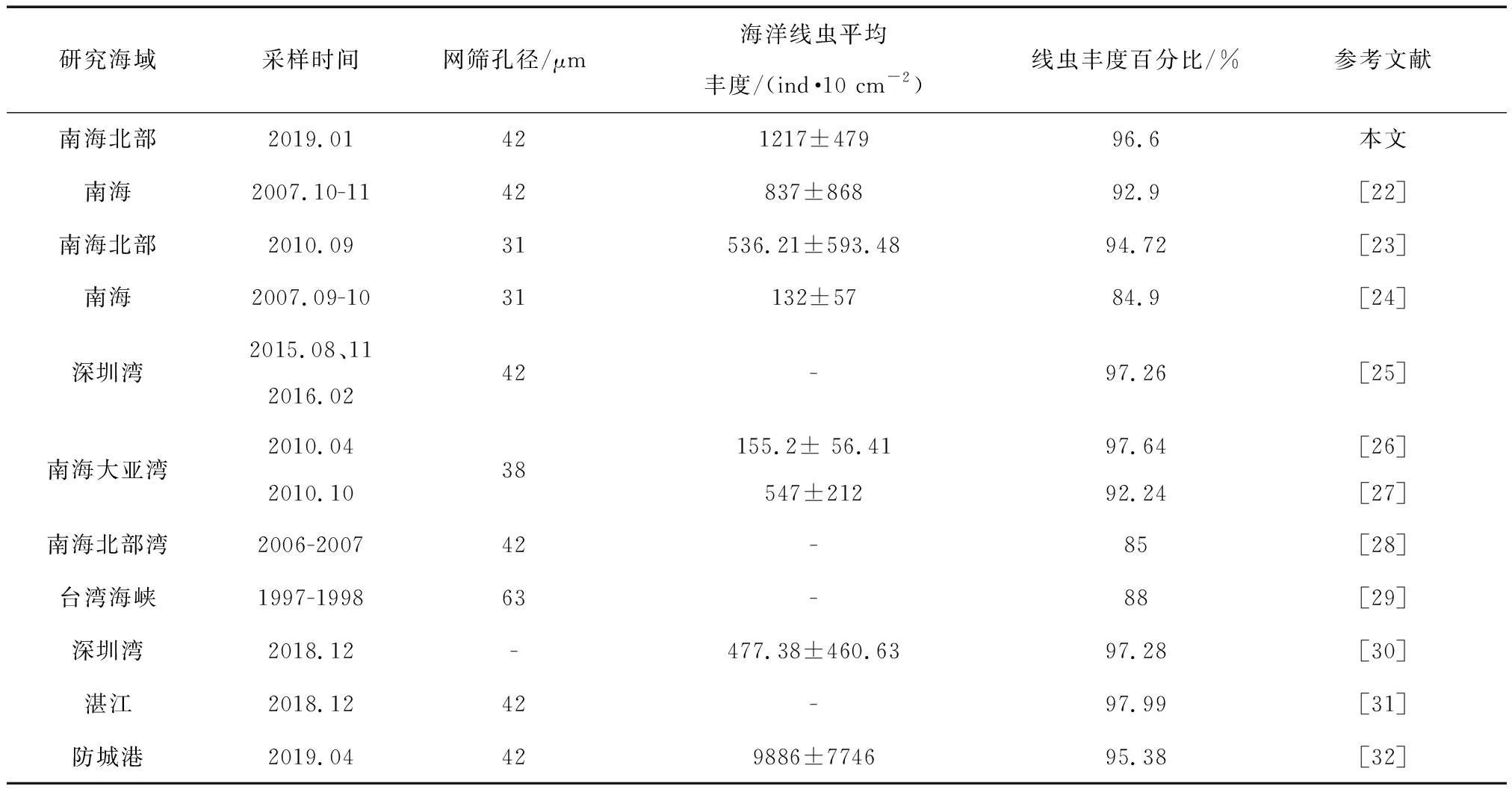
表4 本文研究与相关研究对照表
本研究利用PRIMER 6.0对4个典型站位自由生活线虫进行了丰度的CLUSTER等级聚类分析、非度量多维标度(MDS)分析以及群落多样性分析,结果表明,SZFT站和QANT站更相似,SZWGY站和JDDM站与以上两个站位的相似性较低,南海北部潮间带自由生活线虫群落稳定性较强,具有低优势度和较高多样性的特点。
致谢本研究中样品采集得到聊城大学贾素素同学的帮助,自由生活线虫丰度的CLUSTER等级聚类分析、非度量多维标度(MDS)分析以及群落多样性分析得到中国海洋大学赵美红同学的帮助,在此表示衷心感谢!

