Anti-HER2免疫脂质体的制备及其靶向特异性的检测1
崔 潇,马亚平,张亚柯,李 英,张芳霞,王 瑞
(聊城大学 药学院, 山东 聊城 252059)
0 引言
纳米医学具有提高药物功效、降低毒性、优化药物特性、递送生物大分子药物和克服肿瘤驱动的免疫抑制信号等独特特征[1],在解决诸如单克隆抗体等生物制剂的缺点方面具有巨大潜力[2]。脂质体作为第一类获得临床批准用于癌症治疗的治疗性纳米粒,因其良好的生物相容性、高效的给药途径和保护抗体不被降解的能力而备受关注。脂质体已被证明是能使多种药物有效传递到靶细胞的载体[3],药物与脂质体结合可以显著改善药物的药代动力学,使药物毒性降低和治疗效果提高[4,5],因此脂质体制剂在抗肿瘤药物传递方面具有广阔的发展前景。据报道,聚乙二醇(PEG)通过被动靶向机制以及增强的渗透性和保留EPR效应自发积累在实体肿瘤中[6],因此脂质体的表面可以用柔性的亲水性聚合物如聚乙二醇(PEG)进行改性,从而克服传统脂质体在网状内皮系统(RES)中被快速清除的缺点。
在纳米医学领域,主动靶向是克服低选择性和全身毒性,提高治疗效果的重要策略[7,8]。具有可控和靶向功能的药物传递装置可以理想地将高剂量的治疗剂特异性地传递给病变细胞,减少对健康细胞的干扰,从而产生预期的药代动力学和生物分布,达到更高的治疗效果和更少的副作用。人们对各种先进的靶向策略的开发有持续的兴趣,其中配体偶联的纳米颗粒[9](包括软纳米颗粒如胶束和脂质体,固体纳米颗粒如可生物降解聚合物)可能是各种靶向中最有前景的聚合物纳米粒子,能够将疏水性药物溶解在聚合物基体中[10,11],解决药物溶解性问题,同时具有稳定性高、药物负载效率高、药物持续释放、血液循环时间延长、癌细胞靶向空间活跃等优点[12]。
HER2(人表皮生长因子受体-2)是一种185 KD跨膜糖蛋白,具有胞内酪氨酸激酶结构域和胞外配体结合域,参与细胞分化等重要阶段。HER2作为一个细胞存活的关键基因,过表达可导致恶性肿瘤进展与乳腺癌、卵巢癌、胃癌、前列腺癌的预后不良[13]。大约25%的乳腺癌中存在HER2的过度表达,由于其具有耐药性,导致曲妥珠抗体直接使用临床疗效不佳[14],而空间稳定的脂质体可以增加血液循环时间,通过抗体修饰可以选择性地将胶囊药物输送到HER2过度表达的癌细胞[15],因此Anti-HER2免疫脂质体是一种靶向给药治疗HER2过度表达癌症很有前途的策略。本文主要优化并对比了两种不同的聚乙二醇连接方法,相较之前常见的DSPE-PEG2000-Mal连接方法,DSPE-PEG2000-NHS连接方法更为简单、高效,为今后靶向药物的研究提供一种更简单、高效的免疫脂质体的制备方法。
1 实验材料和方法
1.1 材料
MCF-7细胞(HER2表达阴性细胞系,HER2-cell)和SKOV-3细胞(HER2表达阳性细胞系,HER2+cell)购买于美国标准生物品收藏中心(ATCC),细胞培养基RPMI-1640、DMEM培养基、胎牛血清购买于美国Thermo Fisher Scientific(GIBCO)公司;氢化卵磷脂、DSPE-mPEG2000(二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000)、DSPE-PEG2000-Mal(磷脂酰乙醇胺-聚乙二醇2000-马来酰亚胺)、DSPE-PEG2000-NHS(二硬脂酰磷脂酰乙酰胺-聚乙二醇2000-N-羟基丁二酰亚胺)、Cy5-PEG2000-DSPE(近红外染料Cy5-聚乙二醇-磷脂)购买于西安瑞禧公司;胆固醇、2-IT(2-Iminothiolane HCL)购买于Sigma公司;HER2单克隆抗体由张江生物科技有限公司赠送;PBS、无水乙醇等试剂购自J.T.Baker公司;50、100、200 nm孔径聚碳酸酯膜购买于Whatman公司;Zetasizer Nano ZS是由英国Malvern公司制造,脂质体挤出器LF-1由美国Avestin公司制造;超微量天平为德国梅特勒-托利多XP6百万分之一超微量天平;OLYMPUS共聚焦显微镜;流式细胞仪为Millipore Guava 8HT;多功能微孔板检测仪为Synergy H1。
1.2 实验方法
1.2.1 NHS/Mal脂质体(NHS/Mal LP)以及空白脂质体(LP)的制备——乙醇注入法。 取3 mL PBS于圆底玻璃离心管中,65℃水浴预热,磁力搅拌使PBS形成漩涡。0.5 mL无水乙醇溶液65 ℃水浴预热,精确称取28.74 mg氢化卵磷脂、7.3 mg DSPE-mPEG2000、9.57 mg胆固醇、2.394 mg DSPE-PEG2000-Mal /DSPE-PEG2000-NHS溶解于预热无水乙醇中,涡旋均匀,吸取至1 mL注射器中,将注射器悬空放置于水相圆底玻璃离心管中,待乙醇脂溶液温浴充分后,快速将油相注入水相中,65 ℃ 涡旋30 min,形成脂质体。将制备好的的脂质体溶液通过脂质体挤出器,聚碳酸酯膜的粒径为 200,100,50 nm,反复挤出 21 次,获得粒径均一的NHS/Mal脂质体。空白脂质体(LP)制备时未加入Mal- DSPE-PEG2000 /NHS-DSPE-PEG2000,其制备方法与上述方法相同。
1.2.2 Anti-HER2免疫脂质体(Anti HER2-NHS/Mal LP)的制备。 DSPE-PEG2000-NHS连接法:将HER2抗体溶液加入至透析袋(截留分子量为100 ku),放置于透析液(50 mM Na2HPO4、50 mM NaH2PO4、10 mM EDTA、0.15 M NaCl,pH 7.4)中,4 ℃,6 h,每2 h换一次透析液。透析后抗体与NHS脂质体混匀,摩尔比为1:50,室温震荡孵育3 h,PBS透析(透析袋截留分子量为300 ku)除去未与脂质体连接的HER2抗体。
DSPE-PEG2000-Mal连接法:将HER2抗体溶液加入至透析袋(截留分子量为100 ku),放置于透析液(50 mM Na2HPO4、50 mM NaH2PO4、10 mM EDTA、0.15 M NaCl,pH 8.0)中,4℃,6 h,每2 h换一次透析液。将透析后的抗体与2-IT混匀,摩尔比为1:10,室温震荡孵育1 h,放置于PB溶液(50 mM Na2HPO4、50 mM NaH2PO4,pH 7.4)中透析0.5 h,去除未连接2-IT。将2IT-Anti HER2与Mal脂质体混匀,摩尔比为1:50,室温震荡孵育3 h。 PBS透析(透析袋截留分子量为300 ku)除去未与脂质体连接的2IT-Anti HER2。
空白脂质体对照:将空白脂质体与HER2抗体混匀,摩尔比为1:50,室温震荡孵育3 h,PBS透析除去未与脂质体连接HER2抗体。
荧光免疫脂质体的制备:将0.2 μg Cy5-PEG2000-DSPE(645 nm激发红光荧光染料)与100 μL空白脂质体混合均匀,65 ℃水浴1 h后连接HER2抗体,连接方法同上,制备插入Cy5-PEG2000-DSPE的空白荧光免疫脂质体、NHS/Mal荧光免疫脂质体。透析去除未连接的抗体和游离的荧光染料,成功获得Lip(空白荧光免疫脂质体)、NLip(Anti HER2-NHS-Cy5荧光免疫脂质体)和MLip(Anti HER2-Mal-Cy5荧光免疫脂质体)。
1.2.3细胞培养。 SKOV-3细胞(HER2+cell)用RPMI-1640培养基,含10%胎牛血清(FBS),37 ℃,5% CO2培养;MCF-7细胞(HER2-cell)用DMEM培养基,含10%胎牛血清(FBS),37 ℃,5% CO2培养。显微镜下观察细胞,选择生长状态良好的细胞,密度达到80-90% 即可传代,传代时用0.25% 胰酶消化细胞,制备单细胞悬液进行细胞计数。根据细胞计数的结果,将适当数量的细胞悬液按照实验需要接入含有新鲜培养液的培养瓶、培养皿或细胞培养板中,补足培养基,放入37 ℃,5% CO2培养箱培养,以备实验所需。
1.2.4 粒径测定。 用英国Malvern公司的Zetasizer Nano ZS分析仪测定样品的粒径,每份样品重复3次。
1.2.5 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测HER2抗体与脂质体的连接效率。 将样品移至新的EP管中,按比例加入4×SDS Loading buffer。恒温加热器100 ℃煮沸30 min破乳,12000 rpm离心5 min后,15%分离胶进行SDS-PAGE变性电泳。每泳道按相同体积上样,常规电泳。注:由于透析后抗体浓度较低,为方便检测,透析后样品上样体积为透析前的两倍,计算连接效率时透析后蛋白条带灰度值除以2。
1.2.6 细胞毒性分析。 本研究中,用MTT比色法检测各种脂质体对SKOV-3和MCF-7细胞增殖的影响。将SKOV-3和MCF-7细胞以5 × 103/孔接种于96孔培养板,实验每组设计4个复孔。37 ℃,5% CO2培养24 h。每孔分别加入0.02、0.2、2 μg/mL的LP、Anti HER2-NHS LP、Anti HER2-Mal LP。37 ℃,5% CO2培养24 h。加MTT处理4 h后,去掉培养基,每孔加入120 μL DMSO,轻微震荡10 min,在490 nm的波长下测定OD值读数,同时设置调零孔,对照孔,重复试验3次。计算相对细胞存活率 RCV(%)=测试组OD值/对照组OD值×100%。
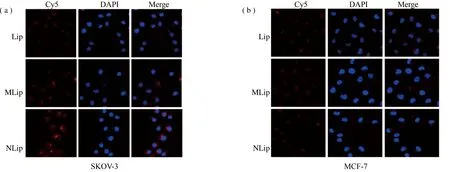
1.2.7 免疫脂质体的靶向特异性检测。 将SKOV-3和MCF-7细胞以5 × 104/皿接种于φ15 mm TC 共聚焦培养皿中,37 ℃,5% CO2培养24 h。将荧光免疫脂质体NLip、MLip和Lip分别与SKOV-3和MCF-7细胞37℃ 孵育2 h后,4% 多聚甲醛固定5 min,DAPI(5 μg/mL)染色15 min,激光共聚焦显微镜拍照。将NLip、MLip和Lip分别与SKOV-3和MCF-7细胞4℃ 孵育30 min,使用密理博guava easy Cyte 8HT 微流式细胞分析仪进行荧光检测。
1.2.8 统计学分析。 实验所得数据均以平均值(Mean ± SD)表示,各组数据差异性比较采用t-test(非参数检验)方法进行分析,p> 0.05表示差异性不显著;0.01<*p<0.05表示差异性显著;**p<0.01表示差异性极显著;***p<0.001表示差异具极其显著性。
2 结果与讨论
2.1 脂质体的粒径检测
众所周知,粒径大小通过影响组织分布和清除率对药物动力学的变化起着重要的作用。应用英国Malvern公司的zeta电位仪Zetasizer Nano ZS分别检测NHS脂质体(NHS LP)、Mal脂质体(Mal LP)、Anti HER2-NHS/Mal免疫脂质体(Anti HER2-NHS/Mal LP)、空白脂质体(LP)粒径。本研究制备的脂质体平均粒径约为100-135 nm,分布均匀,成正态性。
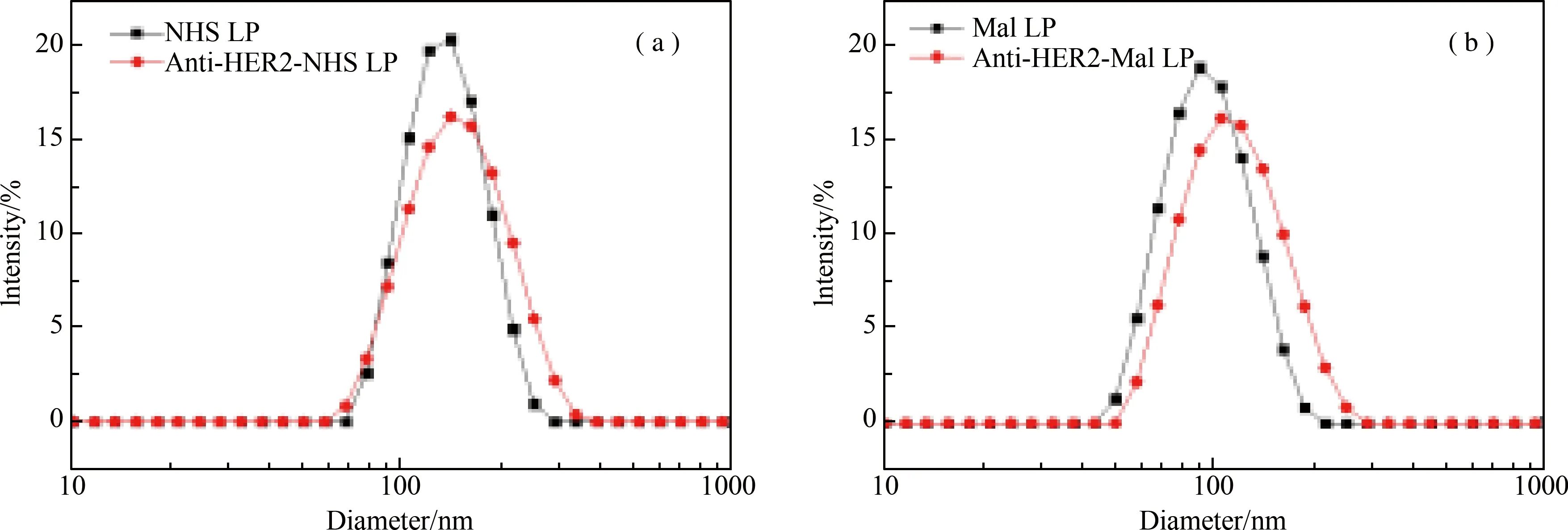
注:(a) NHS脂质体与Anti HER2-NHS LP粒径分布;
2.2 SDS-PAGE检测HER2抗体与脂质体的连接效率
空白脂质体与Anti-HER2反应透析前后对比可得出,若Anti-HER2未与脂质体连接,样品分子量< 300 ku,经透析袋(截留分子量为300 ku)透析后样品中检测不到抗体条带。若Anti-HER2成功与脂质体连接,样品分子量 > 300 ku,经透析袋(截留分子量为300 ku)透析后样品中能够检测到抗体条带。HER2抗体经巯基化处理后,条带上移,图2(a)电泳结果表明脂质体与HER2抗体成功连接,制备了免疫脂质体。通过ImageJ对蛋白条带灰度值进行相对定量,计算出3-6各泳道的条带灰度值比,连接效率=透析后灰度值比/透析前灰度值比×100%。图2(b)显示,DSPE-PEG2000-NHS连接法的连接效率为44.24%,DSPE-PEG2000-Mal连接法的连接效率为36.56%。由此得出结论,DSPE-PEG2000-NHS连接法的连接效率更高。
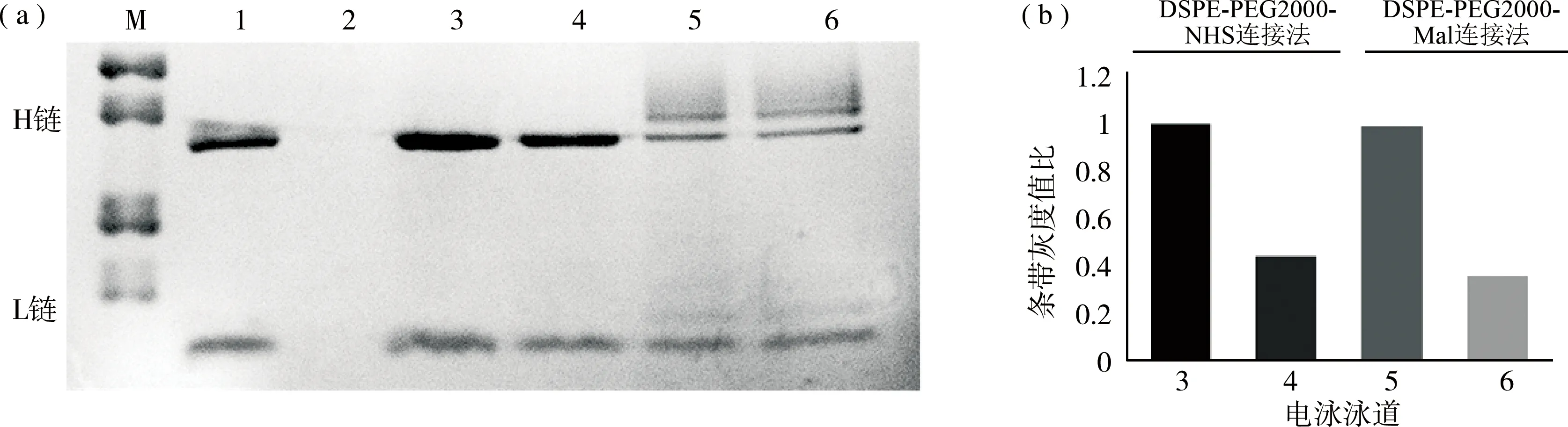
图2 SDS-PAGE 检测HER2抗体与脂质体的连接效率
2.3 细胞毒性分析
将SKOV-3和MCF-7细胞以5 × 103/孔接种于96孔培养板,实验每组设计4个复孔。37 ℃,5% CO2培养24 h。每孔分别加入0.02 μg/mL、0.2 μg/mL、2 μg/mL的LP、Anti-HER2-NHS LP、Anti-HER2-Mal LP。 37 ℃,5% CO2培养24 h,MTT法测定不同脂质体的细胞毒性。不同浓度的脂质体在SKOV-3细胞(图3(b))、MCF-7细胞(图3(a))中均显示出较高的细胞活力,与对照相比无明显差异。因此推测制备的脂质体具有良好的生物相容性和低的细胞毒性。因此,本研究中成功制备的免疫脂质体在体外实验中是相对安全的。
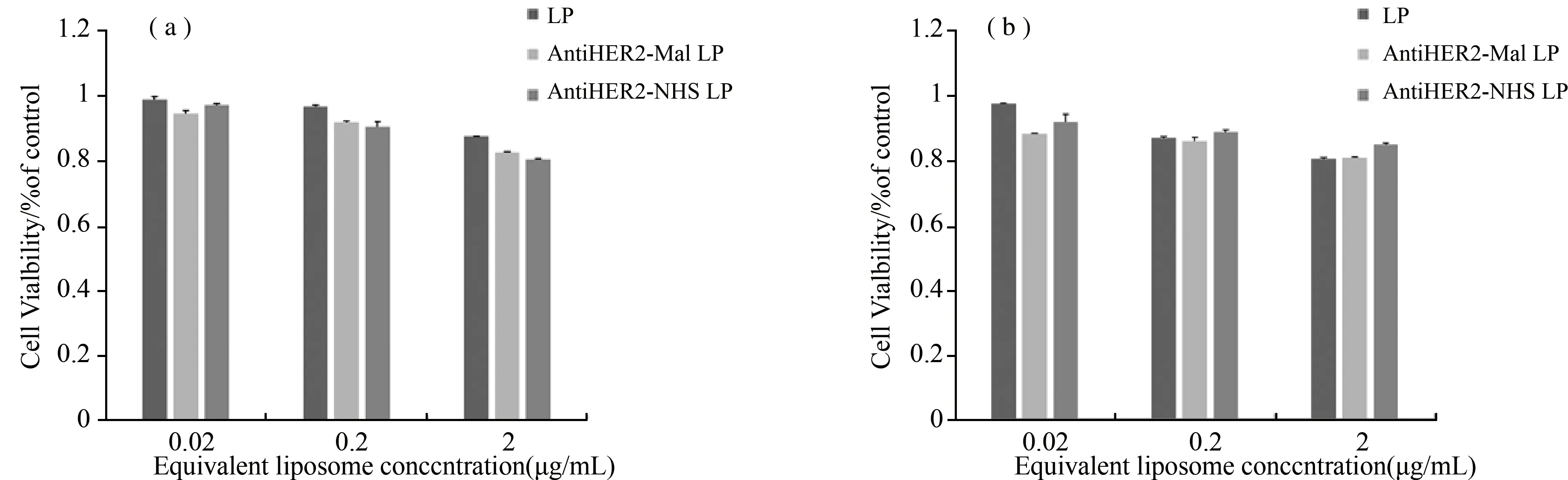
图3 脂质体细胞毒性实验分析 (a) 脂质体处理MCF-7细胞24 h后的细胞活性;(b) 脂质体处理 SKOV-3细胞24 h后的细胞活性
2.4 共聚焦显微镜检测免疫脂质体的靶向特异性
将荧光免疫脂质体NLip、MLip和Lip分别与SKOV-3和MCF-7细胞37 ℃ 孵育2 h后,4% 多聚甲醛固定5 min,DAPI(5 μg/mL)染色15 min,激光共聚焦显微镜拍照。图4(a)结果表明,NLip、MLip可与SKOV-3细胞表面的HER2受体结合,较空白荧光免疫脂质体(Lip)荧光明显增强。由于MCF-7细胞表面不表达HER2受体,将NLip、MLip与MCF-7细胞孵育后,与空白荧光免疫脂质体(Lip)相比,并未显示出荧光强度的差异,如图4(b)。结果表明NHS/Mal荧光免疫脂质体可与HER2受体特异性结合,并通过HER2受体介导的内吞作用增强内化。
2.5 流式细胞仪检测免疫脂质体的靶向特异性
将荧光免疫脂质体Lip、NLip、MLip,分别与MCF-7细胞、SKOV-3细胞孵育,流式细胞仪检测脂质体与HER2受体表达差异细胞的结合特异性。由于NLip和MLip可以与SKOV-3细胞表面的HER2受体特异性结合,因此流式细胞仪检测NLip和MLip与细胞孵育后,荧光强度的峰较Lip明显偏移,与空白荧光免疫脂质体(Lip)相比,荧光明显增强(图5(a));由于MCF-7细胞表面不表达HER2受体,将NLip、MLip与MCF-7细胞孵育后,与Lip相比,荧光强度的峰未见偏移,并未显示出荧光强度的差异(图5(b)),这与共聚焦显微镜分析结果一致。
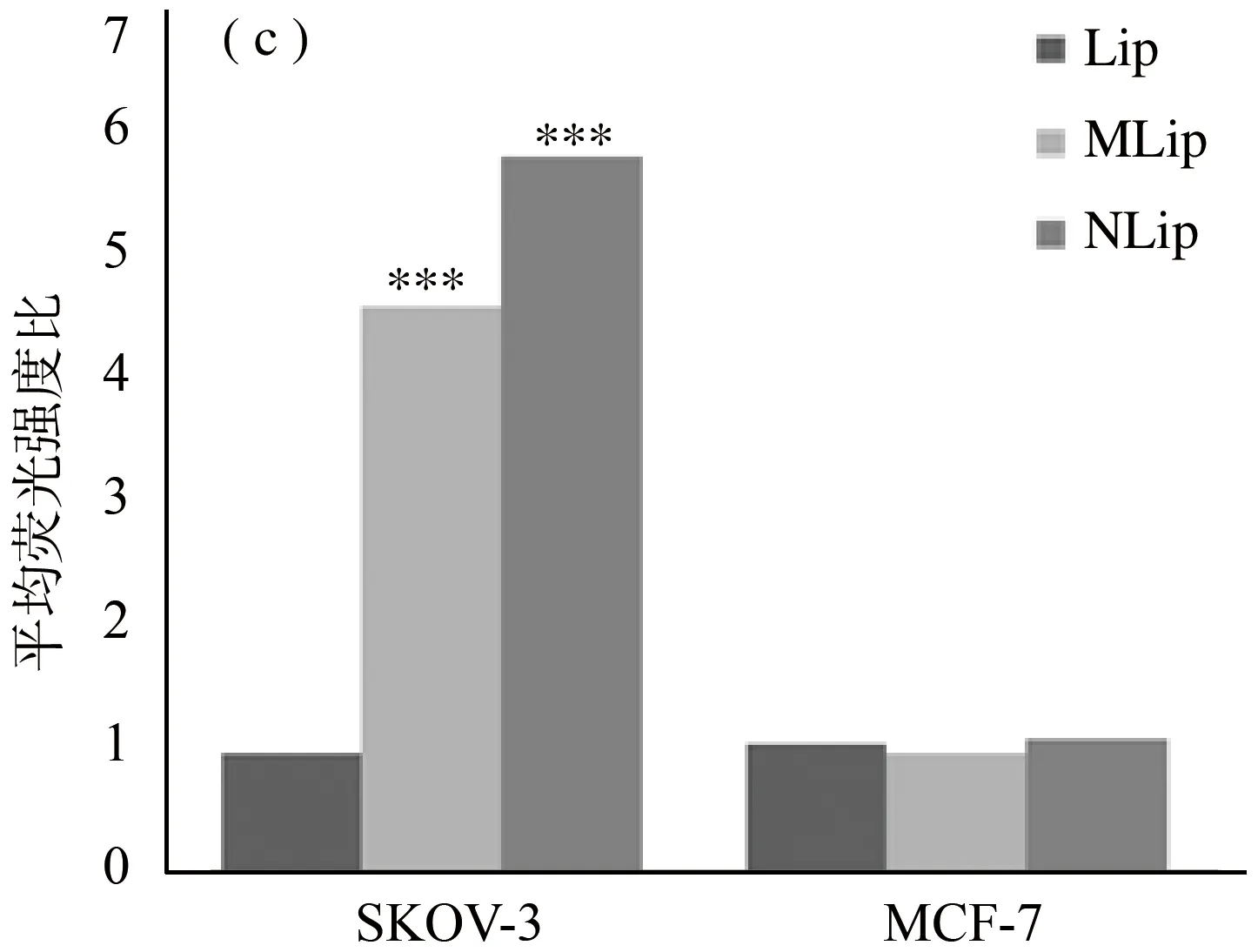
注:***p<0.001 vs control;(a) 荧光免疫脂质体与SKOV-3细胞结合的荧光强度;(b) 荧光免疫脂质体与MCF-7细胞结合的荧光强度;(c) 数据统计。
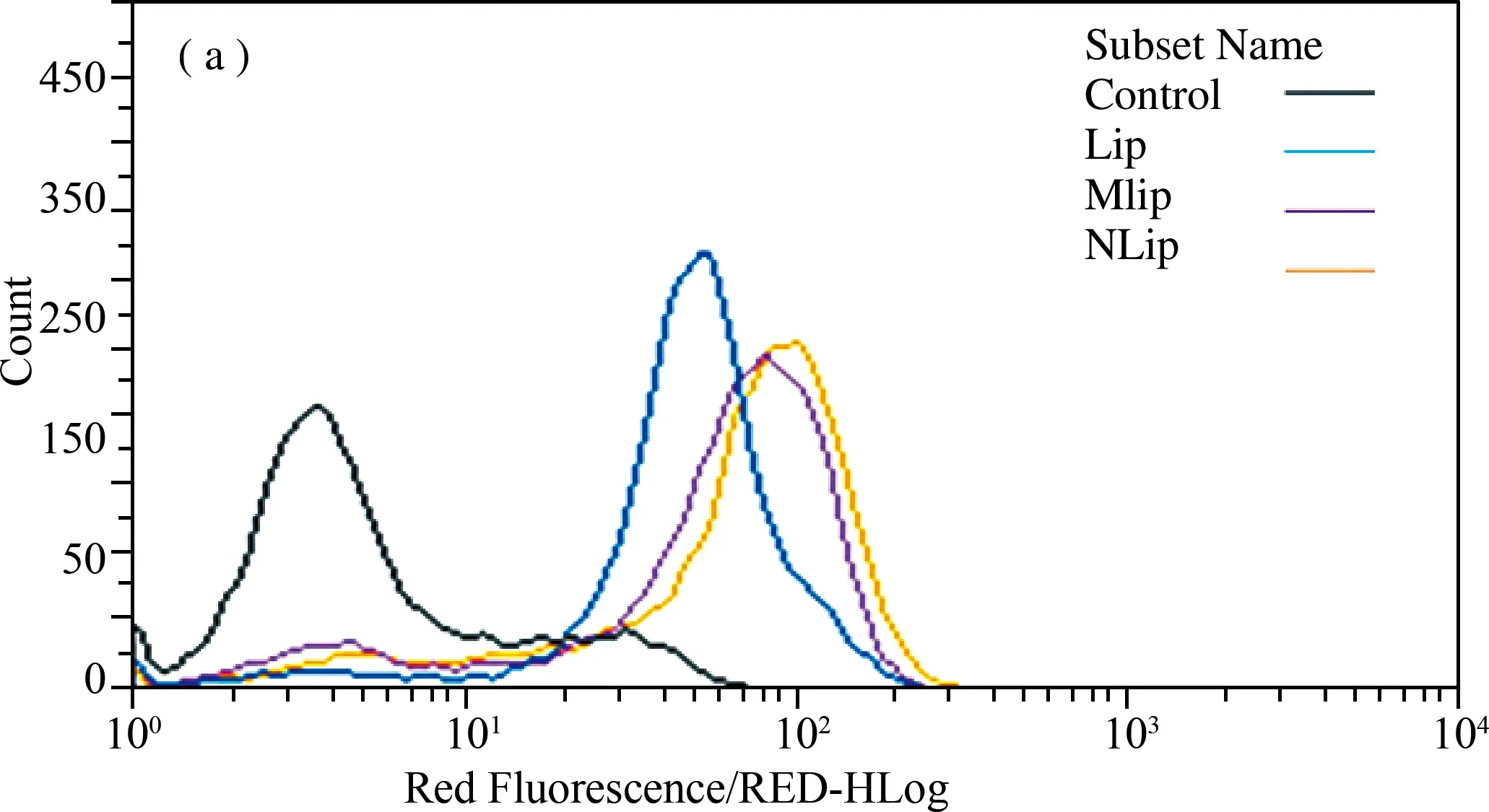
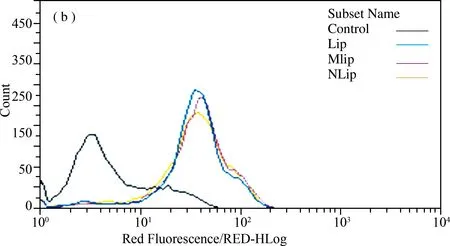
图5 流式检测免疫脂质体的靶向特异性
3 结论
采用聚乙二醇连接法成功制备了具有较小粒径的HER2抗体免疫脂质体。通过细胞毒性分析,本研究所制备的免疫脂质体毒性小,具有较高安全性,可保证体外实验的顺利进行。SDS-PAGE检测表明NHS -PEG2000-DSPE的连接效率更高。共聚焦显微镜观察与流式检测显示,HER2过度表达的SKOV-3细胞中HER2抗体免疫脂质体较空白脂质体组的荧光强,这表明制备的免疫脂质体具有较好的靶向特异性。综上所述,本文主要研究了HER2抗体连接脂质体的方法,为今后靶向药物的研究提供一种更简单、高效的免疫脂质体的制备方法。

