阴离子氧化还原反应对富锂层状材料性能影响研究进展
康若彤,肖 晶,孙一诺,陈艳丽,颜文超
(临沂大学 材料科学与工程学院,山东 临沂 276000)
锂离子电池作为高能绿色储能装置备受关注。自1990 年商业化以来,已经广泛应用于便携式电子设备领域,同时,在新能源汽车和国防工业领域展示了广阔的应用前景和潜在的巨大经济效益。随着新能源汽车的快速发展,对动力电池的续航里程及其它性能提出更高的要求,根据《中国制造2025》、《促进汽车动力电池产业发展行动方案》以及《汽车产业中长期发展规划》,到 2020年,我国动力电池单体比能量要达到300 Wh kg-1[1-3]。在动力电池材料体系,电池的能量密度和功率密度主要取决于正极材料的性能[4]。目前商业化的正极材料无法满足上述要求,因此,选取新的正极材料成为储能领域的研究重点。
富锂层状材料具有高的放电比容量和高的工作电压,有希望成为下一代商业化动力电池正极材料[5,6]。经过近十几年的发展,富锂层状材料的放电比容量高达300 mAh·g-1,但该材料存在首次库伦效率低、倍率性能差、容量和电压衰减严重的缺点,严重制约了富锂层状材料的商业化[7-9]。随着研究的深入和表征设备的快速发展,研究者发现富锂层状材料的优缺点与材料晶体中氧的结构密切相关,进而影响充放电过程中氧离子参与电化学反应的程度[10-12]。
为了更好的理解富锂层状材料晶体结构中氧离子与过渡金属离子和氧离子与锂离子间的相互作用以及该作用对材料电化学性能的影响,本文拟从分子轨道理论角度进行阐述。针对富锂层状材料的缺点,在传统改性方法的基础上,根据氧离子氧化还原反应机制进行了总结和分类,如阴离子取代,阳离子取代,氧空位的形成和表面包覆等,并对每种方法的作用机理进行了阐述。
1 富锂层状材料的晶体结构
富锂层状材料的分子式为Li1+xM1-xO2(M=Ni,Co和Mn),也可以写为(1-x)LiMO2·xLi2MnO3,由于材料的组成比较复杂,其晶体结构尚未达成共识。从分子式中可以看出,该结构由LiMO2和Li2MnO3组成。其中,LiMO2晶体结构为α-NaFeO2,空间群为R3m,结构示意图见图1(a)[13]。Li2MnO3的分子式可以写为Li[Li1/3Mn2/3]O2,该结构同样为α-NaFeO2,只是过渡金属层中1/3的Mn4+被Li+替代,形成了LiMn6的超晶格,晶体结构对称性由六方晶系R3m降低为单斜晶系C2/m空间群,如图1(b)所示[14]。
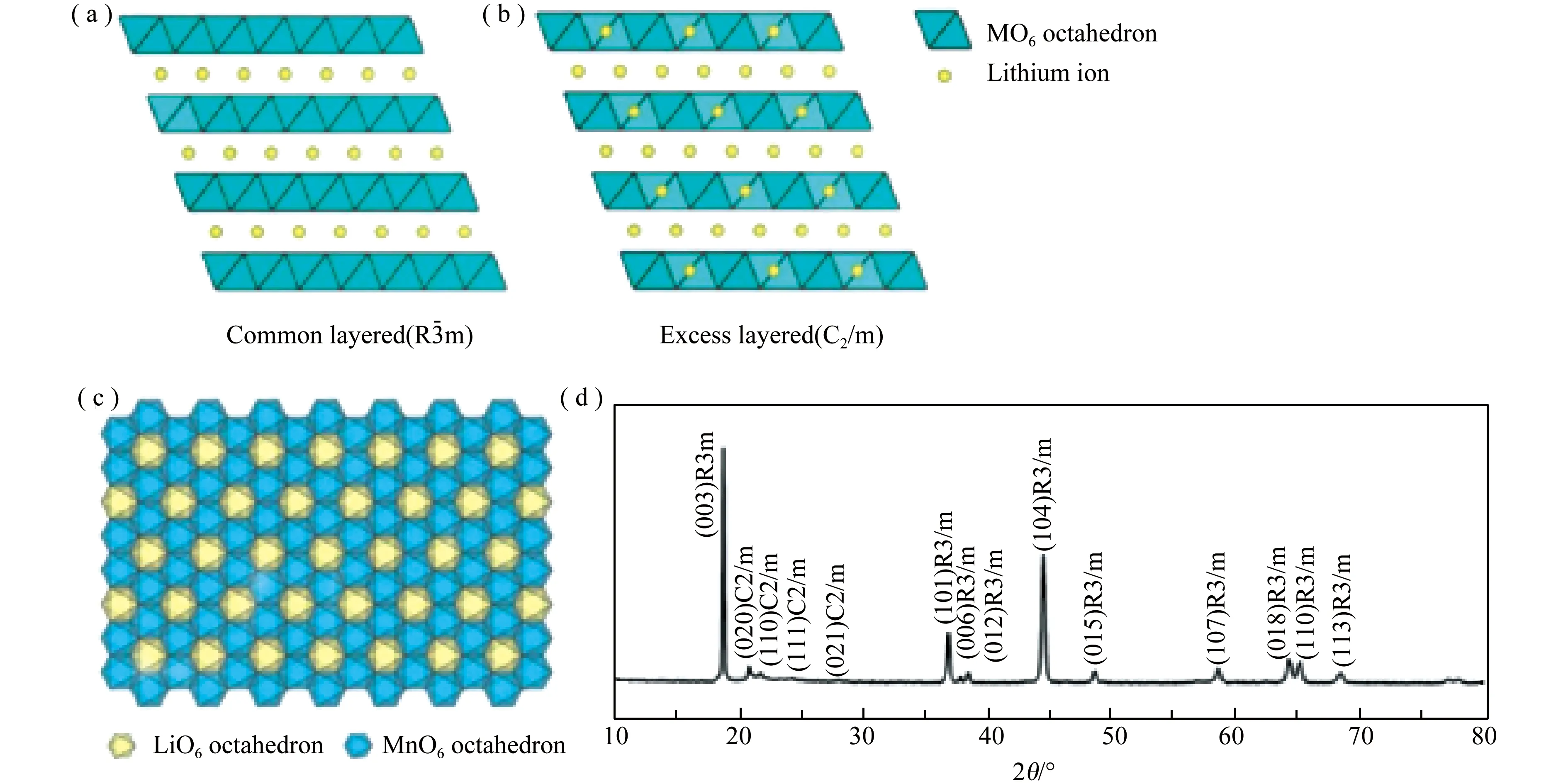
图1 晶体结构示意图(a) LiMO2结构;(b) Li2MnO3结构;(c) Li2MnO3结构中Li/Mn原子排列;(d) 富锂层状材料的XRD图谱[22]
目前,该材料存在的晶体结构主要有两种:纳米复合结构和固溶体结构[14-17]。Thackeray等[18]研究发现,LiMO2的(003)晶面与Li2MnO3的(001)晶面的晶面间距均为0.47nm,二者在原子尺度能够复合,因此能够形成纳米复合结构。此外,由于LiMO2和Li2MnO3二者具有高度的相容性,研究者提出1个LiO6八面体周围有6个MnO6八面体围绕形成了蜂窝状和六角形的LiMn6结构(图1(c))进而形成了固溶体结构[19]。为了进一步证明该材料晶体结构为固溶体结构,研究者通过先进的表征设备进行了验证。Delmas等[20]人在三维空间内观测了富锂层状材料的电子衍射图,他们发现该材料在任何角度的电子衍射谱图都呈现均一的衍射斑点,归属于同一晶系,不存在第二相。Ferreira团队[21]通过X射线衍射(XRD)、电子衍射技术和球差校正透射技术,从原子级别证明了富锂层状材料的结构为固溶体结构。尽管该材料的晶体结构还在讨论中,但大家普遍认为XRD中20°-25°的衍射峰(图1(d))为该材料特征衍射峰。
2 富锂层状材料的充放电机制
尽管富锂层状材料的晶体结构还在争论之中,但该材料具有超高的放电比容量毋庸置疑。将富锂层状材料分为LiMO2和Li2MnO3两相并与电压之间建立关系进行阐述,成为了该领域的共识。Thackeray等[18]首先提出了富锂层状材料的充放电机制。以0.3Li2MnO3·0.7LiNi0.5Mn0.5O2为例,首次充电过程,电压在4.4 V之前,Li+从LiNi0.5Mn0.5O2组分脱出同时伴随着过渡金属离子的氧化(Ni2+/3+/4+)反应方程式为(1),在此阶段,Li2MnO3为非电化学活性物质不参与电化学反应,能够起到稳定晶体结构的作用。当充电电压达到4.4 V,Li2MnO3开始活化,充电曲线出现一个较长的平台,由于Mn为+4价无法发生氧化,Li+在脱出的过程中为了维持材料的电荷平衡,O2-发生氧化(O2-/O22-/O2),最终以O2的形式释放,因此该平台也称为氧损失平台。由于Li+和O2-从晶体结构中脱出,晶体结构在该过程发生重了排,最终以Li2O的形式脱出,反应方程式为[19]
0.3Li2MnO3·0.7LiNi0.5Mn0.5O2→0.7Li++0.3Li2MnO3·0.7Ni0.5Mn0.5O2,
(1)
0.3Li2MnO3·0.7Ni0.5Mn0.5O2→0.3MnO2+0.7Ni0.5Mn0.5O2+0.3Li2O。
(2)
放电过程,Li+重新嵌入到正极材料并伴随着过渡金属离子的还原,反应方程式为
0.3MnO2+0.7Ni0.5Mn0.5O2+Li+→LiNi0.35Mn0.65O2。
(3)
从反应方程式可以看出,充电过程有1.3 mol的Li+从晶体结构中脱出,放电过程只有1 mol的Li+重新嵌入晶体结构,导致首次充电过程具有较大的容量不可逆损失。同时,首次充电过程材料结构发生重排,这也是导致循环过程中层状结构向尖晶石结构转变的起因[23-25]。在随后的充电过程氧损失平台消失,充放电机制与三元层状材料相似,该材料的充放电曲线如图2(a)所示,不同电压下电化学反应路径如图2(b)。
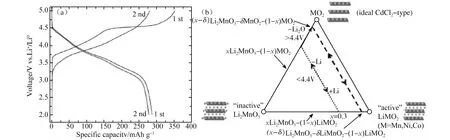
图2 (a) 0.3Li2MnO3·0.7LiNi0.5Mn0.5O2电极材料的充放电曲线;(b) 0.3Li2MnO3·0.7LiNi0.5Mn0.5O2材料不同电压下电化学反应路径[18]
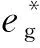
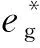
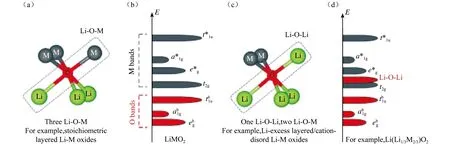
图4 (a) LMO2材料结构中Li-O-M骨架中局部结构;(b) LiMO2材料能带结构示意图;(c) Li2MnO3材料中Li-O-Li和Li-O-M骨架中局部结构;(d) Li2MnO3材料能带结构示意图[27]
3 氧离子氧化还原反应在富锂层状材料中的应用
通过上述内容可知,氧离子参与电化学反应对富锂层状的容量和结构具有重要的影响。基于此观点,通过调控晶体中氧的结构成为近几年的研究的热点[28-30]。本部分内容将对相关工作进行总结,以便读者能够系统的了解氧离子氧化还原反应对富锂层状材料对电化学性能影响的相关工作。
3.1 阴离子取代对氧离子氧化还原反应的影响
目前,阴离子取代是改善富锂层状材料循环稳定性的常用方法之一,即通过适量的阴离子取代富锂层状材料中氧离子,改变材料中氧离子与过渡金属离子的成键比例,影响氧离子参与电化学反应的程度,从而提高富锂层状材料的电化学性能。
F的电负性要高于O,适量的F掺杂进入晶体结构能够改变材料的晶体结构。Li等[31]研究了F-掺杂的富锂层状材料结构和电化学性能的影响,结果表明随着掺杂量的增加,循环过程中缓解了层状结构向尖晶石相转变,分析认为F-进入晶体结构形成了M-F键和降低了过渡金属离子与氧的成键数量,同时在电化学反应过程中F-不参与电化学反应,起到稳定晶体结构的作用,因此改性富锂层状材料展示了优异的电化学性能。Yan等[32]通过第一性原理计算研究了Cl-掺杂和调控富锂层状材料的氧离子氧化还原反应,通过密度泛函理论计算发现Cl-掺杂降低了充电电压和缩短了氧损失平台,分析其原因为Cl-掺杂降低了富锂层状材料中过渡金属离子与配合物间的带隙,进而影响了晶体结构的局部结构,Cl进入晶体结构使得过渡金属离子与配合物的键长长度增加,如图5所示。同时,通过计算发现Br-取代部分O2-形成Br-O键,该键的形成将会导致富锂层状材料的晶体结构发生坍塌。与O2-相比,S2-具有更低的电负性,S2-掺杂到晶体结构形成键能较弱的Li-S键,提高了富锂层状材料的离子传导率。Zhang等[33]将Li2S和富锂层状材料简单混合,在空气中煅烧制备了S-掺杂的富锂层状材料,通过原子尺度材料模拟的计算机程序包(VASP)计算发现少量的硫掺杂能够稳定晶体结构和平衡锂离子嵌入和脱出时所需的能量,电化学性能证明改性材料首次库伦效率高达96%,放电比容量为293.3 mAh·g-1,同时改性材料展现了优异的倍率性能和循环性能。通过研究发现,适量的阴离子取代氧离子会影响富锂层状材料中氧离子的氧化还原反应。
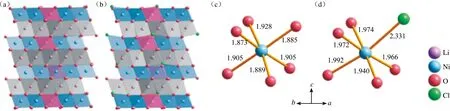
图5 晶体结构示意图。(a) Li1.11Ni0.89O2;(b) Li1.11Ni0.89O1.89Cl0.11;(c) Li1.11Ni0.89O2结构中局部的NiO6骨架;(d) Li1.11Ni0.89O1.89Cl0.11结构中局部的NiO5Cl骨架[32]
图6 DFT模拟(a) BO4和(c) BO3聚阴离子掺杂富锂层状材料的局部结构示意图;(b)和(d)为聚阴离子局部晶体结构键长[36]
通过以上研究发现,阴离子取代富锂层状材料氧离子,改变了富锂层状材料局部晶体结构,影响了Li-O-Li和Li-O-M骨架结构以及过渡金属离子与配合物间能级,提高了富锂层状材料的电化学性能。
3.2 阳离子改性对氧离子氧化还原反应进行调控
3.2.1 过渡金属元素比例调控对氧离子氧化还原反应的影响研究。富锂层状材料中过渡金属元素主要由Ni,Co和Mn组成,三者为元素周期表中同一周期相邻的元素,具有相同的电子结构。然而,在富锂层状材料中Ni,Co和Mn的价态分别为+2,+3和+4价,也就是说在晶体结构中各过渡金属离子与O2-的结合能力不同。同时,Li+与Ni2+的离子半径相近,在高温煅烧过程中容易产生Li/Ni混排现象。这些都会影响电化学反应过程中氧离子的氧化还原反应进程,针对以上问题研究者做了大量的研究工作[37-40]。
研究者对富锂层状材料中Ni含量改变进行了研究。Hwang等[40]研究了Ni在稳定高容量富锂层状材料中的作用,通过改变结构中Ni和Mn的摩尔比发现,随着Ni含量的增加减缓了Mn4+参加电化学反应的程度,结合X-射线吸收光谱(XAS)发现,与Mn相比,Ni具有更高的电负性和氧化状态易与O发生杂化,Ni和O的杂化减缓了循环过程中Mn4+还原为亚稳态的Mn3+,抑制了循环过程中姜泰勒效应的发生。同时,Manthiram等[40]研究了Ni含量增加对富锂层状材料结构和电化学性能影响,发现增加Ni3+会产生以下影响:(1) 降低Li/Ni混排现象,(2) 氧损失平台长度缩短,(3) 放电容量降低;(4) 操作电压平台增加;(5) 材料循环稳定性增加。从上述内容可以看出,改变富锂层状材料结构中Ni/Mn比例能够影响过渡金属离子与氧离子的结合,进而改变氧离子的氧化还原反应程度。
富锂层状材料中调控Ni,Co和Mn含量改变同样对氧离子氧化还原反应的具有影响。Shi等[37]对比研究了0.5Li2MnO3·0.5LiNi0.8Mn0.1Co0.1O2(LR-811)和传统富锂层状材料0.5Li2MnO3·0.5LiNi1/3Mn1/3Co1/3O2(LR-111)的电化学性能,结果表明LR-811材料具有优异的循环性能和倍率性能,200次循环后容量保持率为82%.通过进一步的表征发现,Ni2+提高了过渡金属离子与氧离子的杂化程度并且Ni2+在晶体结构中作为稳定剂,减缓了层状结构向尖晶石相的转变。Zhang等[41]在Li[Li0.2Ni0.13Co0.13Mn0.54]O2材料的基础上,对Li[Li0.2Ni0.13Co0.13Mn0.54]O2·xLiNiO2复合材料和LiNiO2含量进行了研究,随着LiNiO2含量的增加复合材料的氧损失平台变短和首次库伦效率提高,其中Li[Li0.2Ni0.13Co0.13Mn0.54]O2-0.4LiNiO2复合材料展示了优异的循环性能,500次循环容量保持率为93.3%。通过物化性能检测发现,Ni2+与Li+发生交换占据了结构中锂位,同时Ni2+容易扩散到表面形成尖晶石相保护层,提高了复合材料的循环稳定性。
最近,为了阐述阳离子重排对氧离子还原氧化反应的影响,Zhang等[42]对一系列不同组分的富锂层状材料进行研究,结果表明氧离子氧化的本质与阳离子元素配比密切相关,其中O-O二聚物的形成可以通过Li/Ni混排和氧空位的形成进行调控,氧损失反应平台中没有O-O二聚物形成将提高氧离子氧化还原反应的可逆程度。
3.2.2 其它阳离子取代对氧离子氧化还原反应的影响。为了改善富锂层状材料的局部晶体结构,阳离子掺杂被认为是一种有效的方法,如通过Fe,Ru,Mg,Zr等取代部分过渡金属元素,引入外部元素能够提高富锂层状材料的电子电导性或稳定晶体结构,从而达到改善电化学性能的目的[43-47]。
通过引入某些外部元素如取代Li位,同样能够改变富锂层状材料的晶体结构[48-50]。Yan等[51]对Al3+取代富锂层状材料中Li+位进行了研究,通过优化掺杂含量发现Li1.45Al0.05Mn0.675Ni0.1675Co0.1675O2材料具有优异的电化学性能,首次放电比容量可达323.7 mAh·g-1,同时发现随着Al含量的增加,4.5V氧损失的平台逐渐缩短,分析其原因为Al3+进入晶格取代1个Li+,为保持材料电荷平衡,另外两个Li+从结构中脱出导致氧空位的产生,影响了富锂层状结构中Li-O-Li骨架的数量。相比于阳离子取代过渡金属离子,阳离子取代锂位,对结构中Li-O-Li和Li-O-M骨架的影响更为直接。
3.3 氧空位调控对氧离子氧化还原反应的影响
除了上述阴离子取代氧离子和阳离子取代能够调控富锂层状材料中O 2p轨道与过渡金属Md/s/p轨道的杂化程度外,研究者发现在富锂层状材料中制造氧缺陷,同样能够调控氧离子的氧化还原反应[52-54]。Qiu等[55]以CO2为反应介质,通过气-固界面反应,获得了表面具有氧缺陷的富锂层状材料,通过XRD表征发现没有破坏富锂层状材料的晶体结构,电化学性能表表明改性材料首次库伦效率和放电比容量分别为93.2%和301 mAh·g-1,同时,循环100次放电比容量仍高于300 mAh·g-1,电压基本没有衰减。为了进一步研究氧空位对材料的作用机理,研究者将理论计算和实验数据相结合,认为氧空位产生降低了Li+的迁移势磊如图7(a)所示,与未改性富锂层状材料(LR-NCM)相比,改性材料(GSLR-NCM)降低了表面氧的分析进而降低了O2的释放,进而降低了O2与电解液间副反应的发生,在表面形成了较薄的固体电解质膜(SEI),降低了电池体系内阻的增加,反应机理图见7(b)-(e)。为了简化制备过程,Huang等[56]在室温下通过简单的CO2处理富锂层状材料,获得了改性材料,该材料在55℃操作温度下首次放电比容量可达321 mAh·g-1,改性材料同样具备优异的循环性能和倍率性能。
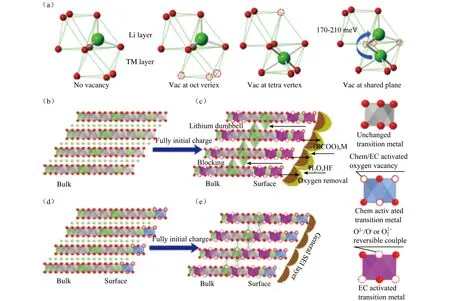
图7 (a) 计算不同空位下晶体结构的位点稳定性和活化能,(b,c)纯LR-NCM材料充电前和全充状态下晶体结构和(d,e)改性GSIR-NCM材料充电前和全充状态下晶体结构示意图[55]
富锂层状材料在适当的温度下NH3同样能够获得具有氧空位的改性材料。Huang等[57]富锂层状材料在400 ℃下暴露于NH3中处理1-2 h,改性富锂层状材料具有以下3个特征:(1) 内部Mn和Co的价态降低;(2) 由于结构重组降低了Co-O和Mn-O键的数量;(3) Li+的脱出在表面形成了LiOH,Li2CO3和Li2O。电化学性能表明改性材料提高了循环性能和缓解了电压衰减。
最近,Sun等[58]使用温和的气态硫对富锂层状材料进行处理,获得了兼具氧空位和硫掺杂的改性富锂材料,电化学性能表明0.5 C倍率下循环600次的容量保持率为81.1%且具在10 C倍率性放电比容量为174.8 mAh·g-1。通过分析发现晶体结构中氧空位的产生和硫的掺入降低了氧的分压,提高了锂离子的传导速率。通过研究发现,在富锂层状材料表面制造氧缺陷,能够降低结构中氧的含量,使MO6的结构发生偏离。也就是说,过渡金属离子与氧离子间的轨道重叠程度发生改变,减少电化学过程中氧离子参与程度。
3.4 表面包覆对氧离子氧化还原反应的影响
为提高富锂层状材料的循环稳定性,降低电极与电解液间副反应的发生,表面包覆也是一种常用的策略。研究发现,常见的包覆材料包括氧化物、氟化物和具有锂离子传导性能的物质[59-63]。其中,具有锂离子传导性能的物质不仅能够起到表面包覆的作用,经过高温改性后,某些外部元素还能够掺杂进入晶体结构,从而对晶体结构起到调控作用。Zheng等[64]针对传统富锂层状材料(LLMO)电压衰减严重的缺点,在材料表面包覆了一层纳米尺寸的LiFePO4(LFP),电化学性能表明包覆5wt%LFP改性材料LLMO-LFP5在0.1 C倍率下循环120次容量保持率为98.1%,电压衰减得到了明显的抑制,见图8。通过分析发现,高温处理后,LFP掺杂进入到富锂层状材料的表面,改善了过渡金属离子与氧离子的杂化程度。因此,提高富锂层状材料的电化学性能通过表面包覆和元素掺杂复合是一种有效的策略,即在表面形成具有锂离子传导性能的化合物阻碍电极/电解液副反应的发生,在内部通过掺杂外部元素调控晶体结构中氧的局部化学环境。
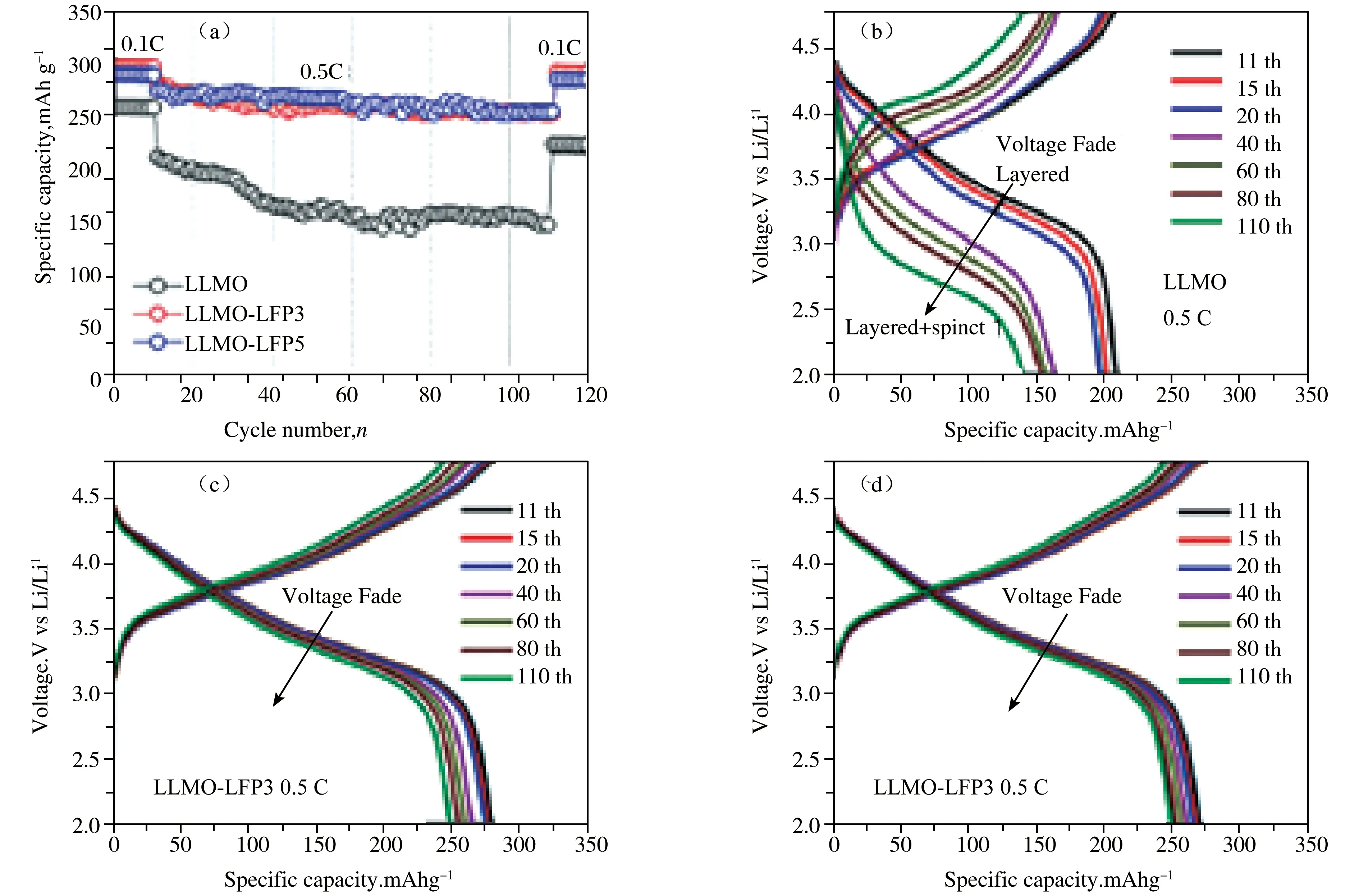
图8 A 循环性能,(B-D) LLMO,LLMO-LFP3和LLMO-LFP5正极材料在0.5 C倍率下的充放电曲线[64]
4 总结
氧离子氧化还原反应对富锂层状材料的电化学性能影响较大,氧离子参与电化学反应程度高材料的放电比容量越高但循环性能差,相反,氧离子参与电化学反应程度低材料的容量低但倍率性能和循环稳定性将提高。因此,如何在高容量和高安全性间寻求平衡是未来高性能正极材料的研究方向问题之一。此外,针对调控过渡金属离子与氧离子间电子的重叠程度,改变富锂层状材料的局部晶体结构,目前的研究主要集中在首次充电行为进行研究,对于循环几十甚至上百次循环后,氧离子如何参与电化学的研究还未见报道。因此,为了使富锂层状材料能够尽早的满足锂离子电池商业化正极材料的应用,研究长循环下氧离子反应机制也是未来需要重点关注的方向之一。

