肠外营养混合液中维生素C 含量测定的研究
穆殿平,解晓帅,张凤莹,许煜静,杨金荣*
(1.天津市第一中心医院,天津 300192;2.天津医科大学药学院,天津 300070)
维生素C(vitamin C,Vc)参与体内多种代谢过程,可增加肌体抵抗能力,促进胶原合成,具有抗病毒及抗癌作用[1,2]。近年来研究表明,Vc 在对抗脓毒血症发挥一定疗效[3]。根据临床需要,Vc 常加入肠外营养混合液(TNA)中,为不能耐受肠内营养或消化道受损患者提供肠外营养治疗[4]。有报道,肠外营养添加大剂量Vc对急性重症创伤患者较好的治疗效果[5]。然而,由于TNA 处方组分多,不同物质混合可能使其物理及化学性质发生变化,有可能降低TNA 混合液的安全性及稳定性[6,7],尤其是Vc 含有烯二醇结构易被氧化变色,甚至失效[8]。因此,测定TNA 中Vc 的含量变化是非常可靠的考查其有效性的指标,文献中关于Vc 含量测定方法报道较多,但多为单一组分或简单配伍条件,且重复性较差。本研究旨在建立操作简便、适用性广、重现性好、结果准确的高效液相色谱法(HPLC),用于测定TNA混合液中Vc 注射液含量,确保临床TNA 治疗的安全性和有效性。
1 材料
1.1 仪器 LC-20AT 高效液相色谱仪(日本岛津公司);十万分之一电子天平(赛多利斯科学仪器);Photoelectron TECHNOLOGY 色谱柱恒温箱;AP-9901S 真空泵(天津兰博实验仪器)。
1.2 试剂 维生素C 对照品(中国食品药品检定研究院,批号100425-201504;规格:100 mg/支;纯度:100.0%);维生素C 注射液(天津金耀药业有限公司,批号1809301;规格:0.5 g/5 ml);甲醇和乙腈(天津市科密欧化学试剂有限公司,色谱纯);其他试剂均为市售分析纯。
2 方法与结果
2.1 色谱条件 采用Zirchrom Kromasil C18(250 mm×4.6 mm,5 μm)色谱柱;流动相:0.34%(w/v)磷酸二氢钾-氢氧化四丁基铵-乙腈(92.5∶2.5∶5,v/v/v,pH 3.0);流速:0.8 ml/min;检测波长:210 nm;柱温:30 ℃;进样量:20 μl。
2.2 溶液制备
2.2.1 对照品储备液的制备 精密称取0.500 g 维生素C 对照品,用流动相溶解并定容至100 ml,得浓度5 mg/ml 的Vc 对照品储备液,摇匀,冷藏、避光保存。
2.2.2 TNA 处方设计 根据普通成人及住院患者对Vc 的日需求量设计实验中TNA 处方。处方中具体各成分配比见表1。处方0(0 组)为阴性对照组不添加Vc 注射液,其余三组Vc 的含量分别为0.735、1.46 和2.88 mg/ml。四组供试溶液均在局部百级的水平层流台由专业人员按照《静脉用药集中调配质量管理规范》中相关操作规程规范配制,灌装在1 L 营养袋中,室温、避光的条件下放置待测。
2.3 系统适用性及专属性试验 精密吸取“2.2.1”项下对照品储备液15 ml,置100 ml 量瓶中,加入流动相最终配制成含Vc 对照品0.75 mg/ml 的对照品溶液。取处方0(阴性对照组)溶液50 ml,置100 ml 量瓶中,加入对照品储备液15 ml,用流动相稀释至刻度,摇匀,作为样品对照溶液;取处方1 溶液50 ml,置100 ml 量瓶中,用流动相稀释至刻度,摇匀,作为样品溶液;取处方0 溶液50 ml,置100 ml 量瓶中,用流动相稀释至刻度,摇匀,作为阴性对照液,按“2.1”项下色谱条件进样测定,HPLC 色谱图见图1。维生素C 色谱峰保留时间为5.5 min,与相邻峰分离度良好。维生素C 色谱峰位置处无相关干扰,结果表明专属性良好。
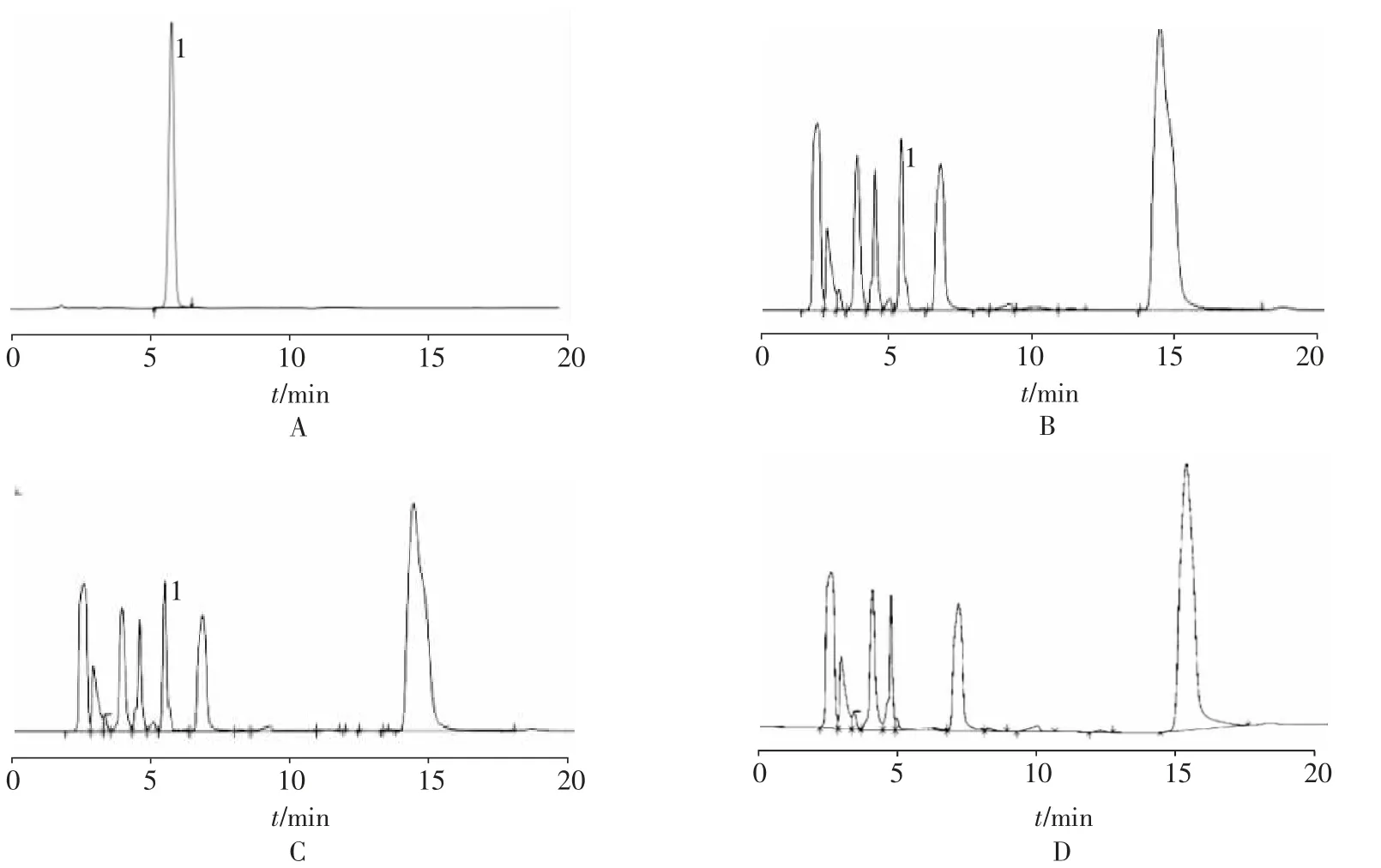
图1 对照品(A)样品对照(B)处方1 供试品(C)阴性对照(D)HPLC 色谱图
2.4 标准曲线的制备 分别精密吸取“2.2.1”项下对照品储备液1.0、2.0、4.0、6.0、8.0、10.0 和12.0 ml 至100 ml 的棕色量瓶中,加入流动相溶液稀释至刻度,避光。按照“2.1”项下的色谱条件进行测定,以各个浓度的维生素C 对照品峰面积(Y)对相应的浓度(X)进行线性回归,得到标准曲线方程式为:Y=27 105X-10 325(r=0.999 8),维生素C 在50~600 μg/ml 浓度范围内呈线性关系。
2.5 精密度试验 精密量取处方1 溶液50 ml,置100 ml 棕色量瓶中,用流动相稀释至刻度,充分混匀,避光,作为供试品溶液。精密量取上述供试品溶液20 μl,按照“2.1”项下色谱条件进行测定,连续进样6 次,记录峰面积,结果RSD 为0.96%。
2.6 重复性试验 精密量取处方1 溶液50 ml,置100 ml棕色量瓶中,用流动相稀释至刻度,充分混匀,避光,作为供试品溶液。同法配制6 份,各取上述供试品溶液20 μl 进样,按照“2.1”项下色谱条件进行含量测定,计算含量RSD 来考查试验的重复性,结果RSD 为1.78%。
2.7 回收率试验 取处方0 溶液,精密量取9 份,每份50 ml,置100 ml 棕色量瓶中,分别精密加入5 mg/ml 的维生素C 对照品储备液5.0(低浓度)、7.5(中浓度)和10.0 m(l高浓度)3 个浓度,流动相稀释至刻度,每个浓度配制3 份,峰面积取平均值计算回收率。按照“2.1”项下色谱条件进样测定,记录峰面积并计算回收率和RSD,结果平均回收率为99.23%,RSD 为1.06%。见表2。
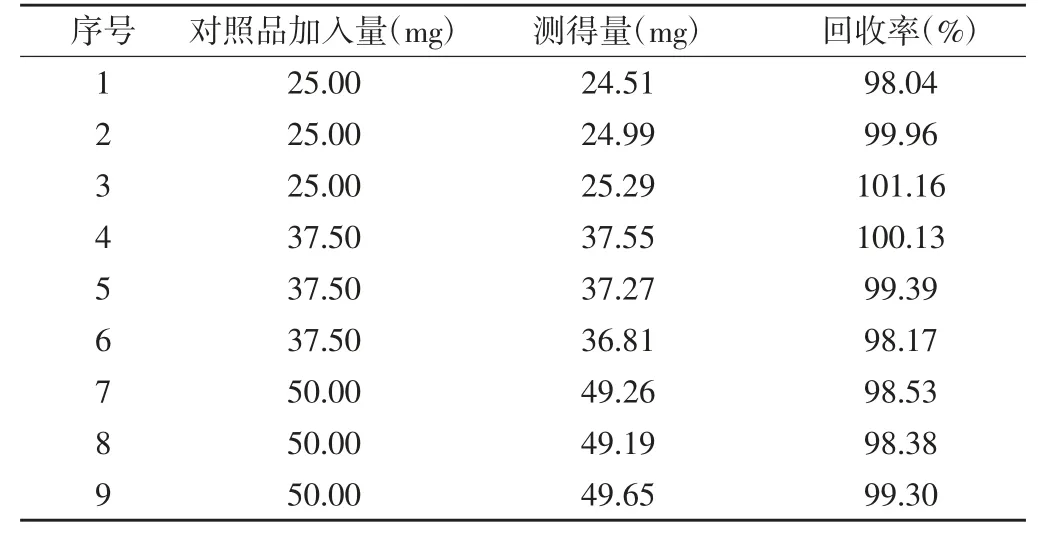
表2 回收率试验结果(n=9)
2.8 样品溶液的含量测定 根据方法学中考查的Vc浓度的线性范围,处方1、处方2 和处方3 分别精密吸取50.0、25.0 和12.5 ml,置100 ml 的量瓶中,用流动相稀释至刻度,充分混匀,避光备用。按照“2.1”项下色谱条件进行含量测定。结果处方1、处方2 和处方3 平均含量分别为0.74、1.46 和2.88 mg/ml,见表3。
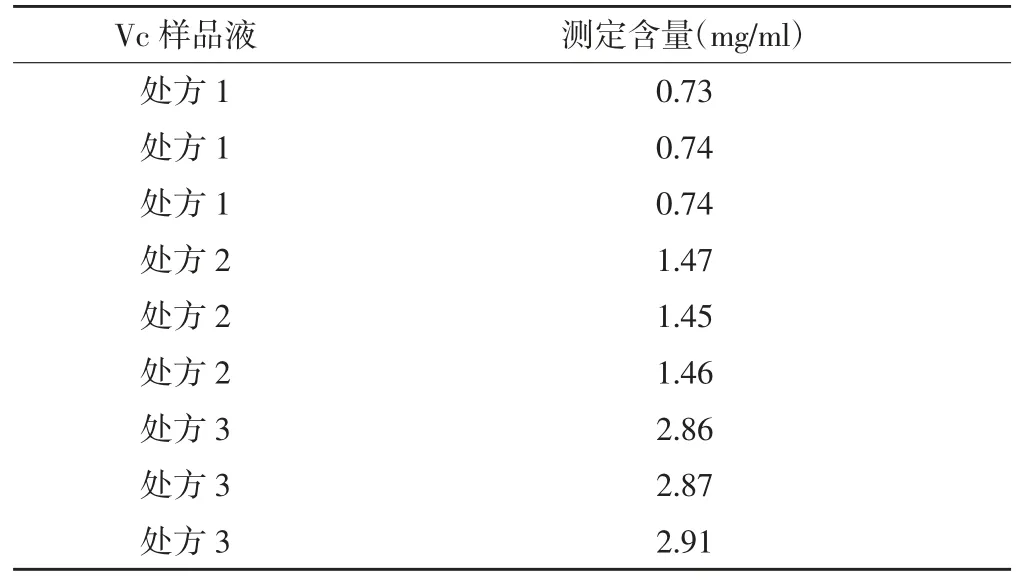
表3 不同处方Vc 样品溶液含量测定结果(n=3)
2.9 TNA 溶液的稳定性 处方1、处方2、处方3 分别在0、4、8、12 和24 h 时取样,按照“2.1”项下色谱条件分别对处方1、处方2、处方3 溶液进行测定,记录峰面积,以每组0 h 时Vc 浓度对应的峰面积为100%,计算每组其他时间点Vc 的相对百分含量。结果见表4。
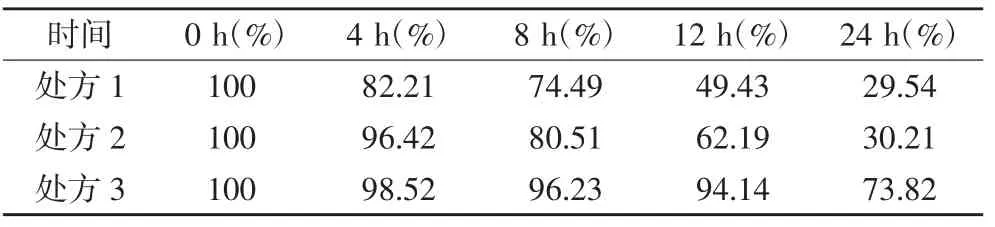
表4 含不同浓度维生素C的TNA 溶液随放置时间的相对含量
3 讨论
3.1 方法学讨论
3.1.1 检测波长的确定 用紫外分光光度计在200 ~800 nm 对维生素C 进行扫描,在波长210 nm 处有最大吸收,故测定波长选择210 nm。
3.1.2 流动相的选择 本试验中样品液为多种组分的TNA 混合液,并且多种物质均有紫外吸收峰,极性与维生素C 相似,很可能干扰维生素C 的含量测定。在早期预试验中,探索正确的流动相时多以参考文献[9]为主,结果不是出峰时间过早导致无法准确测定TNA 中维生素C 含量,就是无法很好分离多组分营养液中的维生素C 峰。经过探索,发现以0.025 mol/L 磷酸二氢钾与0.010 mol/L 四丁基氢氧化铵加入5%的乙腈作为流动相,维生素C 的保留时间在5 min 左右,并可以将相似极性的多种物质与维生素C 的吸收峰分开,峰形良好,不拖尾,分离的大于1.5。
3.1.3 流动相pH 值的确定 由于维生素C 不稳定,具有较强的还原性,易氧化,故其注射剂均添加一定量的抗氧剂来确保其稳定性。根据其在酸性介质中氧化的速度减慢或生成单钠盐而不致发生水解[10],确定流动相应呈偏酸性。当流动相pH 值调为2.0 时,维生素C主峰拖尾严重,而尝试流动相pH 值调节至3.5 时,出现峰形重叠的情况,经过反复探索,调节流动相pH 值为3 时能很好分开极性相似的几个峰,并确保了维生素C 水溶液的稳定。有文献报道[11],当pH 值大于5 时,会导致维生素C 的降解加速,并随着pH 值越来越高,维生素C 降解反应越快。因此,流动相pH 值确定为3.0。
3.2 样品液含量测定 试验数据(表4)显示,各组TNA中Vc 含量随放置时间的延长逐渐下降。1 组和2组分别在放置4 和8 h 后相对含量已经减少到90%以下,根据《中国药典》2015 版规定,即为失去疗效。3组在放置12 h 时,含量仅下降了5.9%;提示TNA 中加入浓度越高的Vc 注射液,其含量下降越慢,可能与Vc 注射液中抗氧剂浓度有关;同时也为进一步研究TNA 中是否可以加入适宜浓度的Vc 注射液奠定了基础。
3.3 其他影响因素 由于维生素C 具有光敏感性,遇空气中的氧气易氧化分解[11],故本试验全程保持避光条件,将配好的样品液及试剂密闭保存,避免与外界的空气长时间的接触。由于样品液为多种注射剂调配而得,而各种注射剂都有相应规格的装量差异,会导致配制的TNA 实际体积与理论体积有所差异。因此在本试验中,样品溶液不同时间的维生素C 含量均以0 h 时测定浓度做比值,计算相对含量,从而排除偶然误差。
4 结论
本文建立了测定肠外营养混合液中Vc 含量的高效液相色谱法,该方法操作简单,快速准确,且分离度和重复性均较好,可用于考查TNA 中Vc 注射液的含量变化。近些年,关于TNA 中加入Vc 注射液稳定性和安全性国内外研究报道较少,该方法的建立可以说为进一步深入研究Vc 注射液加入TNA 中不同浓度,不同配伍的含量变化奠定了基础,同时也为临床肠外营养应用更加安全、有效提供了很好的药学研究路径。

