鱼腥草水溶性多糖的理化性质及体外抗氧化活性
宋也好,李文娟,尹术华,李 露,吴文英,姚于飞
(1.江西中医药大学附属医院,江西 南昌 330006;2.南昌大学食品科学与技术国家重点实验室,江西 南昌 330047)
鱼腥草(HouttuyniacordataThunb)又名蕺菜、折耳根,臭猪菜等,为三白草科植物蕺菜的干燥地上部分,最早记载于《名医别录》,是我国传统美食,也是国家卫生部认证的“药食两用”的品种之一[1]。鱼腥草具有广泛的生物活性,而多糖为其发挥重要生物活性的成分之一。近年来,随着对鱼腥草相关研究的不断深入,国内外研究者们发现鱼腥草多糖(Houttuyniacordatapolysaccharide,HCP)具有抗氧化、抗病毒、抗肿瘤、抗过敏、消炎抑菌及免疫调节等[2-5]生物活性功能。
HCP的理化性质是研究其活性功能的物质基础。2011年Tian等采[6]用高效液相色谱技术分析发现HCP由8种单糖组成,且半乳糖和半乳糖醛酸为其主要成分。2013年Cheng B等[7]采用DEAE Sepharose CL-6B和Sephacryl S-400 HR柱分离出分子量为60 kDa且单糖组成只有半乳糖醛酸的纯多糖HCP-2,并确定其是半乳糖醛酸残基构成的果胶类多糖。2018年Kun等[8]从鱼腥草中得到相对分子量为21.7 kDa的水溶性果胶多糖HCA4S1,其单糖组成为半乳糖、鼠李糖、阿拉伯糖和半乳糖醛酸。2019年Cheng D等[9]从鱼腥草水提物中纯化出分子量为43 kDa果胶类酸性多糖,其主要单糖也是半乳糖醛酸和半乳糖,且单糖种类与Tian等的研究结果相同。综上所述,不同分析方法得到的HCP的单糖组成、分子量及理化性质不尽相同,亟需应用先进的实验手段去验证并继续研究HCP的基础理化特性和活性功能。
因此,本实验采用水提醇沉法、Sevag除蛋白技术从鱼腥草中获得HCP,综合运用现代仪器分析技术研究HCP的基础理化性质(包括中性糖、糖醛酸和蛋白质含量)、分子量、单糖组成、光谱学特性以及固态形貌特征,同时用DPPH自由基和·OH清除法来评价HCP的体外抗氧化活性,旨在为后续HCP精细结构解析及生物活性功能探究提供基础。
1 材料与方法
1.1 材料与试剂
鱼腥草来源于江西中医药大学附属医院药房,江西江中中药饮片有限公司生产,执行标准:《中国药典》2015年版一部。
1,1-二苯基-2-苦基肼(DPPH,分析纯)(美国Sigma公司);2,6-二叔丁基对甲苯酚(BHT,分析纯)(阿拉丁试剂有限公司);牛血清蛋白(美国Amersco公司);考马斯亮蓝G-250、溴化钾(KBr)(美国Fluka公司);葡聚糖(Dextran)标准品(T-10、T-40、T-50、T-70、T-500、T-2000)(美国Pharmacia公司);单糖标准品(L-岩藻糖Fuc、鼠李糖Rha、D-阿拉伯糖Ara、D-半乳糖Gal、D-葡萄糖Glc、D-木糖Xyl、D-甘露糖Man、D-果糖Fru、半乳糖醛酸GalA、葡萄糖醛酸GlcA)(美国Sigma公司);氯仿、正丁醇、咔唑、苯酚、水杨酸等均为分析纯。
1.2 仪器与设备
R-220 SE型旋转蒸发仪(瑞士BUCHI公司);2 L立式冷冻干燥机(美国LABCONCO公司);TU-1900双光束紫外分光光度计(北京普析通用仪器有限责任公司);Nicolet 5700傅立叶红外光谱仪(美国Thermo公司);Dionex ICS 5000离子色谱仪(美国Dionex公司);Agilent 1260高效液相色谱仪(美国Agilent Technologies公司);JSM6701F场发射扫描电镜带能谱仪(日本电子株式会社);多功能全自动酶标仪(美国Thermo公司)。
1.3 方法
1.3.1 HCP的提取
称量粉碎后的鱼腥草200 g,用95%乙醇浸泡过夜,过滤后烘干。将已经脱脂处理的鱼腥草按照料液比1:20加入超纯水,置于恒温水浴锅中在95℃条件下搅拌2 h,将过滤后的滤渣重新提取1次,合并两次滤液于55℃减压浓缩至原体积的1/5,再加入乙醇沉淀12 h(使乙醇终体积分数达到80%),离心收集多糖沉淀物。多糖复溶后加入Sevag试剂脱蛋白4次[10](多糖溶液:Sevage试剂=4:1;Sevage试剂=氯仿:正丁醇=4:1 v/v)。除有机溶剂后把多糖溶液装进孔径为8 000~14 000 Da透析袋中,用自来水、蒸馏水和超纯水分别透析24 h以去除小分子物质。最后旋转蒸发多糖溶液对其进行浓缩处理,真空冷冻干燥后获得鱼腥草精制多糖。
1.3.2 基本理化性质的测定
计算多糖得率,按公式(1):多糖得率/%=(多糖质量/原料质量)×100%
(1)
分别用苯酚-硫酸法[11]、硫酸-咔唑法[12]和考马斯亮蓝法[13]测定HCP中的中性糖含量、糖醛酸含量和蛋白质含量。
1.3.3 光谱特性分析
紫外光谱特性分析:将HCP配制成0.1 mg-1的溶液,以去离子水为空白对照,采用TU-1900紫外分光光度计于200~800 nm波长下进行扫描。
红外光谱特性分析:蘸取微量HCP粉末,在干燥条件下与溴化钾(KBr)混合研磨并压制成透光薄片,以KBr作空白对照,使用Nicolet 5700傅里叶红外光谱仪在400~4 000 cm-1波数下进行扫描[14]。
1.3.4 分子量测定
通过高效凝胶渗透色谱法(HPGPC)鉴定HCP的纯度并测定其相对分子量[15]。将HCP溶解在含0.02%叠氮钠水溶液中,配制1 mg·mL-1的多糖样品,过0.22 μm水系滤膜后经Agilent 1260色谱仪进行测定。使用不同分子量葡聚糖标准品(T-10、T-40、T-50、T-70、T-500、T-2000)构建标准分子量与洗脱时间的标准曲线。
色谱条件:配有示差检测器(RID)和紫外检测器(DAD2996),色谱柱为UltrahydrogelTM线性凝胶柱(300 mm×7.8 mm)。流动相为0.02% NaN3水溶液,柱温箱和示差检测器温度均为35 ℃,流速保持在0.6 mL·min-1,进样量为20 μL。
1.3.5 单糖组成分析
采用高效阴离子交换色谱-脉冲安培法测定鱼腥草多糖的单糖组成[16]。前处理:精密称量5 mg鱼腥草多糖粉末到20 mL具塞试管中,在低温条件下缓慢加入12 mol·L-1的浓硫酸0.5 mL,在磁力搅拌器下搅拌30 min之后加入2.5 mL超纯水,在100 ℃的条件下油浴3 h进行水解处理,待冷却稀释一定倍数后过0.22 μm水系滤膜,进样分析。选取10种单糖标准品(L-岩藻糖Fuc、鼠李糖Rha、D-阿拉伯糖Ara、D-半乳糖Gal、D-葡萄糖Glc、D-木糖Xyl、D-甘露糖Man、D-果糖Fru、半乳糖醛酸GalA、葡萄糖醛酸GlcA)配制成混合标准品,作为标准对照。
离子色谱条件:配有脉冲安培检测器(PDA),色谱柱为CarboPacTMPA20保护柱(3 mm×150 mm)和CarboPacTMPA20分析柱(3 mm×30 mm)串联使用。流动相分别是250 mM NaOH溶液(A)、1 M NaOAc溶液(B)和超纯水(C),流速为0.5 mL·min-1,柱温为30 ℃,进样量为10 μL,按照一定的梯度洗脱程序进行洗脱。梯度洗脱程序如表1所示:
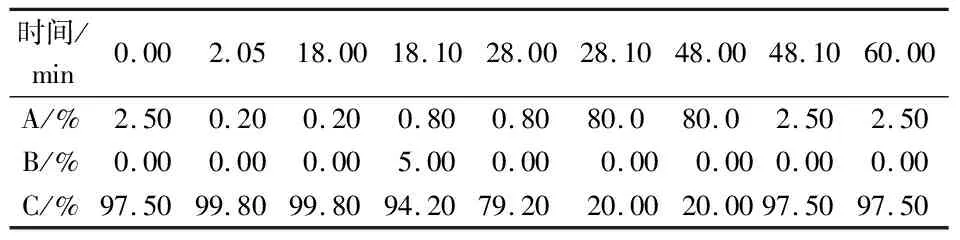
表1 离子色谱法梯度洗脱程序表
1.3.6 SEM分析
将HCP固体复溶后配成1.0 mg-1水溶液,重新冷冻干燥成疏松结构后,蘸取微量于导电胶上,进一步进行喷金处理提高导电性,使用JSM6701F场发射扫描电镜于2000×,10 000×倍数下对样品进行扫描观察其形貌特征。
1.3.7 抗氧化活性研究
1.3.7.1 对DPPH自由基的清除能力
参照Chen等[17]的实验方法并进行略微修改来测定HCP对DPPH自由基的清除能力。方法:采用BHT为阳性对照组,配置一定浓度梯度(0.1,0.2,0.4,0.8,1.6 mg-1)的多糖和BHT样品溶液,加入DPPH(0.1 mmol·L-1)试剂,混匀后于37 ℃恒温箱中避光反应30 min,取200 μL溶液转移至96孔板中,用酶标仪在517 nm下测定其吸光度值,每个样品平行测定3次。用式(2)计算DPPH自由基清除率。
A1:0.2 mL样品溶液+0.5 mL DPPH
A2:0.2 mL样品溶液+0.5 mL 95%乙醇
A0:0.2 mL去离子水+0.5 mL DPPH
清除率/%=(A0-A1+A2)/A0×100%
(2)
式中:A0为空白组吸光度;A1为样品组吸光度;A2为样品对照组吸光度。
1.3.7.2 对羟基自由基(·OH)的清除能力
参照Bi等[18]测定方案并进行适当调整来测定HCP对·OH的清除能力。方法:以BHT作为阳性对照组,配置一定浓度梯度(0.1,0.2,0.4,0.8,1.6 mg·mL-1)的多糖和BHT样品溶液,依次加入硫酸亚铁(FeSO4,9 mmol·L-1)和过氧化氢(H2O2,6 mmol·L-1)溶液混匀后,在37℃避光反应10 min,然后加入水杨酸(9 mmol·L-1)继续在37 ℃避光反应30 min,待反应完全之后吸取200 μL溶液转移至96孔板中,用酶标仪在510 nm下测定吸光度值,每个样品平行测定3次。用式(3)计算·OH清除率。
A1:0.2 mL样品溶液+0.2 mL FeSO4+0.2 mL H2O2+0.2 mL水杨酸
A2:0.2 mL样品溶液+0.2 mL FeSO4+0.2 mL去离子水+0.2 mL水杨酸
A0:0.2 mL去离子水+0.2 mL FeSO4+0.2 mL H2O2+0.2 mL水杨酸
清除率/%=(A0-A1+A2)/A0×100%
(3)
式中:A0为空白组吸光度;A1为样品组吸光度;A2为样品对照组吸光度。
2 结果与分析
2.1 得率和基本理化性质分析
HCP冻干后是易溶于水的褐色疏松固体。如表2所示,由本实验室提取的HCP的得率约为2.79%,与前人的文献报道相比较低,原因可能是脱蛋白四次会损耗部分糖液,从而降低提取率。基础理化数据显示,HCP的总糖含量达到了91.6%(中性糖含量和糖醛酸含量的总和),糖醛酸的含量达到51.11%,蛋白质含量为3.16%,说明该多糖为酸性多糖且可能含部分结合蛋白。
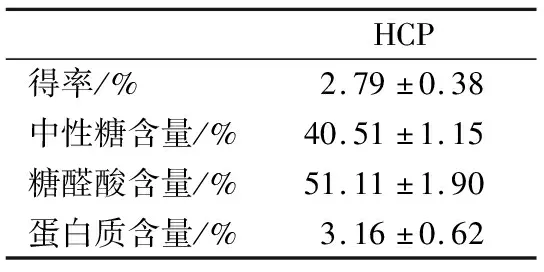
表2 HCP的得率和基本理化性质
2.2 光谱特性分析
将HCP在紫外检测器工作波长200~800 nm扫描后,其紫外光光谱图如图1所示,发现HCP在280 nm波长左右处有蛋白质吸收的特征峰,说明该糖含有蛋白质成分。通过红外光谱扫描法可初步解析多糖的特征官能团构成。观察图2可知:3 356 cm-1处有较宽的强吸收峰是-OH的伸缩振动,属于糖类的特征吸收峰。多糖中甲基类的-CH伸缩振动吸收峰在2 933 cm-1左右处有吸收。1 427 cm-1处的吸收应该是糖类的-CH变角振动产生的。上述三个峰为多糖共有的吸收峰,由此可确定其为多糖[19]。1 743~1 631 cm-1附近的吸收可能为羧基中的C=O的不对称伸缩振动,也是糖醛酸的特征吸收峰[20]。800~1 200 cm-1之间的区域被称为碳水化合物的指纹区域,给样品的结构差异提供了良好指示。1 100~1 018 cm-1之间的强吸收应为C-O和C-O-C的伸缩振动,为吡喃糖环吸收峰[21]。900~700 cm-1为糖类的环振动吸收区,其在828 cm-1的弱吸收可能为α-D-半乳吡喃糖或β-D-阿拉伯吡喃糖的特征吸收峰[22]。上述红外光谱图分析结果表明HCP是一种缀合蛋白的果胶类酸性多糖,且具有吡喃糖结构。
2.3 纯度及分子量分析
HPGPC法是按照高聚物分子量的尺寸以及大小进行逐级分离的,分子量大的高聚物先出峰,而分子量小的高聚物后出峰。HCP的HPGPC见图3,观察发现其在10~16 min之内只有单峰出现且对称性较好,由此得知HCP为纯度较高的均一组分。图中多糖洗脱时间是12.791 min,依据葡聚糖标准品曲线方程计算得到HCP的重均相对分子量为3.87×105Da。
2.4 单糖组成分析
混合单糖标准品和HCP水解样品的离子色谱图见图4,分析可知该多糖是由鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、半乳糖醛酸、葡萄糖醛酸这8种单糖组成,经计算得其物质的量比为6.44:
8.98:16.32:10.32:3.32:1.80:39.12:1.00。如表3所示,经酸水解的HCP样品中,半乳糖醛酸的含量最高,为15.57%,其次是半乳糖和葡萄糖,也再次验证了HCP为酸性的果胶类多糖。HCP经水解后的糖含量显著低于常规化学方法测定的糖含量,因为该方法不能完全将HCP水解为单糖,可能是由于糖醛酸之间的糖苷键更加难以断裂[23]。
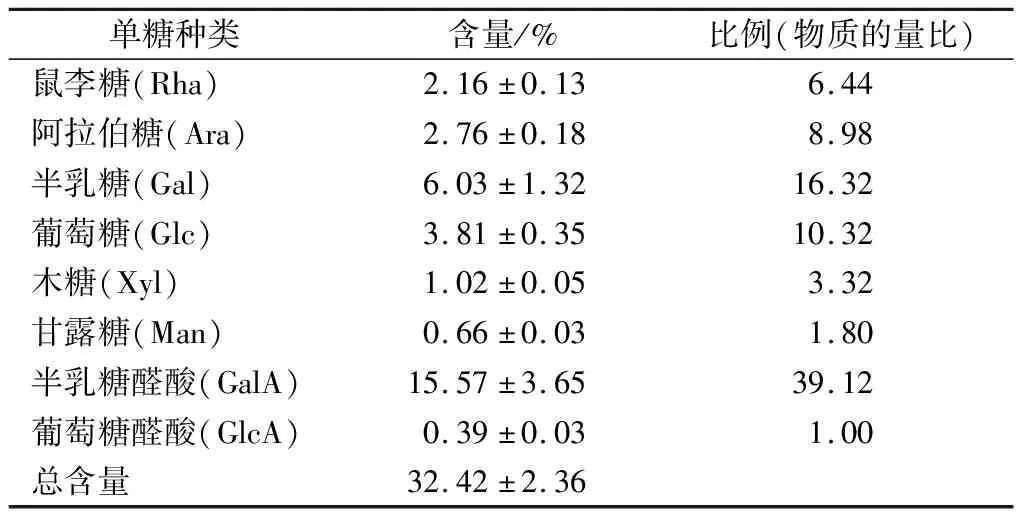
表3 HCP的单糖组成
2.5 SEM分析
扫描电镜主要是根据电子束与试样表面物质相互作用产生效应,并放大样品结构图像从而获得样品的形貌信息,可作为表征多糖性质的一种定性工具[24]。HCP在扫描电镜下被放大2 000和10 000倍的固态形貌如图5所示,由图可知其主骨架为条杆状物质,部分丝状物质相互缠绕成非均匀的网状结构,还有少量球状物质通过细丝附着杆状物质表面,使HCP呈现蓬松质轻的表观形态。
2.6 抗氧化活性分析
DPPH自由基在醇溶液中稳定存在时呈现紫色,遇到抗氧化物时可使DPPH自由基孤对电子被配对而导致溶液变成淡黄色[25],这是评价抗氧化程度的典型指标之一。HCP清除DPPH自由基的能力如图6所示,当HCP质量浓度在0.1~0.8 mg-1范围内时,多糖质量浓度与DPPH自由基的清除能力几乎呈现正比例上升状态。当多糖质量浓度达到1.6 mg-1时,HCP清除DPPH自由基的能力接近峰值达到87.18%,与BHT的清除效率基本相当,说明HCP对DPPH自由基的清除效果强。HCP的清除自由基的作用机制可能是多糖的某些功能基团可与自由基相互作用,终止相应的自由基链反应,形成稳定的聚合物分子,起到抗氧化保护作用[26]。
·OH是一种具有很强的得电子能力且其活性仅次于氟的活性氧自由基,它可以穿过细胞膜作用于蛋白质、脂质、核酸等生物分子引起氧化损伤导致细胞凋亡从而引发衰老等各种疾病[27]。因此,清除有害的·OH可以保护机体正常生命活动。HCP对·OH的清除效果见图7,由图可知HCP质量浓度与清除·OH的效率呈现一定的量效关系,清除率随着剂量的增加而上升。当HCP浓度为0.1 mg-1时,对·OH清除效率较低为7.46%。当HCP质量浓度达到1.6 mg-1时,对·OH的清除率上升至31.37%,但是与BHT对照组相比,其抗氧化能力相对较弱。HCP的抗氧化作用机理可能是多糖链上可产生游离的氢原子,然后与·OH结合生成水,从而达到清除·OH作用;也有可能是多糖中的糖醛酸与Fe2+产生耦合作用从而抑制自由基产生,提高还原力[28]。
3 结论
天然产物来源多糖的结构与功能研究在食品、保健品以及药品等领域已经成为一大热点[29],特别是来源丰富的食源性多糖具有良好的应用价值和市场开发前景。现代研究证实HCP具有消炎镇痛、抗病毒和肠道保护等活性功能[30],因此其基本结构特征的研究具有重要意义。本实验采用水提醇沉法并经脱蛋白处理后从鱼腥草中提取出水溶性多糖并对其理化性质进行了比较全面的测定,结果发现HCP是一种重均相对分子量为3.87×105Da的均一酸性果胶类多糖,且总糖含量高达91.62%(其中糖醛酸含量为51.11%,中性糖含量为40.51%)。HCP的单糖组成主要为半乳糖醛酸和半乳糖,主要由丝状、杆状和球状物质组成,并且对DPPH自由基和·OH呈现较好的清除效果。本研究可为后续深入探究HCP精细结构信息和活性功能奠定了一定的基础,有利于鱼腥草资源的综合利用与开发。

