探讨嵌合内含子对非小细胞肺癌细胞系PC-9上皮间质转化的影响
廖 亮,杨国辉
(1.贵州医科大学,2.贵州医科大学附属医院MICU,贵州 贵阳 550004)
非小细胞肺癌(non-small cell lung cancer,NSCLC)是临床上多发的几种恶性肿瘤之一,国外报道约占肺癌患者总人数的80%[1]。近年来,随着医学及分子生物学等相关领域研究的进展,肺癌早期诊断、治疗和预后均取得了长足进步,但患者5年生存率仍在15%左右[2],而其中原因之一是肺癌细胞在人体内的过早转移。在非小细胞肺癌中上皮-间质转化(epithelial-mesenchymal transformation,EMT)在肿瘤细胞侵袭和转移过程中起着重要而独特的作用[3-5],有研究表明它是肿瘤发生和发展过程中的一个机制复杂的生物学行为[3]。当发生上皮-间质转化时,肺泡上皮细胞将失去原来正常的细胞极性,并逐步获得间质细胞的某些特点,例如增强的迁移和侵袭能力等,同时,还伴随着相关基因表达的改变[6],其中N-钙黏蛋白(N-cadherin)、β-连环蛋白(β-catenin)和转录因子(Snail)等已成为检测EMT发生的特异分子标记物[7,8]。
嵌合内含子(chimeric intron)是由人β-球蛋白第一个内含子5'端剪切序列与人免疫球蛋白IgG重链可变区中内含子3'端剪切序列组合而成[9]。有研究表明,嵌合内含子能够提高蛋白在体外的表达[10-12]以及能显著促进氯霉素乙酰转移酶基因(chloramphenicol acetyltransferase,CAT)在小鼠体内的表达[10]。还有研究证实,它能提高绿色荧光蛋白(green fluorescent protein,GFP)在293T细胞中的表达[13]。在中华仓鼠卵巢细胞(Chinese hamster ovary cells,CHO)中还能大幅度提高重组神经生长因子的表达,并且证明其调控转基因表达具有方向性[14]。因此,本研究的目的是通过在非小细胞肺癌细胞株PC-9中表达嵌合内含子重组质粒,观察其对肿瘤细胞转移、侵袭能力的改变以及对上皮-间质转化的影响。
1 材料与方法
1.1 材料
细胞1640培养基、胎牛血清和0.25%胰蛋白酶购自Gibco公司;Matrigel转移小室由Corning公司生产;DNA转染试剂购自北京码因生物科技公司;总RNA提取Trizol试剂以及PCR试剂购自Invitrogen公司;gDNA Eraser、Reverse Transcription、T4 DNA Ligase试剂盒以及SYBR®Green试剂盒购自Takara公司;PCR仪购于美国赛默飞公司StepOnePlusTM;双荧光酶检测试剂采用购自于GeneCopoeia公司的Luc-PairTMDuo-Luciferase;psiCHECK-2载体购自于美国Promega公司;Western Blotting多克隆抗体以及二抗均购自美国赛默飞(ThermoFisher)公司。PC-9细胞及E.coliDH5α感受态由本实验室保存;引物由上海生工公司合成。
1.2 方法
1.2.1psiCHECK-2-Intron重组质粒的构建 以psiCHECK-2中的内含子为模板,根据psiCHECK-2质粒图谱(图1)[15],分别设计包含有相关酶切位点的特异性引物,由上海生工公司合成,见表1。此嵌合内含子已存在于psiCHECK-2双荧光素酶报告载体SV40启动子的下游。利用PCR技术将扩增内含子目的基因片段。然后将目的基因产物插入并连接到海肾荧光素酶报告基因的下游多克隆位点,再转化感受态DH5α,涂布LB平板,挑取单克隆后进行增菌培养,分别用于PCR鉴定和基因测序鉴定。

表1 引物序列Tab 1 Primer sequence
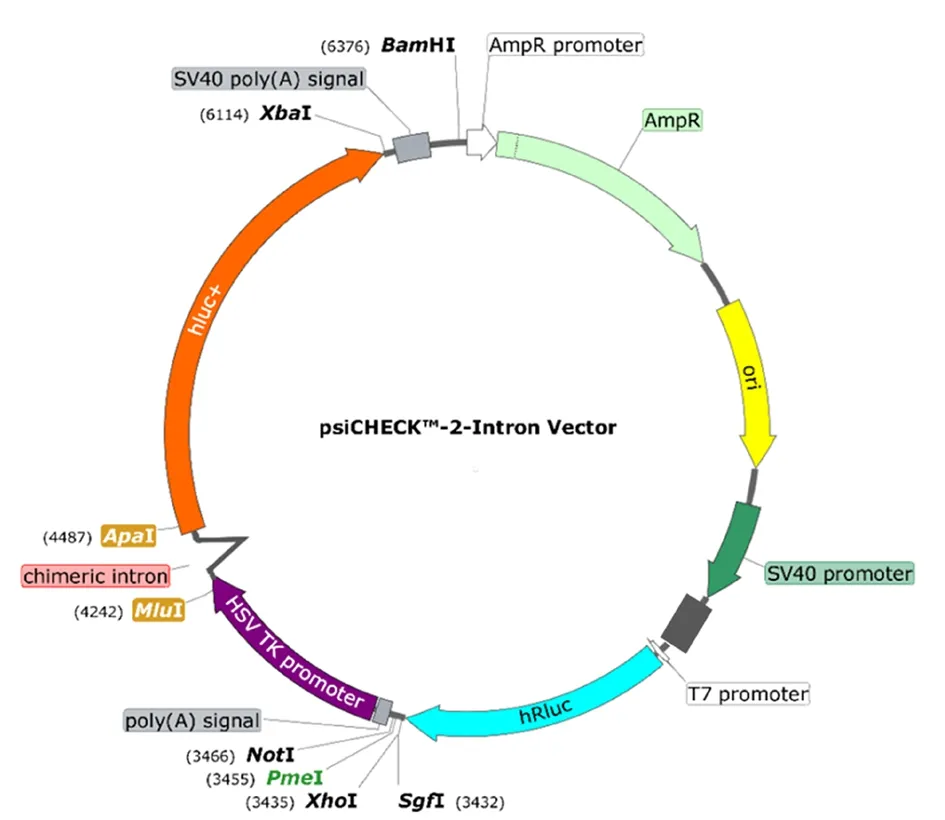
图中箭头方向代表基因转录方向。hRluc+代表海肾荧光素酶cDNA。hluc+代表萤火虫荧光素酶cDNA。ApaI和MluI分别代表两个酶切位点。hluc+上游∧符号代表插入的嵌合内含子基因。图1 psiCHECK-2-Intron重组质粒载体结构图Fig 1 psiCHECK-2-Intron recombinant plasmid vector structure diagram
1.2.2细胞培养和转染 在含10%小牛血清的1640培养基中加入非小细胞肺癌细胞株PC-9并用移液枪充分吹打混匀,放置在培养箱中,温度为37 ℃,CO2浓度为5%,培养48 h,每间隔24 h更换培养基一次,待细胞完全贴壁以后,用0.25%胰蛋白酶消化并传代,psiCHECK-2-Intron质粒转染PC-9细胞按照英格恩公司EntransterTM-H4000转染试剂说明书进行操作。
1.2.3实时荧光定量聚合酶链反应(qRT-PCR) 按照Invitrogen公司说明书使用Trizol试剂提取转染细胞的总RNA,并按照Takara公司逆转录的方法合成cDNA。引物由生工(上海)公司合成(见表1)。PCR反应体系分别包括cDNA0.5 μL,2×Taq Master Mix 10 μL,上下游引物各0.5 μL,无菌水8.5 μL。参数设置:95 ℃预变性2 min,再进行95 ℃,30 s;65 ℃,30 s;72 ℃,30 s(总共30个循环),最后72 ℃,5 min延伸。PCR扩增产物长度通过琼脂糖凝胶电泳进行验证。数据分析采用2-ΔΔCt法计算。
1.2.4双荧光素酶活性检测 将PC-9细胞从-80 ℃冰箱取出,每个孔加入80 μL细胞裂解液。在摇床中以250 r/min,20 ℃,10 min充分摇匀使细胞裂解。准备一个黑色96孔检测板,每个样品分3次重复孔加入,然后每孔分别加入已事先准备好的两种底物SubⅠ和SubⅡ,上机检测(BioTek Synergy 2多功能酶标仪)。通过计算海肾荧光素酶与萤火虫荧光素酶底物荧光比值来测定荧光素酶的相对活性。
1.2.5细胞划痕实验 将细胞以适当的密度接种到12孔板中,并且当细胞粘附至壁后24 h后将其转染。48 h后使用100 μL移液管枪头在融合细胞层上垂直划出一条直线。用PBS洗涤细胞3次,去除划下的多余细胞后,加入含4%胎牛血清的培养基培养,此时记录为0 h。在0~24 h内,使用显微镜记录同一位置的刮擦宽度。划痕愈合率(%)= [划痕宽度(T0-T24)/划痕宽度T0]×100%(T0表示在0 h处的划痕宽度,T24表示24 h之后的划痕宽度)。实验被独立地重复3遍,并且从每个孔中随机选择3个位置记录,从每个孔中取平均值以进行统计分析。
1.2.6Matrigel细胞侵袭实验 用Matrigel基质胶和1640培养基按1∶8比例混匀稀释,取100 μL均匀铺在Transwell上室,放入37 ℃培养箱孵育1 h。按每孔2×105个细胞接种于Transwell的上室,并加入200 μL无血清1640培养基。在Transwell的下室加入1640完全培养基600 μL,培养48 h后用医用灭菌棉棒轻轻拭去上室的细胞,再用甲醇溶液将细胞固定30 min,然后用结晶紫染料进行细胞染色20 min,最后将残余的染料用PBS缓冲液洗去。重复3次,每次在显微镜下随机选择3个观察野并进行人工计数,记录均数用于统计分析。
1.2.7蛋白质印迹(Western Blotting) 将psiCHECK-2空白载体和psiCHECK-2-Intron重组质粒载体转染至PC-9细胞中,72 h后,用PIPA裂解液裂解细胞提取总蛋白,用BCA法检测蛋白质浓度并制备样品。配置SDS-PAGE胶,每孔上样蛋白样品25 μg,蛋白质电泳后转移至PVDF膜上,加入5%BSA封闭1 h,再加入稀释的一抗,4 ℃孵育过夜,用TBST溶液漂洗3次,每次10 min,然后加入羊抗兔(二抗),37 ℃孵育2 h,TBST重复漂洗3次,每次10 min,HRP化学发光液显影,GAPDH做为内参。
1.3 统计学处理
2 结果
2.1 psiCHECK-2-Intron质粒的构建
以psiCHECK-2载体为模板,利用含ApaI和MluI酶切位点的引物扩增Intron基因,设计长度为133 bp,进行实时荧光定量PCR扩增。将PCR扩增产物做琼脂糖凝胶电泳实验,目的片段长度和预期结果相符,见图2A。然后将psiCHECK-2质粒和Intron目的片段双酶切(ApaI和MluI),回收酶切产物,用T4 DNA连接酶在16 ℃水浴中进行连接,获得重组载体psiCHECK-2-Intron后,将其转化入DH5α感受态细菌,经氨苄青霉素LB平板筛选后,挑取单克隆,PCR鉴定,见图2B。
2.2 重组载体psiCHECK-2-Intron的测序鉴定
将PCR鉴定成功的阳性克隆送至上海生工进行测序鉴定,结果证实插入的chimeric intron基因序列正确,无突变和缺失,表明重组质粒psiCHECK-2-Intron构建成功,见图3。
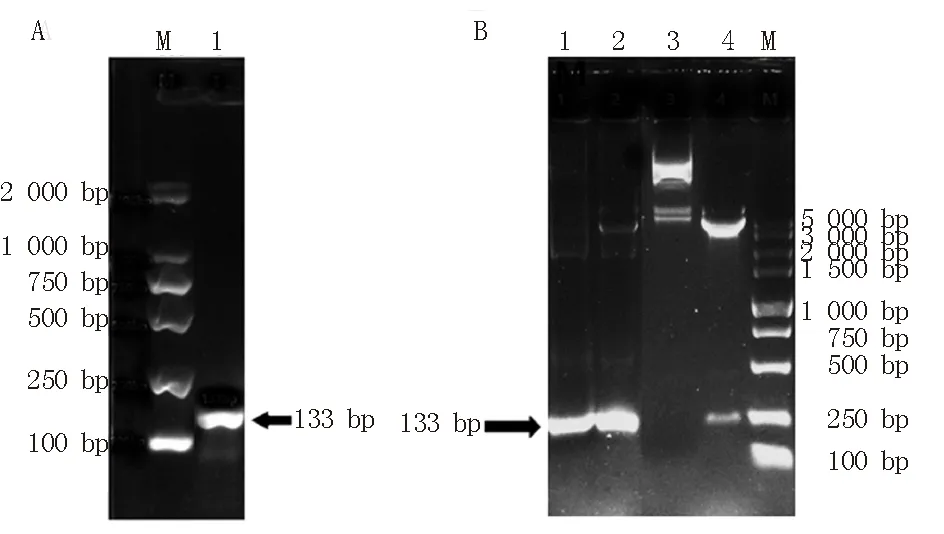
A:M:DL2000 DNA Marker;1:Intron基因扩增结果 B:M:DL5000DNAMarker:1:Intron目的片段 2:Intron目的片段双酶切 3:psiCHECK-2-Intron质粒4:psiCHECK-2-Intron质粒双酶切图2 Intron目的基因以及psiCHECK-2-Intron质粒双酶切及PCR鉴定Fig 2 Intron target gene and psiCHECK-2-Intron plasmid double restriction digestion and PCR identification

图3 重组质粒psiCHECK-2-Intron部分测序结果(方框内为插入的嵌合内含子目的基因片段序列)Fig 3 Partial sequencing results of recombinant plasmid psiCHECK-2-Intron (the sequence of the inserted chimeric intron target gene fragment is in the box)
2.3 RT-PCR鉴定psiCHECK-2-Intron在细胞中的转录
将构建成功的psiCHECK-2-Intron重组质粒转染至PC-9细胞并裂解,用Trizol提取总RNA,经逆转录得到cDNA,利用合成引物qRL和qFL;PCR扩增出海肾荧光素酶及萤火虫荧光素酶目的基因片段,见图4。长度分别122 bp和174 bp。结果表明,重建的psiCHECK-2-Intron质粒能够在PC-9细胞中正确转录。

M:DL2000 DNA Marker;1:海肾荧光素酶基因片段122bp(A图)&萤火虫荧光素酶基因片段174 bp(B图);2:psiCHECK-2-Intron质粒(双酶切)图4 psiCHEKC-2-Intron转染PC-9细胞后PCR鉴定结果Fig 4 PCR identification results of PC-9 cells transfected with psiCHEKC-2-Intron
2.4 双荧光素酶报告基因检测psiCHECK-2-Intron在真核细胞中的表达
将psiCHECK-2空白载体作为对照,转染至PC-9细胞中的psiCHECK-2-Intron质粒所携带的两种荧光素酶报告基因表达后所发出的特定波长的荧光均可被BioTekSynergy 2多功能酶标仪所检测到,见图5。证实两种荧光素酶基因均能够在PC-9细胞中顺利表达。与对照组比较,差异有统计学意义(P<0.001)。
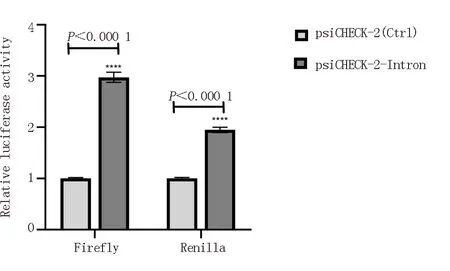
图5 双荧光素酶报告基因检测海肾和萤火虫两种荧光素酶表达活性Fig 5 Dual luciferase reporter gene detection of renilla and firefly luciferase expression activity
2.5 Intron对PC-9细胞迁移的影响
将psiCHECK-2空白载体作为对照组,psiCHECK-2-Intron作为实验组,通过细胞划痕实验检测嵌合内含子表达对PC-9细胞迁移的影响。24 h后,空白对照组划痕愈合度为(63.460±1.745)%,内含子组的愈合度为(41.370±1.672)%,见图6。以上结果表明嵌合内含子抑制了PC-9细胞的迁移能力(P⟨0.001)。
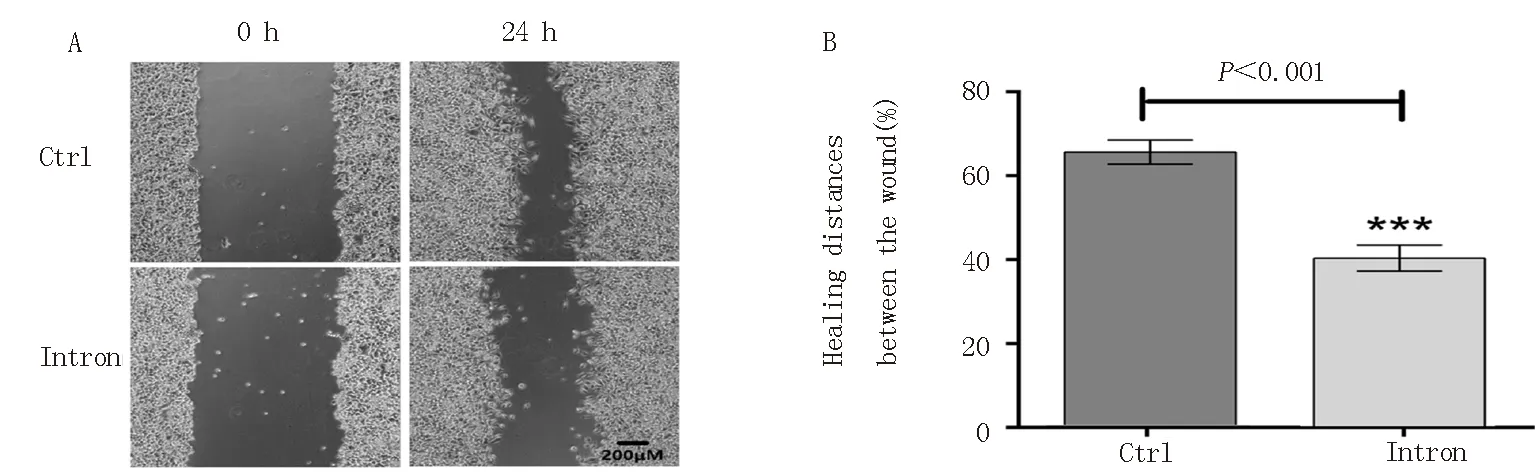
A:细胞划痕图片,B:划痕愈合度(%)计数柱状图图6 chimeric intron表达对PC-9细胞迁移能力的影响Fig 6 The effect of chimeric intron expression on the migration ability of PC-9 cells
2.6 Intron对PC-9细胞侵袭的影响
Matrigel侵袭实验结果显示,对照组中穿过基质胶的细胞数为(98.430±3.000)个,Intron组为(41.670±4.163)个,见图7。提示内含子组的PC-9细胞侵袭能力降低(P<0.001)。

A:细胞侵袭图片 B:细胞计数柱状图图7 嵌合内含子表达对PC-9细胞株侵袭能力的影响Fig 7 The effect of chimeric intron expression on the invasion ability of PC-9 cell line
2.7 Intron对EMT相关分子标记物表达的影响
将psiCHECK-2-Intron表达重组质粒载体转染至PC-9细胞,48 h后通过Western-blotting和qRT-PCR实验分别从蛋白和mRNA水平检测N-cadherin、β-catenin、以及Snail 3种EMT相关分子标记物的表达情况。与对照组相比,Intron组明显降低了N-cadherin、β-catenin和Snail的表达(P<0.001,P<0.01),见图8。

A:qRT-PCR检测N-cadherin、β-catenin、Snail的表达。B:Westernblotting检测N-cadherin、β-catenin、Snail的表达图8 嵌合内含子对上皮间质转化相关分子标志物表达的影响Fig 8 The effect of chimeric introns on the expression of molecular markers related to epithelial-mesenchymal transition
3 讨论
影响外源基因表达的因素有很多,比如启动子、沉默子、增强子、信号肽及所处的表达条件等[13]。在哺乳动物中,内含子作用和功能直到最近才被人们所认识[16]。某些特定的内含子可能包含一个或多个可以促进基因表达的生物学特征,有研究表明内含子可能包括了某些增强元件[17]或特定序列[18]从而促进了翻译的过程。还有一些内含子对于基因的表达有直接或间接的抑制作用[19,20]。而且内含子在不同细胞系中的作用也存在差异,Huang等[21]讨论了嵌合内含子序列IVS对氯霉素转乙酰酶(CAT)在不同细胞中的表达的影响,他们发现CAT表达活性最高的是在中华仓鼠卵巢细胞系(CHO)中,其次是在人肾上皮细胞系(293T)中,最低的是在海拉细胞系(Hela)中。另外,内含子上游不同的启动子对其功能的发挥也存在影响,Xu等[22]比较了内含子在两个启动子SV40与CMV的启动下对荧光素的表达的影响,发现CMV是SV40作用的两倍。
为了研究内含子在肺癌中的作用,本实验通过双荧光素酶报告载体将内含子插入到海肾荧光素酶下游的多克隆位点构建重组质粒,转染至PC-9细胞株中得以表达,研究其对PC-9细胞侵袭、转移能力以及EMT的影响。采用细胞划痕实验和Matrigel侵袭实验模拟肿瘤细胞在人体中的迁移和侵袭过程,显示PC-9细胞侵袭能力的降低。然后进一步检测了上皮-间质转化相关3种分子标志物:N-cadherin、Snail和β-catenin的表达量的变化,发现嵌合内含子下调了以上3种标志物的表达,这说明该内含子在一定程度上抑制了PC-9细胞上皮间质转化的能力。本研究选择PC-9细胞株作为受试细胞,是因为它具有培养简单,细胞容易贴壁和高转染效率等优点[23]。
本研究中应用了由Promega公司研发的双荧光素酶报告载体(psiCHECK-2TM),它同时携带了以上两种报告基因,这样能够在一次实验中同时检测两种荧光素酶活性,而不必分开进行检测,从而进一步提高了实验操作的效率,节省了时间,而且也能在很大限度上减少样本污染的机率,同时也在最大程度上减少了不同批次内和批次间的实验结果之间的差异,为科研工作带来了很大便利。此外,两个荧光素酶基因都有独立的启动子和终止位点,二者单独表达且互不干扰[24]。将研究的目的基因克隆到位于海肾荧光素酶下游的多克隆位点,通过比较过表达或者干扰miRNA后检测报告基因的表达,可以定量检测miRNA对目的基因的调控作用[25],还可以结合定点突变等方法确定miRNA和靶基因3'UTR的作用位点[26]。本研究中应用双荧光素酶实验快速检测报告蛋白表达活性,从而可以在最短的时间内确认质粒的构建是否成功以及在肿瘤细胞中的表达情况。
本研究也存在不足之处。因为时间的限制,本研究只选择了PC-9细胞株作为受试细胞。将来我们考虑增加另一种非小细胞肺癌细胞株进行验证使结论更有说服力。
综上所述,本研究初步证实了嵌合内含子能抑制非小细胞肺癌细胞株PC-9的EMT转化能力。该结论为临床对非小细胞肺癌诊断、治疗提供了实验参考和依据。
鸣谢
感谢贵州医科大学医学分子生物学系王琴容副教授对本实验的指导和帮助。

