千斤拔提取物对急性痛风性关节炎模型大鼠治疗效果及抗炎机制研究
薛舒月,田涵文,石小敏,周康帅,吴明嫦,高贝瑶,吴登鼎,虞道锐
(1.海南医学院临床学院,2.海南医学院基础与生命科学学院,海南 海口 571199)
痛风(gout)是由于单钠尿酸盐(MSU)结晶沉积于关节、肾脏等部位导致的炎症性疾病,急性发作为急性痛风性关节炎[1]。其发生会引起沉积关节部位的剧烈疼痛,严重会导致关节畸形,甚至造成不可逆的关节残疾,一直以来,痛风发病率呈升高趋势,一直干扰着人们的生活质量[2],因此,探寻根治本病的有效方法是医学工作者们的追求目标。如今,临床上治疗急性痛风性关节炎仍然以消炎止痛为主,对疾病选择的药物有限,且不良反应较多[3],所以,寻找一种疗效显著、副作用小的药物是当前研究的一个关键方向。近年来,传统医药在临床各种疾病的疗效彰显优势,急性痛风性关节炎的治疗在基础实验研究显示,传统医药不良反应少且具有“多靶点,多通路”的独特优势[4]。
千斤拔(FlemingiaRoxb.exAit)为豆科植物蔓性千斤拔的根[5]。2015年版《中国药典》四部中有这样的描述:法定药用来源是千斤拔的干燥根[6],民间主要用于治疗手足痹痛,舒筋活血、祛风湿、强筋骨、四肢酸软,跌打扭伤等疾病[7]。现代药理表明,千斤拔在镇痛、抗炎、抗血栓、调节免疫和抗疲劳等方面具有较好的疗效[8]。有研究提示,千斤拔提取液对小鼠足肿胀和耳部水肿有抑制作用和抗二甲苯诱发的小鼠耳廓肿胀的炎症作用[9]。但对急性痛风性关节炎引起的炎症发生与肿痛治疗,以及可能参与疾病发生发展的分子机制尚不明确,且未见专题报道。本研究通过千斤拔提取物灌胃给予急性痛风性关节炎模型大鼠,从炎症表现、关节组织变化方面,探讨其对急性痛风性关节炎的抗炎作用,从炎症相关蛋白表达探讨其作用机制。
1 材料与方法
1.1 主要试剂、药物及仪器
千斤拔提取物由海南医学院生药学教研室提供。尿酸钠晶体(monosodium urate,MSU),批号 101498747,购自 Sigma 公司;秋水仙碱片,批号 H53021369,购自西双版纳制药厂;白介素1β(IL-1β)检测试剂盒,批号:190307;肿瘤坏死因子α(TNF-α),批号:190323;白介素6(IL-6)检测试剂盒,批号:190432;均购自上海酶联生物科技有限公司。兔抗大鼠NALP3单克隆抗体,批号:3560-1,购自Abcam公司;兔抗大鼠 Caspase-1 单克隆抗体,批号:13907-1,购自Abcam公司;β-肌动蛋白/β-Actin抗体,批号:hz-0061R,购自Abcam公司;生物素化羊抗兔IgG(1∶500),批号:165069购自Abcam公司;低温高速离心机,批号:5810(R),购自eppendof公司;Mini-PROTEAN Tetra 垂直电泳转印系统,购自Bio-Rad公司;Western Blot自动分析仪,购自proteinsimple公司。
1.2 实验动物
SD大鼠共60只,均购自长沙天勤生物技术有限公司,室温中动物分笼饲养,自由饮水摄食。动物合格证号:SCXK(湘)2014-001。本研究采用的动物严格参照海南医学院伦理委员会的标准,并在确保实验可行性的同时尽可能减少实验动物的数量,实验结束后动物以脱臼安乐死的方法处死,动物尸体委托学校动物中心处理。
1.3 方法
1.3.1动物造模、分组和给药 将60只SD大鼠称重、标号后双盲法随机分组,千斤拔提取物低、中、高剂量组,阴性对照组,急性痛风性关节炎模型组,秋水仙碱组。分组后每天按规定时间段对各组大鼠灌胃给药,每次给药量为:秋水仙碱组:0.8 mg/kg;千斤拔提取物低剂量组(100 mg/kg)、中剂量组(150 mg/kg)、高剂量组(200 mg/kg)。其余两组大鼠分别给予相应的0.9%NaCl溶液,连续7 d,第5 天给药1 h后建立急性痛风性关节炎模型[10],用5号注射器在每只大鼠的踝关节外后方和沿着与胫骨成45°夹角的方向插入至踝关节腔,将MSU混悬液0.2 mL注入至踝关节腔内,轻揉拉伸关节,便于药物扩散到关节周围各部位,阴性对照组于同一方法注射0.2mL生理盐水。造模成功后在第2、6、12、24小时和48小时测量各组大鼠关节肿胀度及观察其步态;末次给药1 h 后各组采用3%戊巴比妥钠腹腔注射麻醉,麻醉后对每只大鼠右后肢踝关节备皮、酒精消毒,手术刀切开右踝关节囊,用1 mL注射器抽取生理盐水反复冲洗关节腔,收集关节液于离心管中,于低温高速离心机以3 000 r/min离心15 min,取上清液置于2 mL EP管中放在-20 ℃存放备用,接着取大鼠踝关节中的滑膜组织置于5 mLEP管中,置于-80 ℃冰箱中保存备用。
1.3.2各组关节肿胀度测量 各组大鼠造模后第2、6、12、24、48小时时间点测量关节肿胀度,每只大鼠右踝关节上下3 mm的范围进行剃毛,用记号笔在其踝关节下1 mm处进行标记。用游标卡尺重复测量肿胀处的直径3 次并记录,得出的数据按以下公式计算出大鼠踝关节肿胀度:踝关节肿胀度=(造模后各时间点踝关节直径-造模前踝关节直径)/造模前踝关节直径×100%。
1.3.3各组步态观察 各组大鼠造模第6、12、24、48小时时间点进行步态观察,标准如下:(1)正常步态为1级;(2)足踩地减轻,轻度跛行为2级;(3)明显跛行为3级;(4)足完全离地,三足步态为4级。
1.3.4各组关节液IL-1β、TNF-α、IL-6水平测定 从—20 ℃的冰箱中取出已取得的大鼠关节液,采用酶联免疫吸附(ELISA)法检测关节液IL-1β、TNF-α、IL-6水平含量,根据试剂盒说明书具体步骤操作,应用酶标仪检其波长在450 nm的吸光度值,根据待测样品的吸光度值计算相应的IL-1β、TNF-α、IL-6水平。
1.3.5各组踝关节组织NLRP3、Caspase-1蛋白表达 将已取得的踝关节滑膜组织进行匀浆裂解,以滑膜组织裂解液的比例提取蛋白。采用蛋白免疫印迹法(Western blot)检测其NLRP3、Caspase-1蛋白表达,步骤如下:采用BCA法测定蛋白浓度,进行蛋白定量,计算上样量加入上样缓冲液,于100 ℃加热变性5 min。以每孔按50 μg蛋白量上样,再经SDS-PAGE 分离胶电泳分离,结束后将胶上蛋白转至PVDF 膜上,37℃恒温环境封闭1 h,孵育相关一抗4 ℃过夜(一抗稀释比例为NALP3,1∶200;Caspase-1,1∶5 000;β-actin,1∶5 000);二抗室温孵育2 h;TBST洗3 次/10 min。PVDF膜置于发光液中显色,室温静置反应1 min后曝光拍照,并记录分析各目的蛋白与内参条带的灰度值差异值。
1.4 统计学处理

2 结果
2.1 千斤拔提取物对急性痛风性关节炎大鼠关节肿胀度的影响
造模2 h后,模型组的关节肿胀度比阴性对照组增加了68.7%[(9.51±2.78)vs.(30.38±4.27),F=1.242,t=11.58,(P<0.01)],其他各给药组也略升高,但无统计学意义(P>0.05);随着造模时间的增加,在6、12 h 时,整体呈升高趋势,模型组关节肿胀度分别升高了74.4%[(10.10±2.42)vs.(39.10±3.07),F=0.105,t=23.44,P<0.01]和76.4%[(9.63±2.45)vs.(40.86±3.13),F=0.522,t=21.68,P<0.01];与模型组比较,各治疗组关节肿胀度不同程度的减轻,千斤拔提取物高剂量组最明显,分别减轻了62.1%[(14.01±2.05)vs.(39.10±3.07),F=0.993,t=21.48,P<0.01]与64.2%[(15.51±2.56)vs.(40.86±3.13),F=0.106,t=18.39,P<0.01],与秋水仙碱组接近。在24 h和48 h时,各组大鼠的关节肿胀度整体升高,24 h达到最强,之后48 h后有减轻趋势,与阴性对照组比较,两个时间点模型组大鼠的关节肿胀度分别提升了81.1%[(10.63±1.85)vs.(56.14±4.06),F=5.260,t=28.62,P<0.01]和79.7%[(10.38±1.69)vs.(51.13±2.10),F=0.324,t=42.81,P<0.01];其余各组关节肿胀度升高(P<0.05)。与模型组比较,各治疗组关节肿胀度显著减轻,有剂量依赖性。在48 h时,千斤拔提取物高剂量组大鼠的关节肿胀度明显比模型组减轻,[(27.12±2.42)vs.(51.13±2.10),F=0.169,t=21.20,(P<0.01)],与秋水仙碱同一水平[(27.00±2.00)vs.(51.13±2.10),F=0.072,t=23.53,P<0.01]。提示,千斤拔提取物可减轻急性痛风性关节炎大鼠关节肿胀度,其中千斤拔提取物从2 h开始起效,起效快,且作用持久,效果与秋水仙碱相似,见图1。
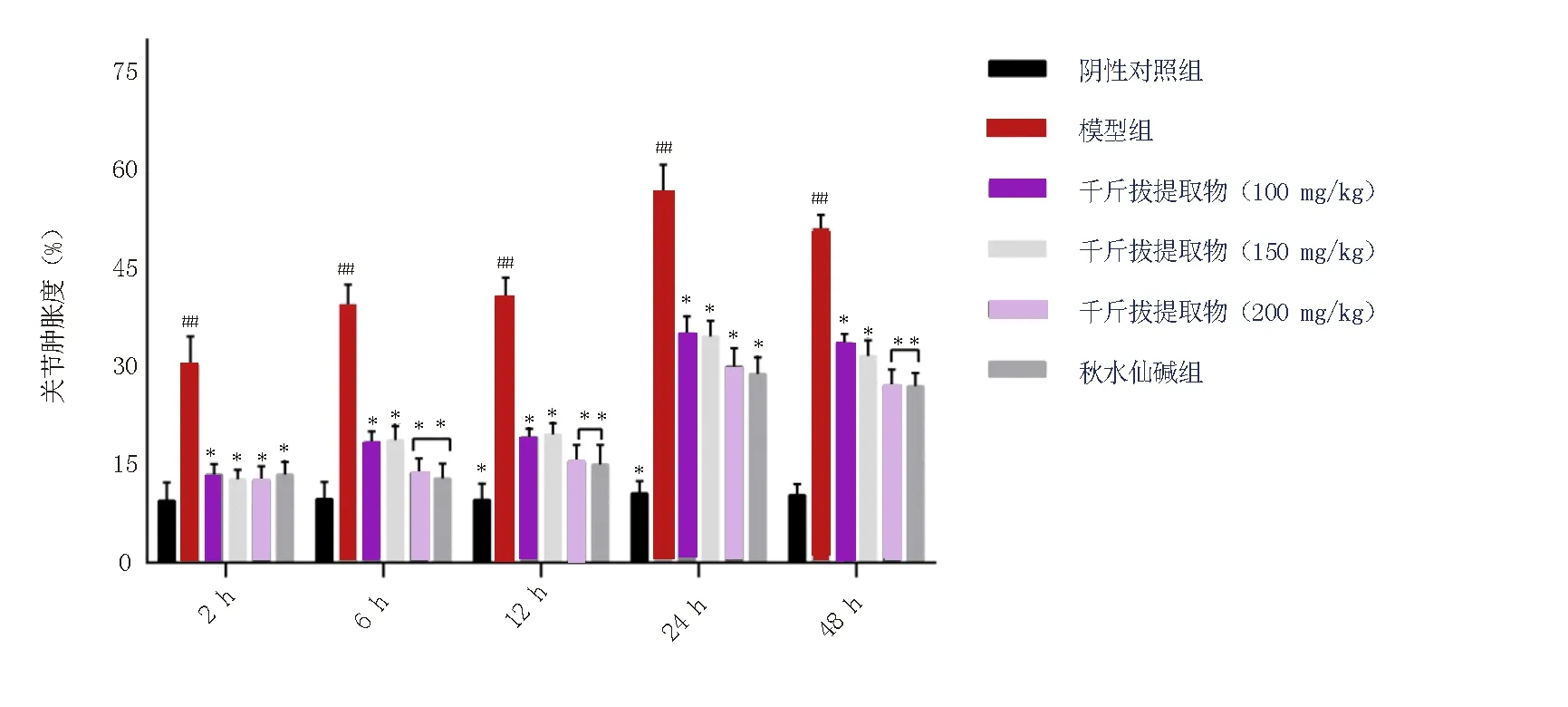
注:与阴性对照组比较,#P<0.05,##P<0.05;与模型组比较,*P<0.05,**P<0.05。图1 各组关节肿胀度变化情况Fig 1 Changes of joint swelling in each group
2.2 千斤拔提取物对急性痛风性关节炎大鼠步态观察
造模6 h后,与阴性对照组比较,急性痛风性关节炎模型组步态变化明显升高[(1.04±0.12)vs.(2.85±0.14),F=0.024,t=30.19,P<0.05],其他各给药组的步态变化也明显升高,但略低于模型组;在12、24、48 h时,模型组步态变化持续上升,到了48 h有下降趋势;与急性痛风性关节炎模型组比较,在12、24 h时,千斤拔提取物各组及秋水仙碱组步态随着时间的增加而改善,千斤拔提取物高剂量组和秋水仙碱改善最明显,两组基本持平[(1.79±0.12)、(1.74±0.16)vs.(3.21±0.16),F12h=0.503,t12h=22.02;F24h=0.078,t24h=19.91,P<0.05]。在48 h时,包括模型组在内的各组步态不同程度的改善,但千斤拔提取物高剂量组最明显[(1.63±0.15)vs.(3.42±0.18),F=0.278,t=23.62,P<0.05],与秋水仙碱组步态改善程度持平[(1.61±0.14)vs.(3.42±0.18),F=0.431,t=24.66,P<0.05]。综上提示,千斤拔提取物从12 h开始改善急性痛风性关节炎大鼠模型的步态,与秋水仙碱持平,但千斤拔作为传统中草药药效多靶点、副作用小等方面优于秋水仙碱。见图2。
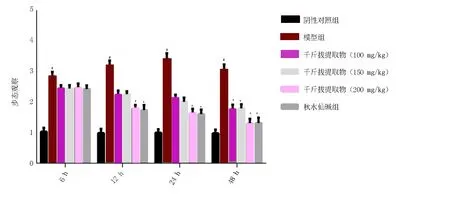
注:与阴性对照组比较,#P<0.05;与模型组比较,*P<0.05。图2 各组步态变化情况Fig 2 Gait changes in each group
2.3 千斤拔提取物对急性痛风性关节炎大鼠关节液IL-1β、TNF-α、IL-6水平的影响
造模成功48 h后,与阴性对照组比较,急性痛风性关节炎模型组均明显升高关节液中IL-1β、TNF-α、IL-6水平(FIL-1β=9.710,FTNF-α=0.069,FIL-6=2.079,tIL-1β=43.19,tTNF-α=102.71,tIL-6=95.95,P均<0.01),提示注入尿酸钠后,炎症因子升高,炎症表现明显。与急性痛风性关节炎模型组比较,可以看出阳性药秋水仙碱组关节液IL-1β、TNF-α、IL-6含量均明显降低,略高于阴性对照组(FIL-1β=0.712,FTNF-α=0.416,FIL-6=2.779,tIL-1β=32.22,tTNF-α=112.47,tIL-6=91.19,P均<0.01);而千斤拔提取物(100、150、200 mg/kg)剂量组大鼠关节液IL-1β、TNF-α、IL-6水平与急性痛风性关节炎模型组比较,呈剂量依赖性明显降低,而千斤拔提取物(200 mg/kg)剂量组大鼠关节液IL-1β、TNF-α、IL-6的含量均最低,略高于阳性药秋水仙碱组(FIL-1β=0.920,FTNF-α=0.487,FIL-6=1.569,tIL-1β=29.64,tTNF-α=89.12,tIL-6=85.84,P均<0.01),提示大鼠关节液IL-1β、TNF-α、IL-6下降水平跟给药剂量有关,且千斤拔在一定程度上抗炎效果优于秋水仙碱,见表1。
表1 千斤拔提取物对各组大鼠滑膜 IL-1β、TNF-α、IL-6 水平的比较Tab 1 Comparison of the levels of IL-1β,TNF-α and IL-6 in the synovium of rats in each
2.4 千斤拔提取物对急性痛风性关节炎大鼠滑膜组织 NALP3、Caspase-1蛋白表达的影响
成功造模第72小时后,与阴性对照组比较,急性痛风性关节炎组的滑关节膜组织中NALP3[(2.91±0.37)vs.(0.32±0.11)]、Caspase-1 [(2.70±0.17)vs.(0.31±0.18)]两个蛋白表达均明显升高,差异有统计学意义[FNALP3=4.321,tNALP3=208.98,PNALP3<0.01;FCaspase-1=1.294,tCaspase-1=300.85,PCaspase-1<0.01];与急性痛风性关节炎组比较,阳性对照秋水仙碱组大鼠滑膜组织的 NALP3[(1.23±0.35)vs.(2.91±0.37)]、Caspase-18[(1.09±0.48)vs.(2.70±0.17)]蛋白表达明显降低(FNALP3=0.011,tNALP3=104.35,PNALP3<0.01);(FCaspase-1=6.434,tCaspase-1=100.54,PCaspase-1<0.01);而千斤拔提取物低、中、高剂量给药组的滑关节膜组织中两个蛋白表达均呈剂量依赖性趋势下降,千斤拔提取物中、高剂量组差异有统计学意义。高剂量组下降幅度接近阳性对照组,见图3。

注:与阴性对照组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01。A:阴性对照组;B:急性痛风性关节炎模型组;C:千斤拔提取物(100 mg/kg)组;D:千斤拔提取物(150 mg/kg)组;E:千斤拔提取物(200 mg/kg)组;F:秋水仙碱组图3 各组踝关节滑膜组织 NALP3、Caspase-1蛋白表达的影响Fig 3 The influence of NALP3 and Caspase-1 protein expression in ankle joint synovial tissue in each group
3 讨论
多年来,急性痛风性关节炎作为一种迁延性风湿病时刻危害着人类的健康。痛风的发生由于尿酸钠结晶在关节及其周围组织沉积,之后带动炎症级联反应,如激活巨噬细胞的活性,加速如组胺、1L-1β、TNF-α等炎症因子的释放,引发氧化应激反应,最终使局部血管扩张、增加血管的渗透性,加快释放、聚集大量的白细胞等非特异性炎症的连锁反应[11]。
目前临床用于治疗急性痛风性关节炎的药物有限,一般以西药如秋水仙碱等为主,但使用的药物在治疗的同时都会有一定的不良反应[12,13]。而本研究选用的千斤拔具有镇痛、抗炎作用,民间用于跌打扭伤的疼痛,临床疗效突出。本实验结果表明,注射尿酸钠晶体的模型组大鼠关节肿胀程度明显加重,说明激活炎症级联反应以及巨噬细胞活性,并使各种趋化因子及炎症介质的释放,导致关节内渗出升高以及滑膜增生和肥厚。而千斤拔提取物几个浓度能显著降低急性痛风性关节炎模型大鼠踝关节肿胀度以及步态的变化,该药理作用可能与镇痛、抗炎作用相关且药效呈剂量依赖性。
现研究表明,注射尿酸盐晶体至关节腔后可刺激单核巨噬细胞中的IL-1β,而IL-1β作为调节炎症的关键因素被认为是最经典的炎症调节剂[14]。又有研究表明,痛风性关节炎的患者体内的IL-17含量显著增加,其与疾病发生发展呈正相关,且认为是IL-1β下游促炎因子[15]。而TNF-α在炎症反应初期就会出现高表达,其可能通过激活细胞因子在炎症反应中发挥级联作用[16]。TNF-α能激活IL-6,而IL-6也影响着TNF-α的活性,两者形成正反馈的关系,最终加重和持续炎症反应的发生[17]。因此,IL-1β、TNF-α、IL-6 等炎症因子在痛风性关节炎中发挥着重要的作用,在治疗该病时,干预以上致炎因子的发生并且阻断或抑制其所调控的炎症过程,对治疗痛风性关节炎有着重要的意义[18]。本实验显示,千斤拔提取物通过呈剂量依赖性下调滑膜组织中IL-1β、TNF-α、IL-6的水平,其高剂量组的调控效果与秋水仙碱相近,提示千斤拔提取物能明显减轻急性痛风性关节炎大鼠关节腔内的炎症反应,且作为传统中医药如不良反应等方面优于秋水仙碱。
NALP3小体是识别内源性危险信号,当注入尿酸钠晶体时,NALP3的蛋白构象就会发生变化,并且结合于Caspase-1前体后形成激活状态的NALP3炎性体,活化Caspase-1活性,又激活IL-1β的活性,从而激活炎症信号通路,产生大量如TNF-α、L-6等炎症因子,从而导致急性痛风性关节炎的发作[19,20]。本实验提示,与正常组比较,模型组踝关节滑膜组织中NALP3、Caspase-1蛋白的表达均升高,证明NALP3炎性小体的活化参与了急性痛风性关节炎的发病过程;本实验的造模成功,可见大鼠踝关节炎症反应明显。经过药物干预处理后显示,千斤拔提取物与秋水仙碱组大鼠的踝关节滑膜组织中 NALP3、Caspase-1蛋白表达均明显降低。说明千斤拔通过抑制NALP3炎性小体和Caspase-1的产生作用于急性痛风性关节炎。略高于秋水仙碱,这可能是由于本实验的药物干预时间较短,虽然千斤拔提取物在抑制炎症因子方面较秋水仙碱略差,但千斤拔提取物对各组大鼠踝关节滑膜组织中 NALP3、Caspase-1蛋白表达与秋水仙碱组持平,说明千斤拔在抑制NALP3炎性体表达方面能追上秋水仙碱。此外,在实验过程中观察各组大鼠的一般情况发现,与模型组比较,千斤拔提取物各组大鼠一般情况恢复较好,而秋水仙碱组大鼠虽较模型组好但明显差于千斤拔提取物各组,说明千斤拔在治疗急性痛风性关节炎时能在一定程度上改善大鼠的精神、饮食、皮毛等一般状态,较秋水仙碱有一定的优势。
本研究通过千斤拔提取物对急性痛风性关节炎模型大鼠的干预,发现其具有一定的的治疗效果,其作用机制可能为有效地抑制NLRP3炎性小体的激活与降低Caspase-1的活性、改善急性痛风性关节炎的炎性反应,为临床用药提供了依据。虽然本研究对千斤拔提取物干预急性痛风性关节炎有一定疗效以及初步探讨一些作用机制,但探讨还不够深入、全面,仍需往后进一步完善。

