AmpC ompK35在亚胺培南诱导肺炎克雷伯菌耐药中的相关性研究
胡颖嵩,卫 明,唐 晶,叶 巍,杨 楷
(湖北省中西医结合医院检验科,湖北 武汉 430015)
肺炎克雷伯菌具有多重耐药性,可以产生质粒介导超光谱β内酰胺酶,对于头孢菌素等多种抗菌药物均会产生耐药,近年来还发现了对亚胺培南耐药肺炎克雷伯菌,因此对肺炎患者的治疗产生严重的影响,目前认为引发耐药主要是孔蛋白确实导致了外模渗透性发生改变,同时形成了水解亚胺培南β内酰胺酶导致青霉素结合蛋白发生改变[1]。近年来随着基因学的飞速发展通过对耐药菌株进行分析了解耐药过程中的变化已成为临床热点,目前认为耐药的重要机制是膜蛋白缺失,ompK35是细菌耐药主要膜蛋白,AmpC则是肠杆菌或者绿脓假单胞菌染色体或者质粒介导形成的β内酰胺酶,可以被诱导形成对β-内酰胺抗菌素抑制剂不敏感,但是两者具体的作用机制临床说法不一[2]。为了进一步深入分析AmpC、ompK35在亚胺培南诱导肺炎克雷伯菌耐药中情况,本研究进行了观察,以期为临床提供指导和依据,现汇报如下。
1 材料与方法
1.1细菌株来源:2015年1月至2020年1月,收集我院分离培养的肺炎克雷伯菌200株,其中耐亚胺培南菌株50株(A组),不耐亚胺培南菌株150株(B组)。
1.2试剂及仪器:全自动鉴定系统:美国BD公司Phoenix 100;高速低温离心机:安徽中科中佳公司 HC 3018R;PCR扩增仪:德国Biometra公司;自动型DNA序列分析仪:美国ABI公司3730型;台式高速低温离心机:德国 Eppendorf公司5417R;恒温水浴箱:广州明珠电器厂;比浊仪:法国生物梅里埃公司;药敏纸片:OXOID公司;亚胺培南:深圳市海滨制药有限公司。
1.3试验方法:采用CLSI纸片扩散法开展菌株药敏试验,选择纯培养菌落接种肉汤培养基,使用无菌棉蘸取菌液布满琼脂表面,室温下干燥5min后使用无菌镊子将含药纸片平铺在琼脂表面。温箱中孵育,测量抑菌环直径。使用琼脂稀释法测定次抑菌浓度IMP菌株对耐药IMP的最低抑菌浓度(MIC)值。IMP的MIC判断标准:MIC低于4ug/mL判断为敏感,MIC=8ug/mL判断为中介,MIC超过16ug/mL判断为耐药。三维水解实验检测β-内酰胺酶:经高压灭菌棉签从培育好的菌悬液中沾取0.5麦氏单位肺炎克雷伯菌菌悬液,均匀涂抹在M-H琼脂平板上,孵育培养24h矢状菌苔生长方向都指向纸片为阳性。提取肺炎克雷伯菌基因组DNA:选择分离培养菌体2g置于LB培养基,37℃恒温摇床培养18h,离心后加入GN结合液混合均匀静置5min,再次离心后漂洗30s,清洗3次去除离心纯化柱残留漂洗液,纯化柱套入干净1.5mL离心管加入100ul缓冲液心1min,收集液体是洗脱下来的基因组DNA,加入ompK35引物:FOR GCGCATCTCCAAGACCATG REV GCCACGCGATTTGACGGAG进行PCR反应,取PCR产物5ul,加上样缓冲液1ul,在1.5%琼脂糖凝胶中电泳30min在紫外成像系统观察结果。

2 结 果
2.1A组和B组AmpC基因和蛋白表达比较:A组AmpC基因、蛋白相对表达量明显高于B组(P<0.05),见表1和图1。
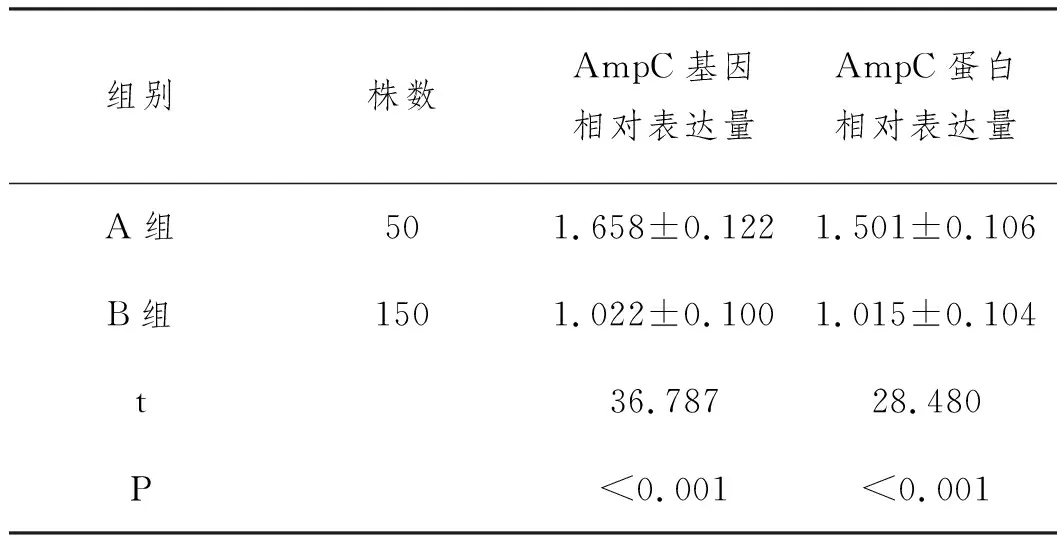
表1 A组和B组AmpC基因和蛋白表达比较
2.2A组和B组ompK35基因和蛋白表达比较:A组ompK35基因、蛋白相对表达量明显低于B组(P<0.05),见表2和图1。

表2 A组和B组ompK35基因和蛋白表达比较
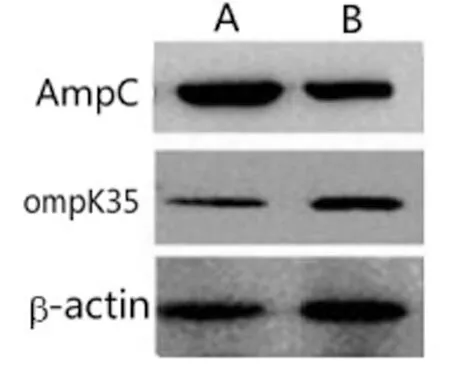
图1 Western blot检测图
2.3相关性分析:AmpC基因与ompK35基因呈负相关(r=-0.329,P<0.05);AmpC蛋白与ompK35蛋白呈负相关(r=-0.435,P<0.05)。见图2。

图2 相关分析图
3 讨 论
肺炎克雷伯菌属于肠杆菌科革兰氏阴性菌,也是引发肺炎重要的致病菌,会导致肺部感染形成高热状态,在老年人群、长期饮酒和营养不良人群中极易感染,研究还发现在长期住院尤其是出现脏器功能衰竭患者容易感染肺炎克雷伯菌,增加了临床治疗难度,患者病死率升高[3,4]。随着现代临床应用抗菌药物越来越广泛,肺炎克雷伯菌对于第三代头孢菌素耐药率接近三分之一,国内研究发现其导致呼吸道感染显著升高[5,6]。目前研究发现由多药耐药病原菌导致肺部感染最佳治疗方案尚未明确,需要进行药物敏感性检测,而对于耐药病菌特效治疗方案较少,提示临床可用有效治疗方法不多[7]。β-内酰胺酶类抗菌药物属于常见的抗生素,治疗细菌感染效果显著,但是耐药性报道也越来越常见,耐药性出现多源化与多样化,目前认为β-内酰胺酶是革兰阴性杆菌发送耐药的主要机制可以水解β-内酰胺类抗生素β-内酰胺环造成活性丧失继而导致耐药[8]。目前大量的研究证实了AmpC酶表达是细菌对β-内酞胺类抗生素产生耐药性主要原因,同时膜蛋白缺失也是重要机制,ompK35则是肺炎克雷伯菌细菌耐药主要膜蛋白[9]。
本研究分析了AmpC、ompK35在亚胺培南诱导肺炎克雷伯菌耐药中的情况,通过分离耐药菌株后进行试验了解肺炎克雷伯均对于亚胺培南耐药特点。AmpC酶为头孢菌素酶,分子结构属于C类,和超广谱β内酰胺酶不同,优选底物属于头孢菌素,对头霉烯类抗菌药物具有高水平耐药性,而且金属酶类可以产生多重耐药,只对单环类抗菌药物形成敏感性,其可以水解大部分β内酰胺类抗菌药物[10]。研究显示由质粒介导AmpC酶可以在外膜蛋白缺失状态下依然引发细菌对于亚胺培南耐药,主要是其可以进行水解,质粒介导的AmpC酶ACT-1能够在一株产气肠杆菌中发现由质粒介导CMY-10,均具有水解碳霉烯类药物的特点[11]。膜蛋白ompK35是亚胺培南进入菌体的主要通道,研究发现ompK35基因减少同耐亚胺培南肺炎克雷伯菌对亚胺培南耐药有关,发挥耐药作用主要是表达量的减少,而且不管AmpC酶表达量超过或低于正常只要同时存在ompK35基因表达异常均会导致肺炎克雷伯菌株对亚胺培南耐药[12,13]。还有研究发现疏水性和带负电荷越多抗菌药物分子、较大药物分子均不容易通过,而外膜蛋白缺失会造成抗菌药物、营养物质运输过程异常,造成了药物通透性降低,而且通过传代后膜蛋白可以逐渐恢复,膜蛋白恢复对亚胺培南渗透性增加导致了敏感性可以得到恢复[14]。
本研究发现,A组AmpC基因、蛋白相对表达量明显高于B组,提示了耐亚胺培南肺炎克雷伯菌AmpC表达显著升高。A组ompK35基因、蛋白相对表达量明显低于B组,提示了耐亚胺培南肺炎克雷伯菌ompK35基因和蛋白表达量明显降低。通过相关性分析发现AmpC基因与ompK35基因呈负相关;AmpC蛋白与ompK35蛋白呈负相关。本研究通过分析了AmpC、ompK35在亚胺培南诱导肺炎克雷伯菌耐药中的变化,证实了AmpC酶是导致肺炎克雷伯菌亚胺培南耐药的重要因素,ompK35基因明显降低同样是导致肺炎克雷伯菌亚胺培南耐药的重要因素,而且两者具有相关性,为临床了解亚胺培南导致肺炎克雷伯菌耐药机制提供了相应的依据,但是本研究对于具体机制以及两种基因之间是否存在相互影响未能深入研究,还需扩大样本量、长期随访论证。
综上述所,耐亚胺培南肺炎克雷伯菌AmpC表达量升高,ompK35表达量降低,两者可能在耐药机制中有重要作用。

