CIAPIN1通过抑制ERK1/2途径对膀胱尿路上皮癌增殖和转移的作用研究
袁晓菲,彭洪涛
(1.河北省保定市第一医院泌尿外科,河北 保 定 071000 2.河北医科大学基础医学院,河北 石家庄 050017)
尿路上皮癌(Urothelial carcinoma,UC)主要由上尿路上皮癌(upper tract urothelial carcinoma,UTUC)和膀胱尿路上皮癌(Bladder urothelial carcinoma ,BC)组成。据估计,2018年美国新增UC病例为8.5万,相关死亡病例为1.8万。UC分别占男性和女性最常见恶性肿瘤的第4和第12位[1]。多发性病变、高复发率和远处转移是UC的典型特征。尽管外科技术不断进步,术前、术后辅助治疗不断发展,但近年来UC患者的长期生存率并没有明显改变[2]。因此,探究UC的发病机制及新的治疗靶点对UC的治疗具有重要意义。细胞因子诱导的凋亡抑制因子1(Cytokine-induced apoptosis inhibitor 1,CIAPIN1)是一种新发现的凋亡相关蛋白,参与调控细胞凋亡、DNA断裂和活性氧生成等细胞过程[3]。已有研究表明,CIAPIN1在膀胱癌组织中高表达,CIAPIN1在膀胱癌中的表达与病理分级、临床分期和淋巴转移相关[4]。细胞外信号调节激酶(Extracellular signal-regulated kinases,ERK),包括ERK1和ERK2,其通过磷酸化激活后,ERK蛋白从细胞质转移到细胞核中,在细胞核中传递信号。CIAPIN1通过抑制ERK1/2途径磷酸化,调控乳腺癌细胞迁移、侵袭和细胞外基质降解过程[5]。目前,关于CIAPIN1在BC中的具体作用机制还尚未可知。因此,本研究旨在探究CIAPIN1对膀胱尿路上皮癌增殖和转移的作用及其作用是否通过ERK1/2途径实现,以期为明确CIAPIN1在BC中的具体作用机制及发现新的UC治疗靶点提供新的科学依据。
1 材料与方法
1.1材料:膀胱尿路上皮癌细胞系J82、T24和UM-UC-3购自美国模式培养物研究所;人膀胱上皮永生化细胞SV-HUC-1购自上海酶研生物科技有限公司;ERK1/2途径抑制剂U0126购自美国萊恩生物科技有限公司;Cell Counting Kit-8(CCK-8)试剂盒购自日本同仁化学研究所;阴性对照(NC)和siRNA-CIAPIN1(si-CIAPIN1)购自上海吉玛制药技术有限公司;LipofectamineTM2000转染试剂购自赛默飞世尔科技(中国)有限公司;SYBRPremix Ex TaqTMⅡ试剂盒购自宝日医生物技术(北京)有限公司(takara中国);CIAPIN1抗体购自英国Abcam公司;p-ERK1/2、ERK1/2和GAPDH抗体购自美国Santa Cruz Biotechnology公司;5-乙炔基-2'-脱氧尿苷(EdU)购自大连美仑生物技术有限公司;Apollo®567购自广州市锐博生物科技有限公司;基质胶购自美国康宁(上海)有限公司。
1.2方 法
1.2.1细胞培养:J82、T24和UM-UC-3细胞用含10%FBS的DMEM培养基,置于37℃、5%CO2培养箱中培养。SV-HUC-1细胞用含10%FBS的DMEM/F12培养基,置于37℃、5%CO2培养箱中培养。细胞每2天更换一次新鲜培养基。待细胞密度达到80%~90%时,0.25%胰酶液消化细胞后,进行后续实验。
1.2.2CCK-8检测细胞活力:将对数期生长的T24细胞接种于96孔板,每孔5×103个细胞,继续培养12h后,将细胞分为0μM组、5μM组、10μM组、20μM组、40μM组和80μM组,每组设置3个重复。按照分组,向细胞中添加不同浓度U0126,0μM组添加等量PBS。细胞继续培养24h后,向每孔细胞中加入10μLCCK-8,37℃条件下孵育3h。酶标仪测定各孔在450nm处的光密度(OD)值。细胞活力(%)=实验组OD450nm /0μM组OD450nm×100%。
1.2.3细胞转染:对数期生长的T24细胞按4×105个/孔密度接种于6孔板,于37℃、5%CO2培养箱中培养24h后,将细胞随机分为空白对照组、NC组和si-CIAPIN1组,按照Lipofectamine2000TM说明书进行NC和si-CIAPIN1的转染。另外,将细胞随机分为NC组、si-CIAPIN1组和si-CIAPIN1+ U0126组。按照分组,向细胞中添加U0126(20μM),随后按照Lipofectamine2000TM说明书进行NC和si-CIAPIN1的转染。37℃、5%CO2条件下培养48h后,进行后续实验。
1.2.4qRT-PCR检测细胞CIAPIN1 mRNA表达水平:收集SV-HUC-1、J82、T24和UM-UC-3细胞,Trizol法提取细胞总RNA,测定RNA浓度,将RNA逆转录合成cDNA。按照SYBRPremix Ex TaqTMⅡ试剂盒说明书进行qRT-PCR实验。反应条件:95℃、30s;95℃、5s,58℃、30s,40个循环;95℃、15s;58℃、30s;95℃、15s。CIAPIN1以GAPDH为内参,采用2-ΔΔCt法计算其mRNA表达。CIAPIN1上游引物:5’-CACCAAGAAGTCTTCTCCTTCAGTG-3’,CIAPIN1下游引物:5’-GCTGAGAGGGTCCACAGCT-3’;GAPDH上游引物:5’-GGAGCGAGATCCCTCCAAAAT-3’,GAPDH下游引物:5’-GGCTGTTGTCATACTTCTCATGG-3’。
1.2.5Western blot检测细胞CIAPIN1、p-ERK1/2和ERK1/2蛋白表达水平:收集SV-HUC-1、J82、T24、UM-UC-3细胞和转染后的T24细胞,RIPA裂解液裂解细胞,离心取上清,BCA法测定上清液的蛋白浓度。取30μg蛋白进行SDS-PAGE分离并转至PVDF膜上。10%脱脂奶粉封闭,加入CIAPIN1(1∶1000)、p-ERK1/2(1∶2000)、ERK1/2(1∶1000)和GAPDH(1∶2000)抗体,4℃孵育过夜。二抗(1∶5000)室温孵育1h后,滴加ECL发光液到膜上,化学发光成像仪检测蛋白条带。
1.2.65-乙炔基-2'-脱氧尿苷(EdU)标记实验检测细胞增殖:对数期生长的T24细胞以2×105个/孔数量接种于24孔板中,按照1.4所示进行细胞转染。48h后,根据说明书,向细胞中添加EdU至终浓度为10μM。继续培养2h后,弃去培养基,4%多聚甲醛固定15min,0.5%Triton X-100穿透20min, Apollo®567避光染色30min,4',6-二氨基-2-苯基吲哚(DAPI)染核5min。激光共聚焦显微镜观察细胞,其中蓝色荧光代表细胞核,红色荧光代表EdU阳性细胞。
1.2.7细胞划痕实验检测细胞迁移:对数期生长的T24细胞以2.5×105个/mL细胞密度接种于6孔板,每孔2mL,细胞置于37℃、5% CO2条件下培养24h。20μL枪头沿着直尺,垂直于6孔板,进行细胞划痕。PBS洗去漂浮细胞,加入无血清培养基。细胞继续培养24h后拍照,Image J软件分析细胞迁移距离。
1.2.8Transwell实验检测细胞侵袭:基质胶用无血清DMEM培养基稀释。取100μL稀释液加入各上腔室中,37℃孵育至凝固。上腔室加入100μLT24细胞悬液(5×104个细胞),下腔室加入500μL含20% FBS的DMEM培养基,37℃、 5%CO2条件下培养24h。5%戊二醛4℃条件下固定,0.1%结晶紫室温染色30min,显微镜下观察。

2 结 果
2.1CIAPIN1在膀胱尿路上皮癌细胞中的表达:qRT-PCR和Western blot实验结果显示:与SV-HUC-1组相比,T24、UM-UC-3和J8两组细胞中CIAPIN1 mRNA和蛋白表达水平均明显升高(P<0.05),其中,T24组细胞变化最为明显,因此选取T24细胞进行后续实验。见图1。
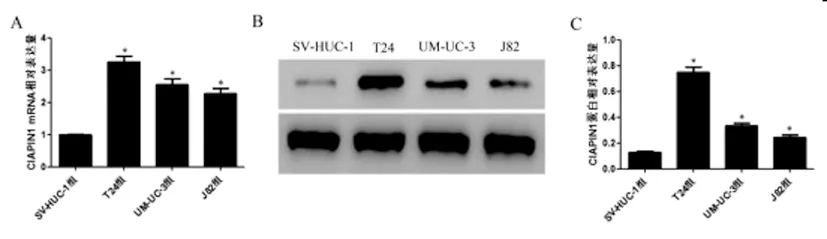
图1 CIAPIN1在膀胱尿路上皮癌细胞中的表达
2.2CIAPIN1对膀胱尿路上皮癌细胞增殖的影响:EdU实验结果显示:与NC组相比,si-CIAPIN1组EdU阳性细胞数明显降低(P<0.05)。见图2。
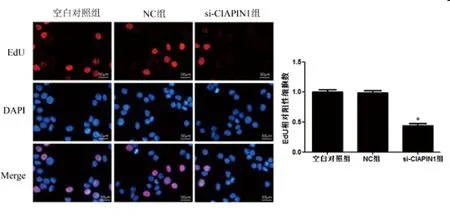
图2 EdU实验检测CIAPIN1对膀胱尿路上皮癌细胞增殖的影响(×400)
2.3CIAPIN1对膀胱尿路上皮癌细胞迁移和侵袭的影响:细胞划痕和Transwell实验结果显示:与NC组相比,si-CIAPIN1组细胞迁移距离和侵袭细胞数明显降低(P<0.05)。见图3和图4。
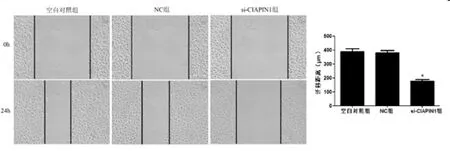
图3 细胞划痕实验检测CIAPIN1对膀胱尿路上皮癌细胞迁移的影响(×100)

图4 Transwell实验检测CIAPIN1对膀胱尿路上皮癌细胞侵袭的影响(×400)
2.4CIAPIN1对膀胱尿路上皮癌细胞ERK1/2途径的影响:Western blot检测结果显示:与NC组相比,si-CIAPIN1组细胞p-ERK1/2 / ERK1/2蛋白表达水平明显升高(P<0.05)。见图5。
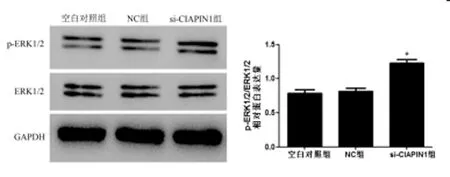
图5 Western blot实验检测CIAPIN1对膀胱尿路上皮癌细胞ERK1/2途径的影响
2.5U0126逆转si-CIAPIN1对ERK1/2途径的作用:CCK-8实验结果显示:与0μM组相比, 40μM组和80μM组T24细胞活力明显降低(P<0.05),而5μM、10μM和20μM差异无统计学意义(P>0.05),见图6,因此,后续实验U0126的使用浓度为20μM。Western blot实验结果显示:与NC组相比,si-CIAPIN1组细胞中p-ERK1/2 / ERK1/2蛋白表达水平明显升高(P<0.05);与si-CIAPIN1组相比,si-CIAPIN1+ U0126组细胞p-ERK1/2 / ERK1/2蛋白表达水平明显降低(P<0.05),见图7。
2.6U0126逆转si-CIAPIN1对膀胱尿路上皮癌细胞的作用:EdU、细胞划痕和Transwell实验结果显示:与NC组相比,si-CIAPIN1组细胞EdU阳性细胞数、迁移距离和侵袭细胞数均明显降低(P<0.05);与si-CIAPIN1组相比,si-CIAPIN1+ U0126组细胞EdU阳性细胞数、迁移距离和侵袭细胞数均明显升高(P<0.05)。见图8、图9和图10。
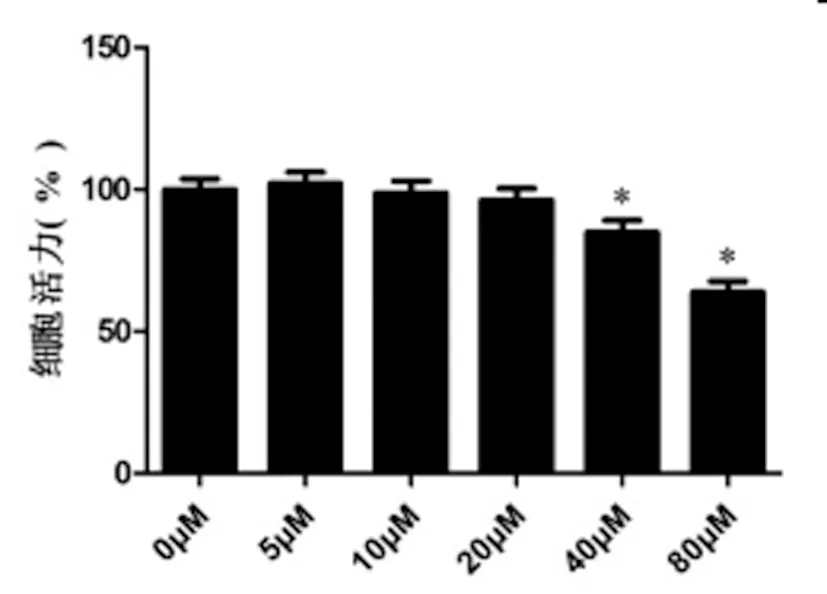
图6 CCK-8检测U0126对T24细胞活力的影响
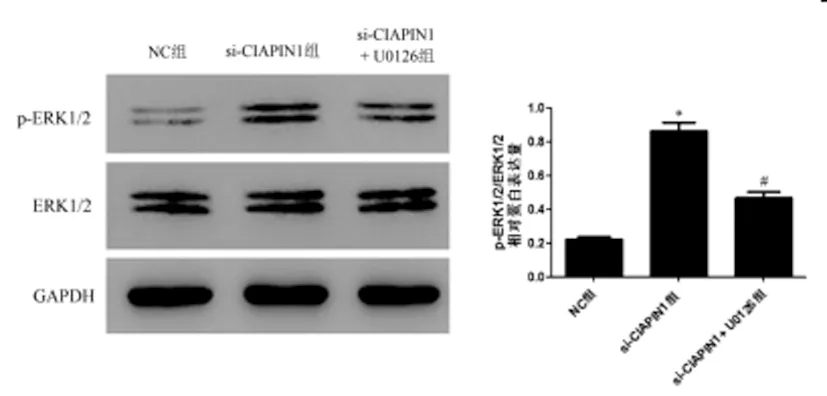
图7 Western blot检测U0126对细胞ERK1/2途径的作用
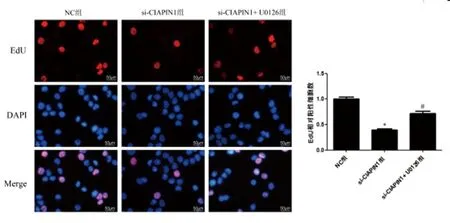
图8 EdU实验检测U0126对细胞增殖的影响(×400)

图9 细胞划痕实验检测U0126对细胞迁移的影响(×100)
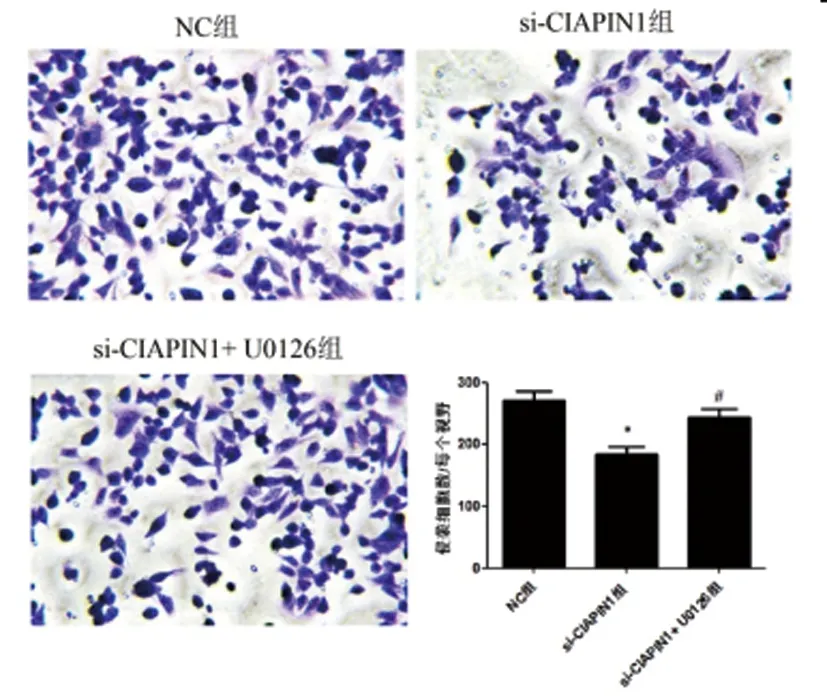
图10 Transwell实验检测U0126对细胞侵袭的影响(×400)
3 讨 论
膀胱尿路上皮癌(BC)是世界上第九大常见的恶性肿瘤。尽管多数晚期BC患者通过一线铂类化疗后疾病控制率(DCR)可达大概65%~75%,但由于存在化疗耐药,他们的疾病无进展生存期(PFS)及总生存期(OS)往往较短。经过一线化疗后,只有约25%~55%的患者有机会接受二线治疗,但很多二线治疗结局因疾病进展较快,而未能达到治疗标准[6]。因此,探寻BC的发病机制及新的治疗靶点对于改善BC疾病现状具有重要意义。CIAPIN1被称为抗凋亡分子,与包括Bcl-2和caspase家族成员在内的一系列凋亡分子没有序列同源性。CIAPIN1已成为多种人类癌症诊断、预后和治疗靶标的候选指标[7]。因此,本研究以BC为研究对象,旨在探究CIAPIN1对BC的作用及其可能的机制,以期为BC的诊断和靶标治疗提供新的科学资料。
CIAPIN1在不同癌症中发挥着抗肿瘤或者促肿瘤作用。研究表明,CIAPIN1在人肺癌组织中显著上调,敲低CIAPIN1可诱导非小细胞肺癌细胞周期阻滞和细胞凋亡[7]。CIAPIN1参与调控三阴性乳腺癌的多药耐药性,hsa-miRNA-143-3p通过靶向结合CIAPIN1提高三阴性乳腺癌细胞对化疗药物敏感性[8]。卵巢癌组织中CIAPIN1高表达,干扰CIAPIN1后可降低卵巢癌细胞存活率,促进细胞凋亡[9]。但在肝癌中,CIAPIN1发挥着抗肿瘤作用,过表达CIAPIN1可抑制肝癌细胞增殖和集落形成能力[10]。有研究表明,膀胱癌中CIAPIN1高表达,CIAPIN1的mRNA表达与增殖标志基因Cyclyin D1的mRNA表达呈正相关[11]。本研究结果显示,CIAPIN1在膀胱尿路上皮癌细胞中高表达,敲低CIAPIN1后可抑制膀胱尿路上皮癌细胞的增殖和转移,该结果说明,CIAPIN1在膀胱尿路上皮癌中发挥着促肿瘤作用。
在海马神经元细胞中,CIAPIN1通过调控Akt、MAPK、NF-κB和细胞凋亡信号通路参与细胞生存、DNA断裂和活性氧生成的调节[12]。目前,在肿瘤相关的研究中,CIAPIN1对ERK1/2途径的调控作用研究较为广泛。ERK1(44kDa)及其同源亚型ERK2(42 kDa)参与调节细胞多种生理活动[13]。已有研究证明,在人慢性髓系白血病细胞中,敲低CIAPIN1后,ERK1/2磷酸化水平上调[14]。同样的,在非小细胞肺癌细胞中,过表达CIAPIN1可抑制ERK1/2磷酸化水平[15]。然而,关于CIAPIN1在膀胱尿路上皮癌细胞中调节ERK1/2通路的作用的资料非常缺乏。本研究结果显示,敲低CIAPIN1后,膀胱尿路上皮癌细胞中ERK1/2磷酸化水平升高,而ERK1/2途径抑制剂U0126处理可逆转敲低CIAPIN1后ERK1/2磷酸化水平的升高,逆转敲低CIAPIN1对膀胱尿路上皮癌细胞的增殖和转移的抑制作用。
综上所述,本研究结果表明,CIAPIN1通过抑制ERK1/2磷酸化促进膀胱尿路上皮癌细胞的增殖和转移。该研究结果为明确CIAPIN1在膀胱尿路上皮癌中的作用及发现新的治疗靶标提供了新的科学依据。

