HMGB1/TLR4介导狼疮性肾炎肾小球细胞增殖和细胞外基质沉积
高 璠,汪 鑫,杨 冉,田月新,苗心妍,封晓娟,刘淑霞
(1.河北医科大学教学实验中心,河北 石家庄 050017;2.河北医科大学第二医院泌尿外科,河北 石家庄 050000;3.河北省中医院病理科,河北 石家庄 050000;4.河北医科大学病理学教研室,河北 石家庄 050017)
狼疮性肾炎(lupus nephritis,LN)是系统性红斑狼疮( systemic lupus erythematosus,SLE)的常见并发症之一,发病率很高且治愈率很低,一直是SLE患者的主要死因之一,因此探明 LN的发病机制,以期为探索有效的LN治疗靶点提供坚实的实验理论依据尤为重要。在临床上狼疮性肾炎患者的病理呈现出多样性,肾小球内皮细胞及系膜细胞的过度增殖,炎细胞浸润,新月体形成等均是LN活动期主要病理改变及评分依据,细胞外基质沉积则是狼疮性肾炎向终末期进展的主要原因之一,由细胞外基质沉积导致的多数肾小球发生硬化是LN肾脏病理损伤的终末阶段及主要死因。因此,在本研究探讨了LN肾小球细胞增殖和细胞外基质的发病机制。
细胞的增殖活性主要受细胞周期蛋白及其依赖性激酶调控,而在多种疾病中发现细胞因子是通过调控细胞周期蛋白及其依赖性激酶来介导细胞的增殖水平从而参与疾病发生的,我们前期实验[1-2]已经证实,重组高迁移率族蛋白B1(high mobility group protein B1,HMGB1)蛋白能够显著上调人肾小球系膜细胞(human mesangial cell,HMC)的增殖水平,而通过质粒转染技术抑制MRL/ lpr小鼠肾脏组织中HMGB1蛋白的表达则可部分减缓小鼠肾小球细胞数目的增多及系膜区的增宽。
系膜区增宽是肾小球硬化的形态学表现之一,肾小球硬化细胞外基质(extracellular matrix,ECM)过度沉积则是其发生的病理学基础,其主要过程可能是肾小球系膜区及毛细血管袢血管壁基底膜部位包括Ⅳ型胶原蛋白(typeⅣ collagen,collagenⅣ)、纤连蛋白(fibronectin,FN)、蛋白多糖、糖胺聚糖等胶原蛋白和非胶原糖蛋白合成增多或降解减少造成的。肾小球系膜细胞是参与ECM过度沉积的主要细胞。近年来的研究发现,HMGB1参与多种疾病的纤维化或硬化进程,那么HMGB1是否与LN的细胞外基质沉积相关,其机制如何?一旦被分泌至胞外,HMGB1大多情况下是作为DAMP与靶细胞细胞膜受体相互结合从而进一步激活靶细胞内下游的信号通路,以介导疾病的发生。Toll样受体2(Toll like receptor 2,TLR2)、Toll样受体4(Toll like receptor 4,TLR4)和RAGE是最早发现也是最常见的HMGB1相关受体,我们前期实验已证实TLR2介导了HMGB1诱导的LN中细胞增殖,TLR4与HMGB1所诱导的系膜细胞增殖关系如何?HMGB1是否通过与TLR4结合介导LN的肾小球细胞外基质沉积?
综上所述,我们前期实验已经证实,HMGB1参与了LN系膜细胞增殖,但其具体机制如何?且其是否参与了肾小球细胞外基质沉积目前尚不清楚。因此我们开展此项研究,通过以LN患者肾穿标本,MRL/ lpr小鼠和HMC细胞系为研究对象,LN患者置换血浆和重组 HMGB1为刺激物,检测系膜细胞中TLR4的表达水平变化及其与 HMGB1所诱导的系膜细胞增殖和ECM沉积的关系,探讨HMGB1是否激活TLR4以介导LN发病中肾小球系膜细胞的增殖和细胞外基质沉积的。
1 材料与方法
1.1 材料
1.1.1实验试剂 小鼠抗单克隆β-actin抗体(HRP-60008)购买于proteintech公司;人FN ELISA试剂盒(ab219046)、Cell Counting试剂盒8(CCK-8) (ab228554)、兔多克隆TLR4抗体(ab13556)、兔多克隆FN抗体(ab268021)均购买于Abcam公司;TAK242(614316)、甘草酸(glycyrrhizic,Gly)(G2137)购自Sigma公司。HMGB1、Gly及TAK242以细胞培养基稀释后使用浓度为100 μg ·L-1、2 mmol·L-1和1 mmol·L-1。
1.1.2肾穿标本 收集2016年1月-2018年12月期间由河北医科大学第二医院风湿免疫科及肾内科收治的狼疮性肾炎患者的肾穿石蜡标本,共计30例,所有患者均为初治且诊断明确,符合美国风湿病协会制定的SLE的诊断标准,且患者24 h尿蛋白定量>0.5 g或者连续两次尿蛋白定量>1+。同时,收集该期间由河北医科大学第二医院泌尿外科收治的肾脏肿瘤患者肿瘤组织旁5 cm以外正常肾组织20例设置为对照组。研究中尊重受试者的自主意愿,遵守无风险、不伤害以及公正的原则,同时对受试者个人信息及相关资料的保密措施。
1.1.3实验动物 30周龄MRL/lpr雌性小鼠10只,体质量(30~35) g,设为狼疮性肾炎模型组,同周龄同体重MRL/MPJ小鼠10只设为对照组,小鼠均由北京维通利华实验动物科技有限公司代购自美国Jackson实验室(实验动物编号为000485、000486)。实验动物在SPF级实验动物饲养室进行饲养,饲养环境为每笼5只,温度为(22±2) ℃,相对湿度为(55±2)%,各项操作符合河北医科大学实验动物饲养管理条例。
1.1.4细胞 人系膜细胞系(HMC)购买于中南大学高等研究中心现代分析测试中心细胞室。
1.1.5LN患者置换血浆 收集河北医科大学第二医院风湿免疫科和肾内科LN患者置换血浆5例。研究中尊重受试者的自主意愿,遵守无风险、不伤害以及公正的原则,同时对受试者个人信息及相关资料的保密措施。
1.2 仪器光学显微镜(日本Olympus),全自动多功能酶标仪(美国Thermo Scientific),Odyssey FC成像仪(美国Li-COR Biosciences),CO2培养箱(日本SANYO),超低温冰箱(青岛Haier),石蜡包埋机(德国LEICA),石蜡切片机(德国LEICA),台式高速低温离心机(德国Eppendorf),垂直电泳槽(美国Bio-Rad),转移电泳仪(美国Bio-Rad),转移电泳槽(美国Bio-Rad)。
1.3 方法
1.3.1细胞分组
1.3.1.1 生长状态良好的人系膜细胞 HMC随机分为对照血浆刺激组组、LN患者血浆刺激组和LN患者血浆+Gly组(Gly预孵育4H后加入LN患者血浆),根据MTT结果LN患者血浆浓度选择5%~10%,LN患者血浆刺激48 h后收取细胞及细胞培养上清,采用ELISA技术检测HMC细胞培养上清中FN蛋白水平。
1.3.1.2 生长状态良好的人系膜细胞 HMC随机分为HMGB1时间梯度刺激组(0、10、20、30、40、50 min),收取细胞蛋白,Western blot检测细胞中TLR4和Myd88蛋白的表达水平变化。
1.3.1.3 生长状态良好的人系膜细胞 HMC随机分为对照组、HMGB1刺激组和HMGB1+TAK242刺激组(TAK242预孵育1 h后加入HMGB1),①HMGB1刺激12 h后收取细胞,CCK8试剂盒检测细胞增殖水平;②HMGB1刺激48 h后收取细胞及细胞培养上清,Western blot技术检测细胞中FN表达水平, ELISA技术检测HMC细胞培养上清中FN蛋白水平。
1.3.2ELISA技术 检测人系膜细胞培养上清FN蛋白水平:严格按照说明书要求稀释标准蛋白制作梯度标准蛋白,后将实验样品及稀释好的标准蛋白加入96孔板中,同时每孔均设立2个复孔; 每孔加50 μL Antibody Cocktail,覆膜后置于37 ℃摇床1 h;加入1× Wash buffer 350 μL后,重复洗板3次并加入底物溶液(100μL/每孔)37 ℃孵育15 min;终止液100 μL以终止反应,使用酶标仪在OD 450 nm处检测标本IOD值;根据说明书及酶标仪读数绘制标准蛋白的标准曲线并计算出实验样品的蛋白浓度。
1.3.3免疫组织化学技术 检测对照组和LN患者肾穿标本肾小球细胞中TLR4蛋白表达水平:肾组织常规脱蜡至水;配置枸橼酸修复液,高压5 min进行抗原修复并自然晾凉;过氧化氢37 ℃避光孵育20 min去除内源性过氧化物酶; 山羊血清于37 ℃孵育60 min进行封闭;滴加抗TLR4抗体(1 ∶200稀释),4 ℃过夜;二抗室温孵育30 min;三抗室温孵育30 min;DAB进行显色;蒸馏水终止显色;应用苏木精进行复染,应用1%盐酸酒精进行分化,氨水进行返蓝,酒精梯度脱水,二甲苯透明,中性树胶封片并在光学显微镜下观察及拍照。
1.3.4Western blot技术 检测人系膜细胞中的TLR4和Myd88蛋白的水平:收集蛋白并应用BCA法定量,使用30 μg蛋白通过煮沸10 min变性,10% SDS聚丙烯酰胺凝胶电泳;90 V恒压湿转至PVDF膜,使用5%脱脂奶粉室温封闭2 h,加入FN(1 ∶1 000)TLR4(1 ∶1 000)、Myd88(1 ∶1 000)和β-actin抗体(1 ∶1 000) 并于4 ℃冰箱摇床过夜;辣根过氧化物酶标记的山羊抗兔/小鼠 IgG,37 ℃孵育1 h,HRP法化学发光,使用Odyssey FC成像系统显影并照相,Gel-Pro analyzer进行定量分析,目的蛋白与β- actin的IOD的比值代表目的蛋白的相对表达量。
1.3.5免疫细胞化学技术 检测MRL/MPJ小鼠和MRL/lpr小鼠肾小球原代系膜细胞中TLR4蛋白表达水平:筛网法提取两组小鼠肾小球组织,将肾小球悬液加入到预包被胶原蛋白Ⅰ的培养瓶中,37 ℃,5% CO2培养细胞72 h后进行胰酶消化,继续培养至10 d左右不规则的系膜细胞为主要细胞,收集细胞,4%多聚甲醛固定;3% H2O2甲醇孵育;山羊血清封闭30 min;滴加TLR4抗体(1 ∶200)冰箱4 ℃过夜;后同“1.2.3”。
1.3.6CCK-8技术 检测HMC的增殖水平: 接种细胞悬液100 μL于96孔板,预先置于37 ℃,5% CO2饱和湿度的培养箱内培养;在每孔内加入10 μL的CCK-8试剂,把培养板放置培养箱内2.5 h;在450 nm波长处测定吸光值。
1.3.7统计学分析 实验结果均应用SPSS 15.0进行统计学分析,实验中计量资料分析应用独立样本t检验或Wilcoxon秩和检验。
2 结果
2.1 LN患者肾小球细胞TLR4蛋白表达上调免疫组化结果显示,TLR4蛋白在LN患者肾穿标本肾小球细胞中的表达较为明显,阳性信号主要定位于肾小管上皮细胞以及肾小球细胞的胞核和胞质,而在癌旁远端正常肾组织肾小球细胞中无明显表达(Fig 1)。
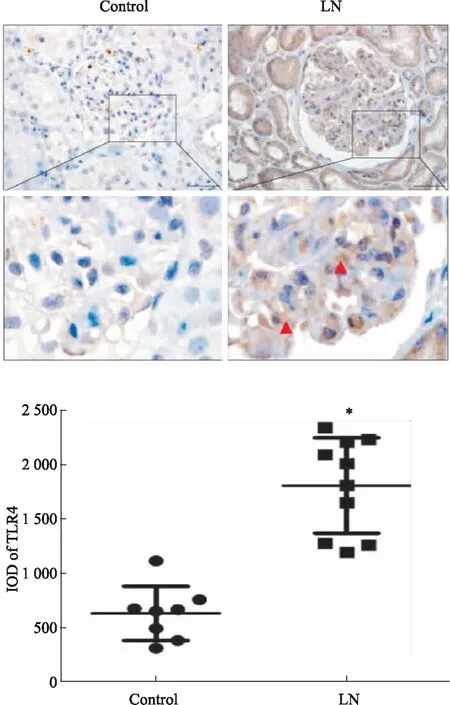
Fig 1 Expression of TRL4 in renal biopsy of LN patients and peri-cancer remote tissues detected by immunohistochemistry *P<0.05 vs control group,bar=50 μm
2.2 原代MRL/lpr小鼠肾小球系膜细胞中TLR4表达水平上调免疫细胞化学结果显示,TLR4在原代MRL/MPJ小鼠和MRL/lpr小鼠肾小球系膜细胞中均表达于细胞质和细胞膜,而与对照小鼠相比,MRL/lpr小鼠系膜细胞中TLR4的表达水平明显增强,主要定位于肾小球细胞的胞膜及胞质(Fig 2)。
2.3 Gly部分阻断HMGB1诱导的HMC培养上清中的FN表达水平的上调ELISA检测结果提示,HMGB1刺激组HMC培养上清中的FN水平较正常对照组明显升高;与HMGB1刺激组相比, HMGB1+ Gly组HMC的培养上清中FN蛋白水平降低(Fig 3)。
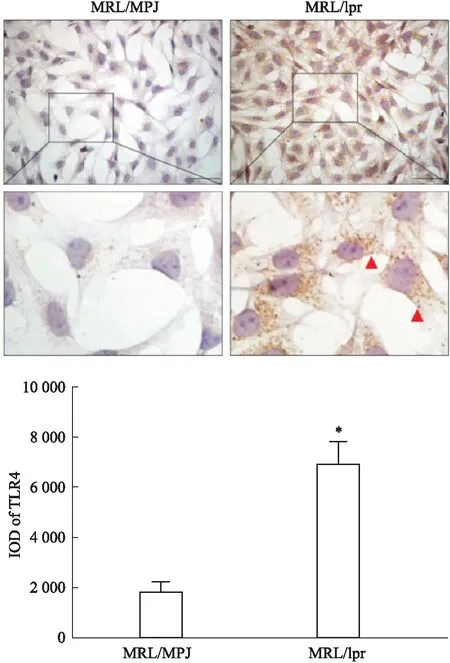
Fig 2 Expression of TRL4 in primary mesangial cells of MRL/MPJ mice and MRL/lpr mice detected by
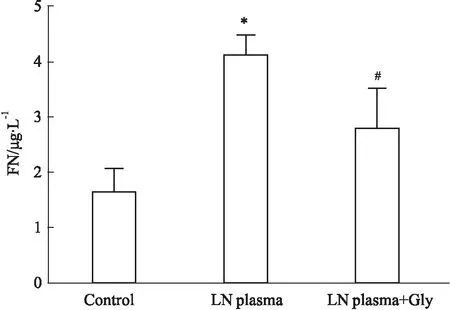
Fig 3 Expression of FN in culture supernatant of
2.4 HMGB1活化HMC的TLR4/Myd88信号通路Western blot结果显示,与对照组相比,HMGB1刺激HMC 20 min后,TLR4和Myd88蛋白表达水平上调并逐渐增高,HMGB1刺激50 min后TLR4表达降低至正常水平(Fig 4)。
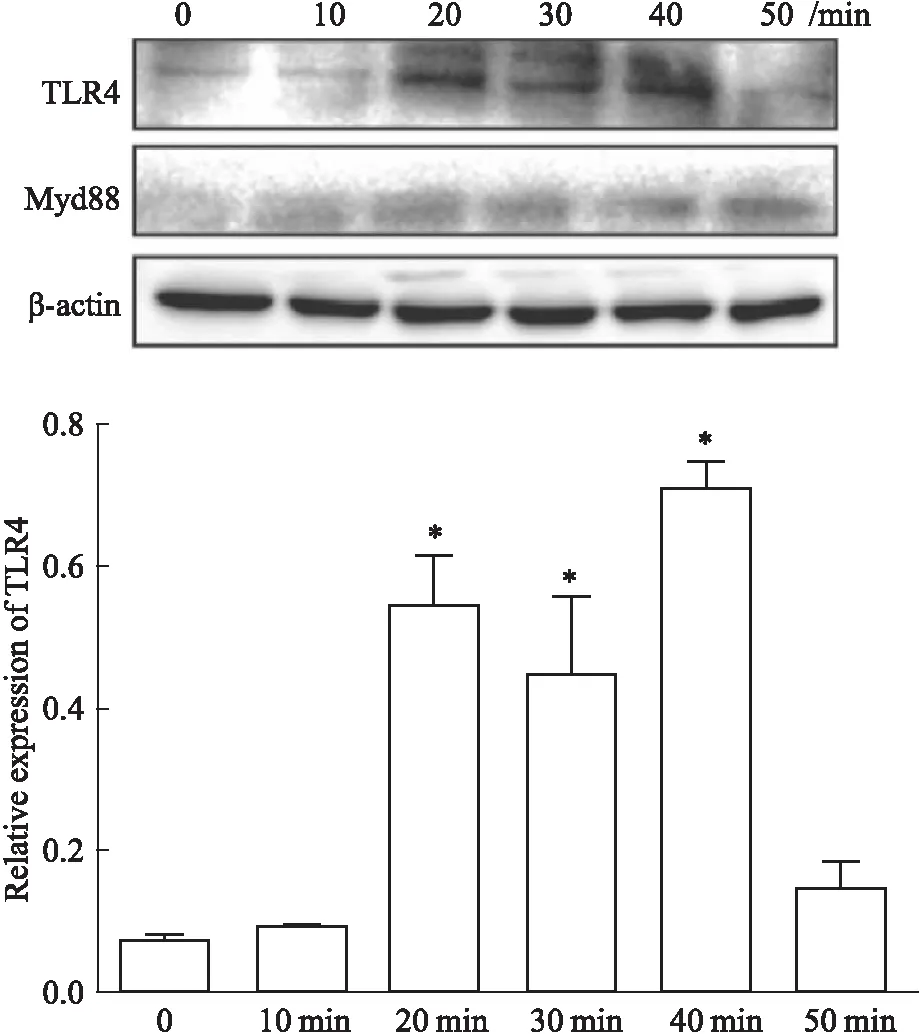
Fig 4 Expression levels of TLR4 and Myd88 in HMCs
2.5 TAK242部分阻断 HMGB1诱导的HMC中FN蛋白表达水平的上调Western blot结果显示,FN蛋白在HMGB1刺激组HMC中的蛋白表达水平较正常对照组明显上调;而与HMGB1刺激组相比,HMGB1+TAK242组HMC中FN蛋白表达水平下降(Fig 5)。
2.6 TAK242部分阻断HMGB1诱导的HMC培养上清中的FN表达水平的上调ELISA检测结果提示,HMGB1刺激组HMC培养上清中的FN水平较正常对照组明显升高;与HMGB1刺激组相比,HMGB1+ TAK242组HMC的培养上清中FN蛋白水平降低(Fig 6)。
2.7 TAK242部分阻断HMGB1诱导的HMC增殖水平的上调CCK-8结果显示,与对照组相比,HMGB1刺激组HMC的细胞增殖水平明显升高;与HMGB1刺激组相比,HMGB1+TAK242组HMC的细胞增殖水平下调(Fig 7)。
3 讨论
肾脏组织的病理学改变是肾功能损伤的形态基础,LN患者的肾脏病理表现多种多样,肾小球内皮细胞和系膜细胞过度增殖,基底膜纤维素样坏死,肾小球细胞外基质沉积,肾小管上皮细胞损伤等均参与了肾小球滤损伤的形成,其中肾小球细胞过度增生是LN活动期的主要肾小球病理学改变,细胞外基质沉积则是LN肾小球肾炎进展的终末阶段的主要表现之一[3],因此,本文旨在探明系膜细胞增生及细胞外基质沉积的发生机制,为LN的靶向治疗提供坚实的理论依据。

Fig 5 Expression of FN in HMCs detected
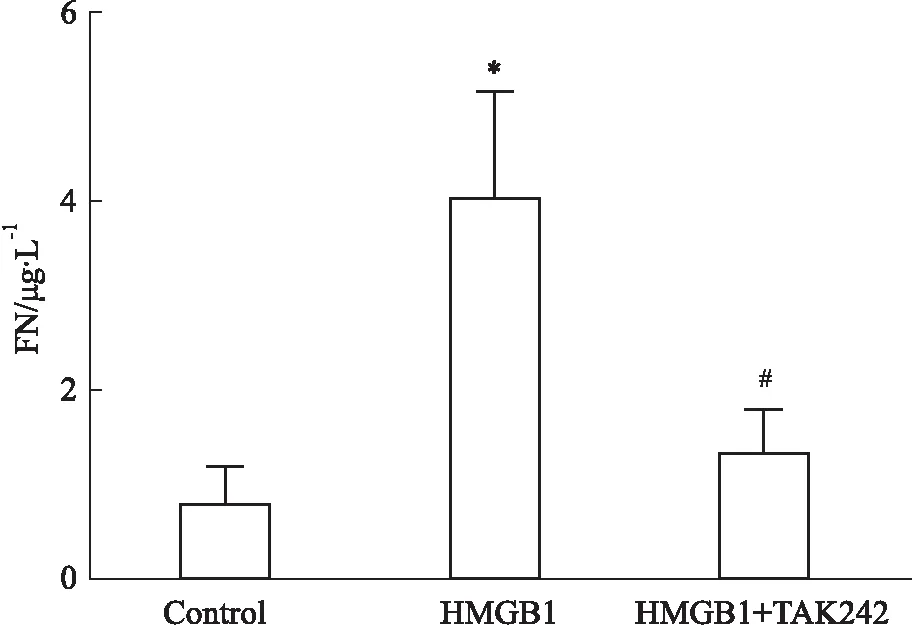
Fig 6 Expression of FN in culture supernatant of HMCs
我们的前期实验围绕着HMGB1在LN中的作用机制进行了探讨。HMGB1已被多项研究的证实可作为炎症因子或通过模式识别受体途径参与LN的进程,但其具体机制不明。研究证实[4],与无肾脏损伤的SLE患者相比,LN患者外周血和尿液中所分离的MPs中 HMGB1的表达均明显升高,且尿液中HMGB1的水平与SLEDAI评分呈正相关,研究还证实HMGB1在LN患者肾组织中细胞质的表达水平升高。我们在前期实验中[2,5]使用原位电转技术,降低MRL/lpr小鼠肾脏中 HMGB1蛋白表达水平,结果发现小鼠尿蛋白水平及肾脏病理改变减轻,肾小球细胞数目增多得到缓解,提示我们在LN发病过程中,HMGB1可能通过促进内皮细胞和系膜细胞增殖参与了蛋白尿的形成,在本实验中我们同样发现,HMGB1刺激HMC以后48H细胞的增殖水平增高。
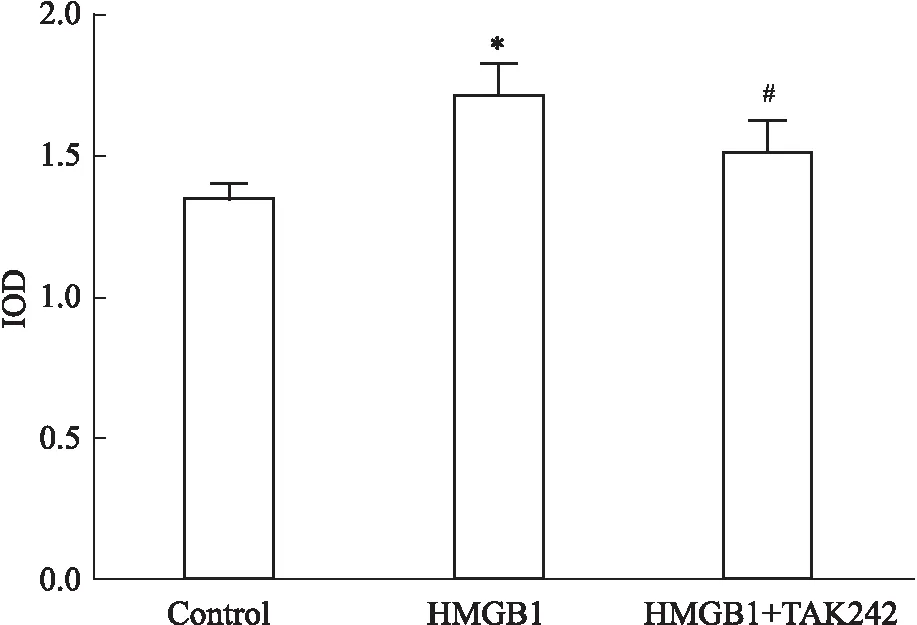
Fig 7 HMC proliferation detected by CCK-8
同时还有研究发现LNⅤ型患者尿液中HMGB1水平明显上调[6],提示了HMGB1细胞外基质沉积的可能关系,因此我们推测HMGB1可能还与LN发生中细胞外基质沉积相关。而ECM过度沉积是肾小球硬化发生的病理学基础,这可能是由Ⅳ型胶原蛋白(typeⅣ collagen,collagenⅣ)、纤连蛋白(fibronectin,FN)、蛋白多糖、糖胺聚糖等胶原蛋白和非胶原糖蛋白合成增多或降解减少造成的[7]。ECM过度沉积过程受到多种机制调控,如TGF-β[8]及IL[7]可作用于肾小球细胞,导致肾小球硬化,TGF-β还被证实介导细胞外基质的沉积。近年研究发现,HMGB1也与细胞外基质释放相关[9-10]。我们在本研究中首先使用LN患者置换血浆作用于HMC,结果发现,LN患者置换血浆可以上调人系膜细胞中的FN分泌,而当我们同时使用了甘草酸后,结果发现,LN患者置换血浆所诱导的FN表达和分泌增加的现象受到了部分抑制,因此我们考虑,HMGB1在LN发病过程中参与了系膜细胞FN的表达与分泌,我们考虑LN患者置换血浆中细胞因子种类繁多,除HMGB1外,其他细胞因子可能也参与这一过程,因此甘草酸的对LN患者置换血浆所引起的系膜细胞的FN蛋白的分泌仅表现部分抑制。接下来我们对HMGB1参与LN系膜细胞增殖和细胞外基质沉积的具体作用机制进行了探讨。
胞外的HMGB1需与其受体结合,以激活细胞内相关信号途径,参与其致炎作用[11]。我们的前期实验分别检测了LN患者肾组织相关受体的表达,结果发现,与癌旁远端正常组织相比,LN患者肾小球细胞中RAGE、TLR2、TLR4及TLR6的表达水平均出现不同程度的升高,我们推测,HMGB1通过与不同受体结合,激活不同信号通路,参与了LN进程中的多种病理性损伤。而以往研究发现TLR4可通过被其配体识别,进而通过髓样分化因子88(myeloid differentiation factor 88,Myd88)依赖性信号通路或非经典信号通路,Myd88通常通过IKKs激活NFkB,使其从细胞质转移至细胞核,最终引起大量炎性因子合成上调,最终打破细胞内促炎反应和抗炎反应的平衡。已有研究证实,TLR4通过激活KLF/NF-kB信号通路参与PA(palmitic acid)介导的脂肪细胞IL-1的分泌[12],HMGB1通过与RAGE或TLR2/TLR4结合参与Obstructive sleep apnea,OSA缺氧环境所诱导的肾损伤[13-16],TLR4抑制剂TAK242通过抑制HMGB1诱导的PASMCs的Ca2+通道的活化[10]。在本研究中,我们用TLR4抑制剂TAK242处理细胞,结果发现,与HMGB1处理组相比,系膜细胞培养上清中的FN蛋白表达水平降低,提示TLR4可能参与了HMGB1诱导的系膜细胞的细胞外基质沉积。而CCK8检测结果则提示TAK242能够改善HMGB1诱导的系膜细胞的过度增殖。由此我们得出结论,TLR4参与了HMGB1诱导的系膜细胞的过度增殖及细胞外基质沉积进程。
综上所述,在本研究中我们发现,LN患者外周血中可能存在HMGB1的过度分泌,而HMGB1蛋白可通过识别并结合与肾小球系膜细胞表面的TLR4受体结合,进而促进系膜细胞过度增殖,以及FN和Col Ⅳ等细胞外基质成分的沉积,从而介导了LN发病过程中肾小球细胞数目增多,肾小球硬化等病理进程。

