冠心病患者血浆miR-10a、miR-342-5p表达与炎性因子的关系及其预测价值
方填源,陈哲林,劳彩光,董德怀,余英滔
冠心病是指冠状动脉发生粥样硬化病变使血管腔狭窄、堵塞,继而引发心肌缺血缺氧甚至坏死所致的心脏病[1],随着经济的飞速发展及生活节奏的加快,冠心病发病逐渐年轻化且发病率呈不断增加趋势,对人类健康造成严重威胁。冠心病发病早期血管堵塞不严重,患者无明显临床症状,在病情尚未进展前及时诊治,对改善患者预后具有重要意义。动脉粥样硬化是冠心病病理基础,是由慢性炎性反应、免疫紊乱等因素相互作用所致的慢性炎性疾病,多种炎性因子参与其发生发展过程[2]。微小核糖核酸(miRNA)是长度17~25个核苷酸的单链小分子RNA,无编码蛋白质的功能,通过结合互补mRNA序列的3’-UTR以抑制miRNA的翻译或加速其降解,从而发挥对下游靶基因调控的作用,随着对分子生物学研究的不断深入,已经证实miRNA介导了心脑血管疾病、糖尿病、恶性肿瘤等疾病的发生发展过程[3]。研究表明[4-5],微小核糖核酸-10a(miR-10a)、miR-342-5p与多种恶性肿瘤发病密切相关,可作为预测疾病和判断预后的标志物。现分析miR-10a、miR-342-5p与冠心病发病的关系及其对冠心病的预测价值,报道如下。
1 资料与方法
1.1 临床资料 选取2016年8月—2019年2月广东省茂名市中医院心血管病科诊治的冠心病患者153例为观察组,其中男89例,女64例,年龄47~78(61.29±10.97)岁。根据临床分型分为急性心肌梗死(AMI)亚组61例,不稳定型心绞痛(UAP)亚组49例,稳定型心绞痛(SAP)亚组43例。根据纽约心脏病学会心功能分级(NYHA)[6],心功能Ⅱ级患者78例:病程1~7 (4.37±2.33)年;冠心病诱因:动脉粥样硬化47例,肥胖31例;基础疾病:高血压14例,糖尿病17例,高脂血症13例;家族遗传史29例。心功能Ⅲ级患者41例,病程3~9 (5.67±2.61)年;冠心病诱因:动脉粥样硬化24例,肥胖17例;基础疾病:高血压10例,糖尿病12例,高脂血症9例;家族遗传史16例。心功能Ⅳ级患者34例,病程3~10(6.38±2.99)年;冠心病诱因:动脉粥样硬化20例,肥胖14例;基础疾病:高血压11例,糖尿病7例,高脂血症7例;家族遗传史11例。随机选取同期在医院进行体检的健康志愿者100例为健康对照组,男63例,女37例,年龄43~75(59.22±11.68)岁。观察组与对照组性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。本研究获得医院伦理委员会批准,研究对象及家属知情同意并签署知情同意书。
1.2 病例选择标准 (1)纳入标准: ①所有患者均有典型临床症状,心电图、超声心动图等检查符合冠心病表现,经冠状动脉造影检查证实3支主要的冠状动脉或者其重要分支中,至少1支冠状动脉狭窄超过50%,并符合美国心脏病学会/美国心脏协会中关于冠心病诊断标准[7];②患者年龄≥18岁;③临床病历资料完整者。(2)排除标准: ①孕产妇及哺乳期妇女;②肝、肾功能障碍者;③血液系统疾病者;④急、慢性炎性反应性疾病者;⑤自身免疫性疾病者;⑥慢性阻塞性肺疾病患者;⑦恶性肿瘤患者;⑧其他可能影响本研究结果的疾病。
1.3 观察指标与方法 冠心病患者入院翌日晨、健康志愿者于体检当天抽取外周静脉血8 ml备用。
1.3.1 血浆miR-10a、miR-342-5p检测:上述静脉血4 ml加入EDTA抗凝剂试管中,在室温环境下静置,收集血浆装入EP管中,保存在-80℃环境,用于检测miR-10a、miR-342-5p的表达。
1.3.1.1 提取总RNA及反转录合成cDNA 使用血清总RNA提取试剂盒(miR-Neasy Serum/Plasma Kit)和RNA转录试剂盒(miScript II RT Kit)完成总RNA的提取和反转录(均购自德国凯杰公司),具体流程为:将血浆样本2 ml与Trizol溶液充分混匀后在室温下静置5 min,再将氯仿0.2 ml加入其中振荡,充分混匀、静置,提取总RNA。提取过程严格按照Trizol试剂盒说明书进行,Agilents RNA LabChip Bioanalyzer仪(ARLC&2100B,购自美国Agilent公司)验纯后反转录合成cDNA,设计反转录体系20 μl:RNA 1 μg ,2×RT mix 10 μl、oligo dNTPs 1 μl、 mix 2 μl、Random hexamers 1 μl,最后加入 RNase Free H2O 5 μl;反应条件:25℃ 5 min,50℃ 15 min,85℃ 5 min。
1.3.1.2 RT-qPCR法 利用PCR引物设计软件Primer Premier 5.0设计miR-10a、miR-342-5p引物序列,逆转录过程参照试剂盒说明书进行。U6为内参基因,上游引物序列为:5’-CTCGCTTCGGCAGCACA-3’,下游引物序列为:5’-AACGCTTCACGAATTTGCGT-3’;miR-10a上游引物序列为:5’-CGCACAAATTCGGATCTACAGGGTA-3’,下游引物序列为:5’-GTGCAGGGTCCGAGGT-3’;miR-342-5p上游引物序列为:5’-CTCAACTGGTGTCGTGG AGTCGGCAATTCAGTTGAGTCAATCAC-3’,下游引物序列为:5’-ACACTCCAGCTGGGA GGGGTGCTATCTGT-3’,miR-10a、miR-342-5p引物序列均由Invitrogen公司合成。于7500型实时荧光定量PCR仪(美国ABI公司)上进行PCR扩增: SYBR Premix Ex Taq II 10 μl, ROX Reference Dye II 0.4 μl, U6 Primer 1.6 μl, cDNA 2 μl, RNase Free H2O 6 μl;扩增条件:95℃持续10 s 变性,95℃持续5 s,60℃持续20 s,95℃持续1 min,55℃持续30 s,95℃持续30 s,60℃持续15 s,共40个循环;每个样本均设3个复孔后取平均值。miR-10a、miR-342-5p相对表达量采用2-△△Ct表示,△Ct=Ct(miR-10a/miR-342-5p)-Ct(U6),△△Ct=△Ct(miR-9/miR-34c)-△Ct(校准标本)[5]。
1.3.2 血清炎性因子检测:上述静脉血4 ml离心留取上清液装于EP管中,保存在-80℃环境下,用于检测炎性因子水平。采用酶联免疫吸附法检测血清白介素-6(IL-6)、IL-8、IL-10、高敏C-反应蛋白(hs-CRP)、肿瘤坏死因子-α(TNF-α)水平,试剂盒均由上海酶联生物公司提供,检测过程严格按照试剂盒说明书进行。
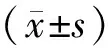
2 结 果
2.1 血浆miR-10a、miR-342-5p表达比较 各组(亚组)血浆miR-10a表达水平比较,AMI亚组
2.2 各组血清炎性因子水平比较 血清IL-6、IL-8、hs-CRP、TNF-α水平比较,AMI亚组>UAP亚组>SAP亚组>健康对照组(P均<0.05),而IL-10水平比较,AMI亚组

表1 各组血浆miR-10a、miR-342-5p表达水平比较
2.3 冠心病患者血浆miR-10a、miR-342-5p表达水平与血清炎性因子的相关性 经Pearson相关分析,冠心病患者血浆miR-10a表达水平与血清IL-6、IL-8、hs-CRP、TNF-α呈负相关,与IL-10呈正相关(P均<0.01);miR-342-5p与血清IL-6、IL-8、hs-CRP、TNF-α呈正相关,与IL-10呈负相关(P均<0.01),见表3。
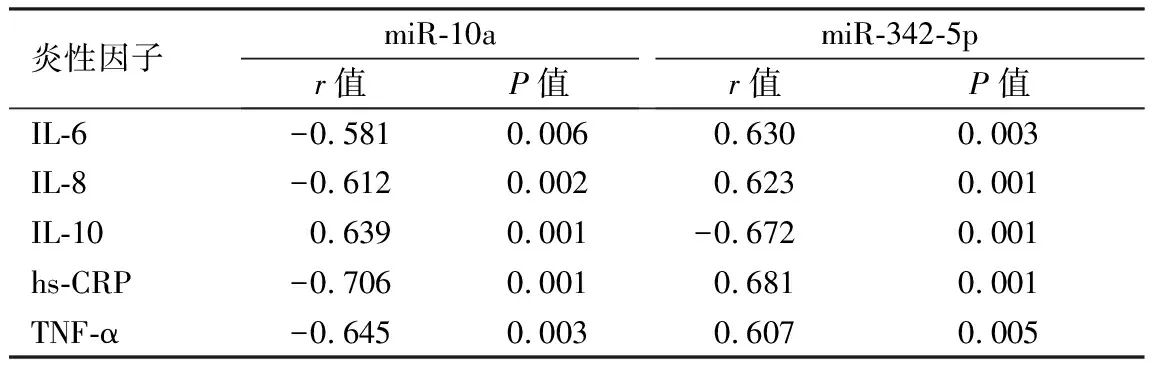
表3 冠心病患者血浆miR-10a、miR-342-5p表达水平与血清炎性因子的相关性
2.4 血浆miR-10a、miR-342-5p预测冠心病的价值 采用ROC曲线下面积(AUC)评估血浆miR-10a、miR-342-5p对冠心病的预测价值, miR-10a、miR-342-5p及miR-10a联合miR-342-5p预测冠心病的AUC分别为0.883(95%CI0.825~0.944)、0.892(95%CI0.836~0.949)、0.952(95%CI0.915~0.989),最佳截断值miR-10a为1.107,miR-342-5p为0.22,miR-10a、miR-342-5p敏感度、特异度、准确度分别为0.82、0.85、0.76、0.81、0.78、0.82、约登指数分别为0.58、0.66;miR-10a联合miR-342-5p预测冠心病的价值最大,敏感度、特异度、准确度为0.86、0.85、0.87,约登指数为0.71,见图1。

图1 血浆miR-10a、miR-342-5p预测冠心病的ROC曲线
3 讨 论
冠心病是严重威胁人类健康的重大疾病,据WHO估计,全球每年约2.5亿人患心血管疾病,其中冠心病将会成为患者致残和致死的首位原因[8]。我国是心血管疾病高发国家,截至2012年,我国心血管疾病发病人数高达2.9亿人,死亡人数每年约350万人[9-10]。早期发现和诊断冠心病,并及时评估患者的病情严重程度,对临床制定针对性干预措施、改善患者病情具有积极意义。
随着科技的不断进步,从分子生物学角度探索疾病的诊断和治疗靶点成为近几年的研究热点。miRNA是广泛存在于血液、尿液中的非编码小分子RNA,转录后能特异性结合靶mRNA 3’端的非翻译区而抑制靶mRNA翻译,特异性结合靶mRNA 5’端可激活靶mRNA的表达[11]。miRNA参与了机体各种生理过程,如细胞增殖、分化、凋亡,机体的生长发育、脂肪代谢及器官形成等,病理状态下,miRNA异常表达通过介导机体炎性反应、氧化应激反应等环节而参与疾病的发生发展[12]。研究显示[13-14],miRNA作为抑癌基因和促癌基因参与调控恶性肿瘤的发生发展过程,并且与疾病临床病理特征密切相关,可作为预测恶性肿瘤及评估预后的重要生物标志物。另有研究发现[15],miRNA异常表达在类风湿性关节炎等炎性反应性疾病发病过程中通过调控炎性因子水平参与疾病的进展。并且,较传统生化标志物而言,外周血中miRNA检测具有无创性,预测疾病具有较高的敏感度和特异度,可见miRNA用于预测疾病和评估病情严重程度具有诸多优势。

表2 冠心病患者与健康对照组血清炎性因子水平比较
miR-10a是位于17号染色体上的一种重要miRNA,研究显示,miR-10a表达上调介导了子宫内膜癌、胰腺癌等恶性肿瘤的发病过程[16-17]。杨海等[15]证实,miR-10a在类风湿性关节炎细胞和滑膜组织中表达下调,并通过影响NF-κB通路的活化而与类风湿性关节炎成纤维细胞样滑膜细胞的侵袭、迁移有关。关于miR-10a在心脏病发病过程中的作用,目前相关研究较少。miR-342属于一种miRNA,其基因位于Evl基因的第三个内含子区,在生物合成过程中分别形成miR-342-3p和miR-342-5p,其中miR-342-5p已被证实参与了乳腺癌、结肠癌等恶性肿瘤的发病过程[18-19]。Natarelli等[20]发现miR-342-5p具有保护心肌细胞的作用,长期锻炼的人动脉血管会分泌miR-342-5p并将其运送至心脏,通过保护心肌细胞免受损伤而减少心肌梗死发生风险。基于以上不足,本研究旨在探讨miR-342-5p、miR-10a在冠心病发病过程中的作用。
本结果显示,不同类型和不同心功能分级冠心病患者血浆miR-10a表达水平均低于健康对照者,miR-342-5p表达水平高于健康对照者,随着病情的加重,miR-342-5p、miR-10a表达异常显著,提示血浆miR-10a、miR-342-5p参与了冠心病的发病过程,并可作为评估病情严重程度的重要指标,与既往报道结果基本一致[20-21],原因主要可能与miR-10a、miR-342-5p及炎性因子在冠心病患者机体中的作用机制有关,miR-10a、miR-342-5p可通过激活机体氧化应激反应,参与 NF-κB 通路的信号传导,最终引起心肌缺血再灌注导致的神经损伤。冠状动脉粥样硬化斑块不稳定破裂或脱落堵塞血管腔或者使其变狭窄,心肌缺血缺氧导致冠心病,而巨噬细胞吞噬氧化型低密度脂蛋白后所致的炎性反应是粥样硬化斑块形成的病理基础,miR-10a可调控脂质的摄入及抑制炎性因子的分泌,当其水平降低时脂质紊乱、炎性因子分泌过多,炎性反应加重,最终促进了冠心病的发生发展[21-22]。miR-342-5p通过抑制Caspase-9及Jnk2蛋白表达而促进细胞凋亡,加速心肌死亡而致心肌梗死[23]。冠心病发生过程中存在持续性炎性反应,大量炎性因子不断分泌和释放。IL-6、IL-8、hs-CRP、TNF-α是促炎因子,可反映炎性强度,其水平越高提示炎性反应越重,IL-10为抑制炎性反应的标志物,其水平升高提示炎性反应减弱,与李志等[24]报道一致,但在该研究中并未发现UAP患者血清IL-8、IL-10水平与AMI患者有差异,这可能与该研究选取的样本量较小有关。本研究发现,随着冠心病病情严重程度增加,促炎因子水平显著升高,抑炎因子水平降低,提示冠心病病情严重程度与炎性反应密切相关。
相关性分析结果显示,冠心病患者血浆miR-10a、miR-342-5p表达水平与血清IL-6、IL-8、IL-10、hs-CRP、TNF-α呈不同程度相关性,提示miR-10a、miR-342-5p可能通过介导炎性反应而参与冠心病发生、发展过程。miR-10a可促进血管形成、增生,调节脂质代谢,其表达水平下调可致促炎因子水平升高及抗炎因子表达下降,激活NF-κB信号通路,促进心肌细胞凋亡。miR-342-5p通过介导炎性反应过程可抑制Akt1蛋白磷酸化,损伤心肌细胞。ROC结果显示,miR-10a、miR-342-5p预测冠心病具有较高的价值,AUC分别为0.883、0.892,敏感度和特异度接近。而两者联合预测的AUC为0.952,敏感度、特异度分别为0.86、0.85,提示联合检测更可提高临床辅助预测冠心病的诊断效能。
综上所述,血浆miR-10a、miR-342-5p异常表达通过介导炎性反应而参与冠心病的发病过程,并与病情严重程度密切相关,早期联合检测可作为辅助预测冠心病的重要生化指标。
利益冲突:所有作者声明无利益冲突
作者贡献声明
方填源:设计研究方案,实施研究过程,论文撰写;陈哲林:提出研究思路,分析试验数据,论文审核;劳彩光:进行统计学分析;董德怀、余英滔:实施研究过程,资料搜集整理

