SHH信号通路激活对大鼠心脏微血管内皮细胞缺血再灌注损伤血管再生作用研究
国伟,杨军,任法新,梁平平
心肌缺血再灌注损伤(myocardial ischemic-reperfusion injury,MIRI)是心肌长时间缺血重新恢复血液灌注后出现的一种损伤,其特点是更为明显和严重的损害或功能障碍,包括心肌收缩功能障碍、冠状动脉血流和血管反应性的变化。目前关于心肌缺血再灌注损伤的发病机制尚不完全清楚,也无预防及治疗的有效药物[1-2]。因此,探讨MIRI的深层发病机制和临床研发靶向治疗药物具有重大意义。近年来,SHH(sonic hodgehog)信号通路对心血管系统疾病的影响越来越受到人们的重视,其为探索保护心肌细胞功能提供了新的作用靶点[3]。研究还发现,SHH信号通路参与了多种缺血动物模型中的血管再生,包括脑、角膜、骨骼肌缺血及肢体缺血模型等[4-5]。然而,SHH信号通路在心肌缺血再灌注损伤中的研究很少。基于此,现探讨SHH信号通路激活对微血管内皮细胞(CMECs)缺血再灌注损伤促进血管再生的潜在作用,报道如下。
1 材料与方法
1.1 材料 (1)实验动物: SD大鼠(雄性),月龄1月,体质量100~150 g,购于山东大学实验动物中心,动物许可证号SCXK(鲁)2016-0016,标准饲养,日常光照,自然饮水。 (2)试剂:10% FBS 的DMEM 培养液购于美国Invitrogen公司,无L-谷氨酰胺DMEM培养基,胰蛋白酶,Cyclopamin购于美国Sigma-Alidrich公司,重组人SHH蛋白购于美国Cambridge公司,ELISA试剂盒购于武汉Antigene公司,Trizol试剂盒购于美国Invitrogen公司,SMA 400 UV0VIS购于上海Merinton公司,BCA蛋白检测试剂盒购于美国Rochford公司,TM型cDNA合成试剂盒购于美国Bio-Rad公司。(3)仪器:全自动酶标仪(日本Olympus公司,型号AU400), Bio-Image(Bio-Rad)图像分析软件。
1.2 实验方法 2016年7月—2017年2月于青岛大学附属烟台毓璜顶医院进行实验。
1.2.1 大鼠原代心脏微血管内皮细胞培养:参照参考文献[6],CMECs来源于SD雄性大鼠心脏组织,大鼠腹腔内注射0.1%戊巴比妥钠(2 ml/100 g)麻醉,无菌条件下迅速取出心脏,并用PBS液洗净3遍,去除大血管、瓣膜及结缔组织,剪去右心室和左、右心房,将左心室浸泡在75%酒精中10 s,然后将心肌组织剪碎成块,1 mm3大小,并加入0.025%胰酶水浴(温度37℃)中消化10 min,再用100 mm尼龙网滤除未消化左心室心肌组织,继而用含10% FBS的DMEM 培养液将沉淀反复混匀,然后用1 ml的吸管软柔吹打3次。将所得左心室细胞悬液接种在培养瓶中,于37℃,5%CO2孵箱中培养,6 h后倒出培养液去掉未贴壁的平滑肌细胞、成纤维细胞等,再加入含10%FBS的DMEM培养液继续培养,孵育48 ~72 h后更换1次培养液,获取原代细胞。
1.2.2 实验分组及干预措施:选取培养7 d的CMECs建立体外氧糖剥夺/复氧(OGD/R)损伤模型用以模拟心肌缺血再灌注损伤,参照文献[7]具体操作如下:CMECs用PBS缓冲液反复冲洗,然后在无血清培养基的OGD条件下培养,并置于无糖或无L-谷氨酰胺DMEM培养基,在37℃、5%CO2氧糖剥夺条件下培育CMECs 1 h;再从缺氧条件下取出CMECs培养板,用PBS缓冲液洗3 次,然后在正常氧条件下孵育CMECs 1.5 h。
实验分组: (1)正常对照组(Control,C组):CMECs不给予任何外部因素处理;(2)C+SHH组:CMECs在正常氧条件下孵育1 h后,加入人重组SHH蛋白3 μg/ml正常孵育1.5 h;(3)C+CYC(环杷明,Cyclopamine, CYC)组:CMECs在正常氧条件下孵育1 h后,加入CYC(SHH信号通路抑制剂)20 μmol/L正常孵育1.5 h; (4)OGD组:CMECs给予OGD/R,即缺血1 h,再灌注1.5 h;(5) OGD+SHH组:CMECs缺血1 h后,加入含人重组SHH蛋白3 μg/ml的再灌液再灌注1.5 h;(6)OGD+CYC组:CMECs缺血1 h后,加入含CYC 20 μmol/L的再灌液再灌注1.5 h。
1.3 观察指标与方法
1.3.1 MTT法测定CMECs细胞活力:CMECs以5×104/ml细胞密度接种在96孔板上,每孔200 μl。细胞以SHH蛋白(3 μg/ml)、CYC(20 μmol/L)处理后各组在相应正常氧或OGD/R条件下孵育48 h,然后以12 000 r/min离心去除上清液。每个孔再加入MTT 20 μl并培养4 h,继而每个孔加入二甲基亚砜(DMSO) 150 μl震荡混匀10 min;使每个孔的细胞结晶物得到充分溶解后,再用全自动酶标仪在波长为570 nm处测定各个孔的吸光度值(OD值)。
1.3.2 ELISA法测定血清血管新生因子VEGF、FGF和Ang-1水平:将50 μg/ml的VEGF、 FGF和Ang-1抗体涂在预处理的微孔板上,置37℃水浴箱中温育2 h。4℃孵化过夜后,微孔板用含0.05% Tween-20 (PBST) 的PBS缓冲液反复冲洗3遍,封闭在5%山羊血清PBST中1 h。然后样本用含10%小牛血清和5%山羊血清的PBST按1∶100稀释,再用辣根过氧化物酶(HRP)标记的羊抗鼠IgG在37℃水浴箱中孵育2 h。最后,用1 mol/L硫酸溶液终止反应,并用酶标仪测定492 nm吸光度值。
1.3.3 RT-PCR法测定血管生长因子VEGF、FGF和Ang-1 mRNA表达水平:各项干预结束后,提取细胞总RNA,参照RT-PCR试剂盒说明书进行逆转录反应。遵循SYBR Green荧光染料技术(SYBR Green Master mix; Thermo Scientific, Waltham, MA, USA)进行实时定量PCR反应,从而获取各组标本的标准曲线,在每一次聚合酶链反应结束时进行扩增产物的标准曲线分析,确认只有一个样品被扩增和检测。其中,磷酸甘油醛脱氢酶(GAPDH)为内参。计算机自动分析Ct值。Ct值为每个反应管内荧光强度达到系统设定的有目的DNA合成时经历的循环数。mRNA表达的差异采用相对定量法比较, 即以2-△△Ct表示待测标本的相对mRNA水平,其中△Ct =(目的基因Ct值-看家基因平均Ct值)。
1.3.4 Western-blot检测SHH、SMO、Patched-1、Gli-1和Gli-2蛋白表达:用M-PER哺乳动物蛋白裂解液提取细胞蛋白,在临用前加入以下试剂: DTT 0.5 mmol/L,PMSF 0.5 mmol/L,aprotinin 10 μg/ml,12 000 r/min离心15 min弃去沉淀,测定蛋白浓度,每组取30 μg进行Western-blot检测。以GAPDH为内参,采用Bio-Image(Bio-Rad)图像分析软件对每个条带采集信号并分析。目的蛋白相对表达量=目的蛋白IA值/内参蛋白IA值。其中,条带测定值以积分吸光度值(IA)表示。
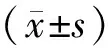
2 结 果
2.1 各组CMECs细胞活力比较 与C组 CMECs细胞活力(0.86±0.12,n=10)比较, C+SHH组CMECs细胞活力(1.21±0.45,n=10)显著增加(t=1.996,P<0.05),C+CYC组(0.64±0.19,n=10)显著降低(t=1.988,P<0.05);与C组细胞活力比较,OGD组细胞活力(0.41±0.07,n=10)显著减弱(t=1.972,P<0.05);与OGD组细胞活力比较,OGD+SHH组(0.83±0.10,n=10)显著增加(t=2.004,P<0.05),OGD+CYC组(0.23±0.05,n=10)显著降低(t=2.212,P<0.05),见图1。

注:与C组比较,a P<0.05;与 OGD组比较,b P<0.05
2.2 各组血清血管新生因子VEGF、FGF、Ang-1蛋白水平(pg/ml)比较 与C组血清VEGF、FGF和Ang-1水平(71.23±3.57,50.36±2.18,62.48±3.03,n=10)比较,C+SHH组(108.50±6.05,118.95±6.47,125.71±6.92,n=10)显著增加(t=1.990,2.072,2.001,P<0.05),C+CYC组(50.06±2.73,32.42±1.95,41.59±2.04,n=10)显著降低(t=7.435,5.969,3.826,P<0.01);与C组血清VEGF、FGF和Ang-1水平比较,OGD组(35.19±2.01,15.47±0.94,20.86±1.27,n=10)显著降低(t=10.009,7.763,8.684,P<0.01);与OGD组血清VEGF、FGF和Ang-1水平比较,OGD+SHH组(69.85±3.26,48.45±2.20,63.24±3.15,n=10)显著增加(t=12.394,10.871,8.375,P<0.01),OGD+CYC组(24.83±1.58,8.13±0.51,8.90±0.68,n=10)显著降低(t=2.128,2.003,2.370,P<0.05),见图2。
2.3 各组血管新生因子VEGF、FGF、Ang-1 mRNA表达比较 与C组VEGF、FGF和Ang-1的mRNA表达水平(1.00±0.05,1.00±0.06,1.00±0.04,n=10)比较,C+SHH组(1.52±0.64,1.68±0.53,1.76±0.75,n=10)显著增加(t=2.043,2.125,1.990,P<0.05),C+CYC组(0.86±0.51,0.74±0.48,0.82±0.49,n=10)显著降低(t=3.507,4.427,3.072,P<0.01);与C组VEGF、FGF和Ang-1的mRNA表达水平比较,OGD组(0.43±0.27,0.40±0.23,0.48±0.28,n=10)显著降低(t=8.462,4.017,3.002,P<0.01);与OGD组VEGF、FGF和Ang-1的mRNA表达水平比较,OGD+SHH组(1.36±0.58,1.25±0.50,1.28±0.55,n=10)显著增加(t=5.760,7.396,9.088,P<0.01),OGD+CYC组(0.31±0.09,0.33±0.07,0.30±0.05,n=10)显著降低(t=1.973,2.016,1.992,P<0.05),见图3、4。
2.4 各组SHH信号通路相关蛋白表达比较 与OGD组SHH、SMO、Patched-1、Gli-1、Gli-2的蛋白表达水平(1.00±0.34,1.00±0.36,1.00±0.39,1.00±0.37,1.00±0.43,n=10)比较,OGD+SHH组SHH信号通路相关蛋白表达水平(2.46±0.42,2.09±0.45,2.24±0.56,1.56±0.39,2.13±0.47,n=10)显著增加(t=4.517,3.007,3.472,3.726,4.988,P<0.01);OGD+CYC组(0.59±0.15,0.55±0.17,0.53±0.14,0.72±0.11,0.46±0.09,n=10)显著降低(t=18.978,19.034,17.152,14.747,16.273,P<0.01),见图5、6。
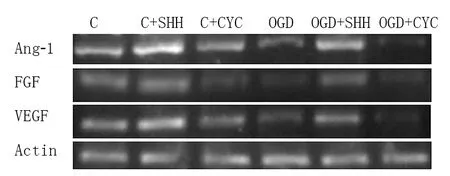
图4 不同组别CMECs中VEGF、FGF、Ang-1的mRNA表达

图6 各组SHH、Patched-1、SMO、Gli-1、Gli-2的蛋白表达比较
3 讨 论
SHH在人体组织细胞中分布最为广泛,参与基因转录、调节细胞因子和功能蛋白表达,在调控胚胎生长发育、血管新生、肿瘤细胞增殖等方面有极其重要的作用[8-10]。在大鼠脑缺血动物模型中,研究发现脑缺血使SHH信号通路发生激活,给予该信号通路特异性抑制剂Cyclopamine后,却进一步加重了脑缺血后神经功能的损伤,同时也加重了脑梗死面积及脑水肿的程度[11]。心肌缺血时,SHH的表达水平增加,促进骨髓来源的内皮祖细胞诱发血管生成,促进血管内皮细胞生长因子和血管生成素的表达增多[12]。但是SHH信号通路对心肌缺血再灌注损伤的影响及其机制的研究却鲜有报道。 梁关凤等[13]研究发现,激活SHH通路可抑制ATM磷酸化改善缺血缺氧诱导的心肌细胞DNA损伤,促进DNA损伤修复,抑制细胞凋亡。本研究表明,在OGD/R条件下,加入外源性重组人SHH蛋白后,CMECs的细胞活力显著增加,同时,血清血管新生相关因子VEGF、FGF和Ang-1蛋白水平和mRNA表达也显著增加;并且SHH信号通路下游信号蛋白SHH、SMO、 Patched-1、Gli-1和Gli-2的蛋白表达水平也显著增加,但上述指标均可被SHH信号通路的特异性抑制剂Cyclopamine所抑制。因此,本研究初步揭示了SHH信号通路在CMECs缺血再灌注损伤后血管再生中发挥着重要作用。近年来众多研究表明,SHH信号通路在各种组织和器官的血管再生过程中发挥着至关重要的作用,并且发现可能是通过SHH/SMO/Gli通路、磷酸肌醇3-激酶通路及Coup-TFII通路3种途径来实现其对血管再生的调控[14]。但到目前为止,对于SHH信号通路在血管再生中的具体作用机制仍不十分清楚。本实验研究证实,加入外源性重组人SHH蛋白可能通过激活SHH-Patched-SMO-Gli信号通路发挥促血管再生作用,从而对CMECs缺血再灌注损伤起到保护功能。

注:与C组比较,a P<0.05,b P<0.01;与OGD组比较,c P<0.05,d P<0.01

注:与C组比较,a P<0.05,b P<0.01;与 OGD组比较,c P<0.05,d P<0.01
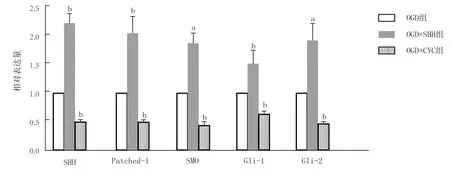
注:与OGD组比较,a P<0.05,b P<0.01
VEGF是作用于内皮细胞糖基化的有丝分裂原,有多种生物学效应,包括介导血管内皮通透性增加,促进血管新生和抑制细胞凋亡等。Ang-1是促进血管形成与成熟的重要血管新生因子。FGF具有广泛的有丝分裂和细胞生存活力,并且参与了多种生物学过程,包括细胞生长、肿瘤生长和侵袭。Infante等[15]在角膜和后肢缺血模型中研究SHH激活对血管生成的影响时,发现加入外源重组人SHH蛋白会使成年小鼠血管和心脏的Patched-1表达增多,并促使多种血管新生因子(如VEGF、Ang-1和Ang-2)表达的上调。Spence等[16]在研究鸡胚胎视网膜的血管再生情况时发现,SHH信号通路激活可以导致FGF表达增多。Omitz等[17]研究发现,SHH可以通过激活硫酸乙酰肝素蛋白聚糖(一种细胞外基质蛋白,HSPGs)促使bFGF表达上调,继而发挥保护心肌免受缺血损伤的功能。本研究结果发现,加入外源性重组人SHH蛋白可以激活SHH信号通路,从而进一步上调血管新生因子VEGF、 FGF和Ang-1在CMECs缺血再灌注损伤后的表达,继而发挥促进血管新生的重要作用。但是SHH信号通路在CMECs缺血再灌注损伤后如何调控血管新生因子VEGF、FGF和Ang-1的表达,以及其调控血管新生的潜在具体分子生物学机制仍需以后实验进一步研究。
综上所述,SHH信号通路激活可以通过增强细胞活力,上调血清血管新生相关因子VEGF、FGF和Ang-1的表达,从而在缺血再灌注损伤CMECs血管再生过程中起重要作用。随着科学研究的进一步深入,SHH信号通路很有可能成为治疗人类心血管系统疾病的一个崭新的突破,将为心肌缺血后的功能恢复提供重要理论依据和新的方法指导。
利益冲突:所有作者声明无利益冲突
作者贡献声明
国伟:设计研究方案,实施具体研究过程,分析实验数据,论文撰写;杨军:提出研究思路,论文审核;任法新、梁平平:实施研究过程,修改论文

